https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html



























































https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
об’ємом 2–3 мл (Б). Поміркуйте, чи спостерігаємо
1. Виділення газу (CO₂) — видно бульбашки на зображенні В.
2.Утворення нових речовин — натрій ацетат (сіль), вода та вуглекислий газ.
3.Неможливість простим способом повернути початкові
відновляться самі знову).
Отже, це саме хімічна реакція.
Сторінка 11
Поміркуйте Хімічна
CH3COONa,
3COONa + CO2 + H2O = NaHCO3 + CH3COOH
наведене рівняння складене
Правильно: NaHCO3 + CH3COOH → CH3COONa + CO2↑ + H2O
Досліджуємо, моделюємо, проєктуємо Мідну пластинку
пальника. Поміркуйте, які
2.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
1. Насамперед
брязкальця. 231,0 19,25 = 211,75 г
2. Науковець обчислив об'єм
який було видано ювелірові.
■ Обчисліть об'єм бруска та
,c = 3,0 см. Об’єм: V = a ⋅ b ⋅ c = 2 2 3 = 12 см3 Густина: ρ = ���� ���� = 231 12 = 19,25
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
посуд. – Уникати вдихання або потрапляння речовин
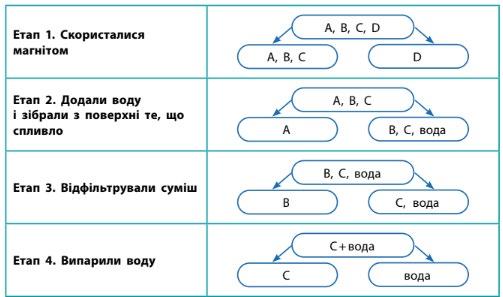
Визначте літери, якими позначено кожен компонент
A – деревна тирса (спливає на поверхні води).
B – глина (залишається нерозчиненою у воді).
C – кухонна сіль (розчиняється у воді). shkola.in.ua
D – залізні ошурки (відділяються магнітом).
Для кожного етапу зазначте суміш (однорідна
та Андрій.
– Етап 1 (Скористалися магнітом):
Суміш: (A, B, C, D)
Вилучили D (залізні ошурки).
Суміш після відділення: (A, B, C)
Характеристика: Неоднорідна суміш.
– Етап 2 (Додали воду, зібрали те, що спливло):
Суміш: (A, B, C, вода)
Вилучили A (деревна тирса), бо вона спливла.
Суміш після відділення: (B, C, вода)
Характеристика: Неоднорідна суміш.
– Етап 3 (Відфільтрували суміш):
Суміш: (C, D, вода)
Вилучили D (глина), бо вона не розчиняється. Суміш після відділення: (C + вода)
4 (Випарили воду):
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
shkola.in.ua
Сторінка
6.
папером. Порівняти кількість
хорошого горіння.
2. Вогонь кочерги не боїться. Це, скоріше,
Як перевірити: Наукова перевірка
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
shkola.in.ua
Як перевірити: Проаналізувати звіти
ГМО-культур на біорізноманіття, забруднення ґрунтів і використання
елементами.
Наприклад: shkola.in.ua
NaCl — натрій хлорид
CaS — кальцій сульфід (кальцій + сульфур).
Отже, якщо
Сторінка
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Стибій тощо). shkola.in.ua
Тобто:
розташовані
Якщо елемент стоїть у 1-й або 2-й групі (крім Гідрогену) → це метал.
Якщо він у 15–17 групах (наприклад, N, O, F, Cl, S) → це неметал.
Якщо він у 13-й групі (Al, Ga) → це метал, але з особливостями.
18-та група — інертні гази (не утворюють йонів).
Сторінка 23
Досліджуємо, моделюємо, проєктуємо
- складання формули речовини за її назвою;
1. Записати символи катіона й аніона. shkola.in.ua
2. Визначити їхні заряди за періодичною таблицею.
3. Добрати індекси так, щоб сумарні
4. Записати формулу (спочатку катіон, потім аніон). - визначення зарядів катіона й
1. Визначити,
2.
NaCl, H₂O, CO₂.
Бертоліди – це сполуки, у яких склад не є сталим, співвідношення
CaCl₂: Ca²⁺ + 2Cl⁻ → (+2) + 2(–1) = 0.
у Al₂S₃: 2Al³⁺ + 3S²⁻ → 6(+) + 6(–) = 0.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
shkola.in.ua
bis — «двічі»). Поясніть значення термінів
виразу «зіграти щось на біс».
Бінарна сполука — речовина, утворена
з двох символів (0 і 1). «Зіграти на біс» — виконати ще
а) H₂S – гідроген сульфід (сірководень)
б) K₂S – калій сульфід
в) BaF₂ – барій фторид
г) AlI₃ – алюміній йодид
д) Mg₃P₂ – магній фосфід
е) Na₃N – натрій нітрид
ж) Na₂O – натрій оксид
и) K₃P – калій фосфід shkola.in.ua
У всіх формулах індекси підібрані
12. Запишіть систематичні
K₂O – калій оксид
Al₂S₃ – алюміній сульфід
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Амоніак — NH₃ (Гідроген + Нітроген)
Фосфін — PH₃ (Гідроген + Фосфор)
Арсин — AsH₃ (Гідроген + Арсен)
Стибін — SbH₃ (Гідроген + Стибій) shkola.in.ua
Тут за традицією
Сторінка 25
Поміркуйте
shkola.in.ua
Приклад:
H₂O → 2×Ar(H) + 1×Ar(O) = 2×1 + 16 = 18.
Сторінка 30
Робота з інформацією
одиниць вимірювання: берковець, пуд, гривня
Берковець ≈ 163,8 кг
Пуд = 16,38 кг
Гривня ≈ 409 г shkola.in.ua
Золотник ≈ 4,27 г Ці стародавні міри ваги
одиницею стала кілограм.
Сторінка 31
16. Випишіть із періодичної
Al — Алюміній, Ar ≈ 27
F — Флуор, Ar ≈ 19
Zn — Цинк, Ar ≈ 65
Ag — Аргентум, Ar ≈ 108
Sn — Станум, Ar ≈ 119
17. Дізнайтеся,
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
H = 1, He = 4, N = 14, O = 16, S = 32, Si = 28, Fe = 56, Cu = 64
(14) –
(4)
(16) – Сульфур (32)
Ферум (56) – Силіцій (28)
Сульфур (32) – Купрум (64)
19. Обчисліть, скільки атомів Оксигену
Ar(O) = 16
Ar(Cu) = 64 shkola.in.ua
Обчислення: 64 : 16 = 4
Відповідь:
CaSO4; е)
крейди CaCO3; ж) малахіту (CuOH)2CO3.
(H = 1, C = 12, O = 16, S = 32, Cl = 35, Ca = 40, Cu = 64):
а) Cl₂ = 2×35 = 70
б) H₂SO₄ = 2×1 + 32 + 4×16 = 2 + 32 + 64 = 98
в) C₁₂H₂₂O₁₁ = 12×12 + 22×1 + 11×16 = 144 + 22 + 176 = 342
г) Cu = 64 shkola.in.ua
д) CaSO₄ = 40 + 32 + 4×16 = 40 + 32 + 64 = 136
е) CaCO₃ = 40 + 12 + 3×16 = 40 + 12 + 48 = 100
ж) (CuOH)₂CO₃ = 2×(64 + 16 + 1) + (12 + 3×16) = 2×81 + (12 + 48) = 162 + 60 = 222.
Відповідь: а) 70; б) 98; в) 342; г) 64; д) 136; е) 100; ж) 222. 21. Запишіть формули
натрій хлориду; б)
нітроген(ІІІ) оксиду.
H = 1, C = 12, O = 16, N = 14, Na = 23, Cl = 35, Ca = 40, Br = 80, Pb = 207, I = 127, Al = 27.
а) NaCl = 23 + 35 = 58
б) CaBr₂ = 40 + 2×80 = 40 + 160 = 200
в) PbI₂ = 207 + 2×127 = 207 + 254 = 461
г) Al₂O₃ = 2×27 + 3×16 = 54 + 48 = 102
д) N₂O₃ = 2×14 + 3×16 = 28 + 48 = 76 shkola.in.ua
Відповідь: а) 58; б) 200; в) 461; г) 102; д) 76.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Mr(HO) = 1 + 16 = 17.
Mr(H₂O₂) = 2 × 17 = 34.
34 : 17 = 2, отже у молекулі по два атоми Гідрогену й Оксигену.
Відповідь: формула перекису водню — H₂O₂.
23. Мінерал пірит складається з двох хімічних елементів — Феруму та
має відносну формульну масу 120. Визначте хімічну формулу цієї речовини.
1. У піриті є Ферум (Fe, Ar = 56) і Сульфур (S, Ar = 32).
2. Спробуємо скласти просту формулу.
FeS: Mr = 56 + 32 = 88 (замало). shkola.in.ua
FeS₂: Mr = 56 + 2×32 = 56 + 64 = 120.
Відповідь: формула піриту — FeS₂.
24. Формула жасмоналю, який зумовлює запах квітів жасмину, C6H5CHC(C5H11)CHO.
Обчисліть його відносну молекулярну масу.
Підрахуємо кількість атомів: C = 14, H = 18, O = 1.
Mr = 14 × 12 + 18 × 1 + 16 = 168 + 18 + 16 = 202.
Відповідь: Mr(C₁₄H₁₈O) = 202.
Сторінка 32
Розуміння явищ природи (робота в групах)
25. За малюнками визначте, чи справді
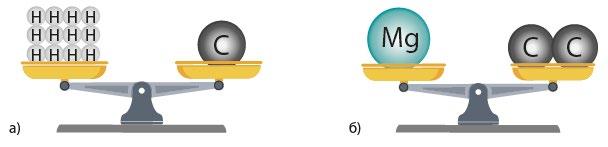
а) Ліворуч 12 атомів Гідрогену (Ar(H) = 1).
Сума: 12 × 1 = 12.
Праворуч 1 атом Карбону (Ar(C) = 12).
12 = 12 → терези врівноважені. shkola.in.ua
б) Ліворуч 1 атом Магнію (Ar(Mg) = 24).
Праворуч 2 атоми Карбону (2 × 12 = 24).
24 = 24 → терези врівноважені.
26.

Mr(H₂O) = 2×1 + 16 = 18.
3×18 = 54.
H₂O.
Права шалька — 2 молекули CO₂.
Mr(CO₂) = 12 + 2×16 = 44.
2×44 = 88. shkola.in.ua
54 < 88,
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
shkola.in.ua
формулою.
Сторінка 36
Робота з інформацією
27.
а) NO2;
Відомо: NO2 Розв’язання: Обчислимо відносну
ω(����) — ?
ω(O) — ?
б) PbCl2;
Відомо: PbCl2
ω(Pb) ?
ω(Cl) — ?
в) Na2CO3;
Розв’язання: Обчислимо
= 69,6%.
Обчислимо масові частки: shkola.in.ua ω(Pb) = �������� (Pb) �������� (PbCl2
Відповідь: ω(Pb) = 74,7%; ω(Cl) = 25,3%.
Відомо: Na2CO3 Розв’язання:
ω(Na) ?
ω(C) — ?
ω(O) — ?
35 =
+
= 277
�������� (Na2 CO3 ) =2 ⋅�������� (Na) + �������� (C) +3 ⋅�������� (O) = =2 ⋅ 23 + 12 +3 ⋅ 16 = 46 + 12 + 48 = 106 Обчислимо масові частки: shkola.in.ua
ω(Na) = 2 ⋅�������� (Na) �������� (Na2 CO3 ) ⋅ 100% = 46 106 ⋅ 100% ≈ 43,4%
ω(C) = �������� (C) �������� (Na2 CO3 ) = 12 106 ⋅ 100% ≈ 11,3%
ω(O) = 3 ⋅�������� (O) �������� (Na2 CO3 ) ⋅ 100% = 48 106 ⋅ 100% ≈ 45,3%
Відповідь: ω(Na) = 43,4%; ω(C) = 11,3%; ω(O) = 45,3%.
г) H2SO4;
Відомо: H2SO4
ω(H) ?
ω(S) — ?
ω(O) — ?
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
д) Ba3(PO4)2.
Відомо: Ba3(PO4)2
ω(Ba) ? ω(P) — ? ω(O) — ?
�������� (H2 SO4 ) =2 ⋅�������� (H) + �������� (S) +4 ⋅�������� (O) = =2 ⋅ 1+ 32 +4 ⋅ 16 =2+ 32 + 64 = 98 Обчислимо масові частки: shkola.in.ua
≈
ω
ω(S) = �������� (S) �������� (H2 SO4 ) ⋅ 100% = 32
= 4 ⋅�������� (O) �������� (H2 SO4 ) ⋅
Відповідь: ω(H) = 2,0%; ω(S) = 32,7%; ω(O) = 65,3%.
Розв’язання: Обчислимо відносну
�������� (Ba3 (PO4 )2 ) =3 ⋅�������� (Ba) +2 ⋅
+4 ⋅�������� (O)� = =3 ⋅ 137 +2 ⋅ (31 +4 ⋅ 16) =
(Ba) = 3 ⋅�������� (Ba) �������� (Ba3
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
колір. Інші назви — «червоне залізняк», «кровавик».
важливий тим, що його здавна використовували
розписів,
33. Як ви вважаєте, чи
ω(����) ?
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відомо: NH4NO3
ω(����
(����) = �������� (����) �������� (����������������3 ) = 14 85 ≈ 0,165 або 16,5%
Відповідь: ω(����) = 16,5%
Розв’язання:
селітри: �������� (��������4 ��������3 ) = �������� (���� ) +4 ⋅�������� (���� ) + �������� (����) +3 ⋅�������� (���� ) = = 14 +4 ⋅ 1+ 14 + 48 = 14 +4+ 14 + 48 = 80 Обчислимо
(
ω(����) = 35%
shkola.in.ua
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
1. Визначимо відносну формульну масу сполуки: �������� = ����(Cr) ⋅�������� (Cr) ���� (Cr) = 1 ⋅ 52 0,52 = 100
2. Маса Оксигену: 100 52 = 48
3. Число атомів Оксигену: shkola.in.ua
48 ∶ 16 =3
Відповідь: CrO3 .
б) Оксид Феруму
Відомо: ���� (Fe) = 70% =0,70.
Необхідно визначити: хімічну формулу сполуки. Fex Oy
1. Визначимо відносну формульну масу сполуки: �������� = ����(Fe) ⋅�������� (Fe) ���� (Fe) = 1 ⋅ 56 0,70 = 80
2. Маса Оксигену: 80 56 = 24
3. Число атомів Оксигену: shkola.in.ua 24 ∶ 16 =1,5
4. Домножуємо індекси на 2 → Fe2 O3 .
Відповідь: Fe2 O3 .
Визначте хімічну формулу сполуки:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
1. Визначимо відносну формульну масу сполуки: �������� = ����(C) ⋅�������� (C) ���� (C) = 1 ⋅ 12 0,8182 = 14,67
2. Маса Гідрогену: 14,67 12 =2,67
3. Число атомів Гідрогену: shkola.in.ua 2,67 ∶ 1=2,67 (дробове)
4. Домножуємо індекси на 3 → C3 H8 .
Відповідь: C3 H8
38. Мінерал халькопірит містить
30,4 %) та Сульфур.
1.
3.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Сторінка 47 Поміркуйте
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
1 доба = 24 години
1 тиждень = 7 діб
1 рік = 365 діб shkola.in.ua
1 дюжина = 12 штук
1 коло = 360°
Сторінка 49
а) Cl2
Розв’язання: у молекулі
(Cl) =1 ⋅ 2= 2 моль
Відповідь: ����(Cl) = 2 моль. б) H2 SO4
Розв’язання: shkola.in.ua
����(H) =1 ⋅ 2= 2 моль;
����(S) =1 ⋅ 1= 1 моль;
����(O) =1 ⋅ 4= 4 моль.
Відповідь: ����(H) = 2 моль,; ����(S) = 1 моль,; ����(O) = 4 моль.
в) H3 PO4
Розв’язання: shkola.in.ua
����(H) =1 ⋅ 3= 3 моль;
����(P) =1 ⋅ 1= 1 моль;
����(O) =1 ⋅ 4= 4 моль.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відповідь: ����(H) = 3 моль,; ����(P) = 1 моль,; ����(O) = 4 моль.
г) Fe2 O3
Розв’язання: shkola.in.ua
����(Fe) =1 ⋅ 2= 2 моль;
����(O) =1 ⋅ 3= 3 моль.
Відповідь: ����(Fe) = 2 моль,; ����(O) = 3 моль.
д) Ca(OH)2
Розв’язання: shkola.in.ua
����(Ca) =1 ⋅ 1= 1 моль;
����(O) =1 ⋅ 2= 2 моль;
����(H) =1 ⋅ 2= 2 моль.
Відповідь: ����(Ca) = 1 моль,; ����(O) = 2 моль,; ����(H) = 2 моль.
42. Обчисліть
K2SO4; и) Fe(NO3)3; к) NaAl(OH)4.
а) Відомо: H2 S
���� (H2 S) ?
б) Відомо: NH3
���� (NH3 ) ?
в) Відомо: F2
���� (F2 ) ?
г) Відомо: CaCO3
���� (CaCO3 ) ?
Розв’язання: Обчислимо
���� = �������� =2 ⋅�������� (H) +1 ⋅�������� (S) =2 ⋅ 1+ 32 = 34 г/моль
Відповідь: ���� = 34 г/моль. shkola.in.ua
Розв’язання:
масу: ���� = �������� =1 ⋅�������� (N) +3 ⋅�������� (H) = 14 +3 ⋅ 1= 17 г/моль
Відповідь: ���� = 17 г/моль. shkola.in.ua
Розв’язання: Обчислимо відносну молекулярну масу: ���� = �������� =2 ⋅�������� (F) =2 ⋅ 19 = 38 г/моль Відповідь: ���� = 38 г/моль. shkola.in.ua
Розв’язання: shkola.in.ua
масу: ���� = �������� =1 ⋅�������� (Ca) +1 ⋅�������� (C) +3 ⋅�������� (O) = = 40 + 12 +3 ⋅ 16 = 100 г/моль
Відповідь: ���� = 100 г/моль.
д) Відомо: SO2 Розв’язання: shkola.in.ua Обчислимо
масу: ���� = �������� =1 ⋅�������� (S) +2 ⋅�������� (O) = 32 +2 ⋅ 16 = 64 г/моль Відповідь: ���� = 64 г/моль. ���� (SO2 ) ?
е) Відомо: NaOH
���� (NaOH) ?
Розв’язання: Обчислимо відносну молекулярну масу: shkola.in.ua
���� = �������� =1 ⋅�������� (Na) +1 ⋅�������� (O) +1 ⋅�������� (H) = = 23 + 16 +1= 40 г/моль
Відповідь: ���� = 40 г/моль.
ж) Відомо: K 2 SO4
���� (K 2 SO4 ) ?
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Розв’язання: Обчислимо відносну молекулярну масу: ���� = �������� =2 ⋅�������� (K) +1 ⋅�������� (S) +4 ⋅�������� (O) = =2 ⋅ 39 + 32 +4 ⋅ 16 = 174 г/моль
Відповідь: ���� = 174 г/моль. shkola.in.ua
и) Відомо: Fe(NO3 )3
���� (Fe(NO3 )3 ) ?
к) Відомо: NaAl(OH)4
Розв’язання: shkola.in.ua
Обчислимо відносну молекулярну масу: M= �������� =1 ⋅�������� (Fe) +3 ⋅ ��������� (N) +3 ⋅�������� (O)� = = 56 +3 ⋅ (14 + 48) = 242 г/моль
Відповідь: ���� = 242 г/моль.
Розв’язання: shkola.in.ua
Обчислимо відносну молекулярну масу: ���� = �������� =1 ⋅�������� (Na) +1 ⋅�������� (Al) +4 ⋅ ��������� (O) + �������� (H)� = = 23 + 27 +4 ⋅ (16 +1) = 118 г/моль
���� (NaAl(OH)4 ) ? 43. Обчисліть кількість
Відповідь: ���� = 118 г/моль.
а) Відомо:
����(Fe) = 7 г
����(Fe) ?
б)
Відомо:
����(N2 ) = 21 г
����(N2 ) ?
shkola.in.ua
в) Відомо:
����(CaCO3 ) = 500 г
Розв’язання: shkola.in.ua �������� (Fe) = �������� (Fe) = 56 г/моль ���� = ���� ���� = 7 56 =0.125 моль Відповідь: ����(Fe) = 0.125 моль.
Розв’язання: �������� (N2 ) =2 ⋅�������� (����) =2 ⋅ 14 = 28 г/моль
���� = ���� ���� = 21 28 =0.75 моль
Відповідь: ����(N2 ) = 0.75 моль.
Розв’язання: �������� (CaCO3 ) =1 ⋅�������� (Ca) +1 ⋅�������� (C) +3 ⋅�������� (O) = = 40 + 12 +3 ⋅ 16 = 100 г/моль ���� = ���� ���� = 500 100 = 5 моль
Відповідь: ����(CaCO3 ) = 5 моль. shkola.in.ua ����(CaCO3 ) ?
г) Відомо: ����(NaHCO3 ) = = 10 кг = 10000 г
����(NaHCO3 ) ?
shkola.in.ua
Розв’язання: �������� (NaHCO3 ) =1 ⋅�������� (Na) +1 ⋅�������� (H) +1 ⋅�������� (���� ) +3 ⋅�������� (���� ) = = 23 +1+ 12 +3 ⋅ 16 = 84 г/моль.
����(NaHCO3 ) ≈ 119.05 моль.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
0,75 моль; д) золота
Відомо:
����(H2 ) = 2 моль
Розв’язання:
1. Обчислимо молярну масу водню:
Відповідь: ����(H2 ) = 4 г. ����(H2 ) ? shkola.in.ua
б) Відомо:
����(O2 ) = 3 моль
���� (H2 ) =2 ⋅�������� (H) =2 ⋅ 1= 2 г/моль.
2. Обчислимо масу: ���� = ����⋅���� =2 ⋅ 2= 4 г.
Розв’язання:
1. Обчислимо молярну масу кисню: shkola.in.ua ���� (O2 ) =2 ⋅�������� (O) =2 ⋅ 16 = 32 г/моль
Відповідь: ����(O2 ) = 96 г. ����(O2 ) ?
в)
Відомо:
����(H2 O) = 2.5 моль
2. Обчислимо масу:
���� = ����⋅���� =3 ⋅ 32 = 96 г
Розв’язання: shkola.in.ua
1. Обчислимо молярну масу
Відповідь: ����(H2 O) = 45 г. ����(H2 O) ?
г) Відомо: ����(C12 H22 O11 ) = = 0.75 моль
���� (H2 O) =2 ⋅�������� (H) +1 ⋅�������� (O) =2 ⋅ 1+ 16 = 18 г/моль
2. Обчислимо масу: ���� = ����⋅���� =2.5 ⋅ 18 = 45 г
Розв’язання: shkola.in.ua 1. Обчислимо молярну масу цукру: ���� (C12 H22 O11 ) = 12 ⋅�������� (C) + 22 ⋅�������� (H) + 11 ⋅�������� (O) = = 12 ⋅ 12 + 22 ⋅ 1+ 11 ⋅ 16 = 342 г/моль
2. Обчислимо масу: ���� = ����⋅���� =0.75 ⋅ 342 = 256.5 г Відповідь: ����(C12 H22 O11 ) = 256.5 г. ����(C12 H22 O11 ) ? д) Відомо: ����(Au) = 0.08 моль
(Au) ? shkola.in.ua
Розв’язання: 1. Обчислимо
���� (Au) = �������� (Au) = 197 г/
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
б) Відомо:
���� =3.5 моль, ���� = 84 г
���� ? shkola.in.ua
в) Відомо:
���� =0.25 моль, ���� = 8 г
���� ?
Розв’язання:
���� = ���� ���� = 84 3.5 = 24 г/моль
Атомна маса ≈ 24 → це Магній (Mg).
Відповідь: ���� = 24 г/моль, магній.
Розв’язання: shkola.in.ua ���� = ���� ���� = 8 0.25 = 32 г/моль
Атомна маса ≈ 32 → це Сульфур (S).
Відповідь: ���� = 32 г/моль, сірка.
46. Визначте, маса якого зразка більша: а) кисню О2 кількістю речовини
N2
речовини 2 моль; б) води H2O кількістю речовини 5
речовини 1,4 моль; в) негашеного
MgO кількістю речовини 1,5 моль. а) Відомо: ����(O2 ) = 3 моль, ����(N2 ) = 2 моль. Розв’язання: 1. Обчислимо молярні
у якого зразка маса більша? shkola.in.ua
б) Відомо:
����(H2 O) = 5 моль, ����(Cl2 ) = 1.4 моль.
у якого зразка маса більша? shkola.in.ua
���� (O2 ) =2 ⋅�������� (O) =2 ⋅ 16 = 32 г/моль ���� (N2 ) =2 ⋅�������� (N) =2 ⋅ 14 = 28 г/
2. Обчислимо маси: ����(O2 ) = ����⋅���� =3 ⋅ 32 = 96 г
����(N2 ) = ����⋅���� =2 ⋅ 28 = 56 г
3. Порівняння: 96 г > 56 г
Відповідь: більша
в) Відомо:
����(CaO) = 1 моль,
����(MgO) = 1.5 моль.
у якого зразка маса більша?
кисню O2 .
Розв’язання: 1. Обчислимо молярні маси: ���� (H2 O) =2 ⋅�������� (H) +1 ⋅�������� (O) =2 ⋅ 1+ 16 = 18 г/моль ���� (Cl2 ) =2 ⋅�������� (Cl) =2 ⋅ 35.5= 71 г/моль
2. Обчислимо маси: ����(H2 O) = ����⋅���� =5 ⋅ 18 = 90 г ����(Cl2 ) = ����⋅���� =1.4 ⋅ 71 = 99.4 г
3. Порівняння: 99.4 г > 90 г
Відповідь: більша маса у 1.4 моль хлору Cl2 .
Розв’язання:
1. Обчислимо молярні маси:
���� (CaO) = �������� (Ca) + �������� (O) = 40 + 16 = 56 г/моль
���� (MgO) = �������� (Mg) + �������� (O) = 24 + 16 = 40 г/моль
2. Обчислимо маси: shkola.in.ua
����(CaO) = ����⋅���� =1 ⋅ 56 = 56 г
����(MgO) = ����⋅���� =1.5 ⋅ 40 = 60 г
3. Порівняння: 60 г > 56 г Відповідь:
1.5
MgO.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
����(SO2 ) = 3 моль
����(O) ?
б) Відомо:
����(CuO) = 40 г
����(O) ? shkola.in.ua
Розв’язання: shkola.in.ua У молекулі SO2 міститься 2
����(O) = ����(SO2 ) ⋅ 2=3 ⋅ 2= 6 моль
Відповідь: ����(O) = 6 моль.
Розв’язання:
1. Обчислимо молярну масу міді(ІІ) оксиду:
���� (CuO) = �������� (Cu) + �������� (O) = 64 + 16 = 80 г/моль
2. Обчислимо кількість речовини CuO:
����(CuO) = ���� ���� = 40 80 =0.5 моль
3. У 1 молекулі CuO є 1 атом Оксигену, отже:
����(O) = ����(CuO) ⋅ 1=0.5 ⋅ 1=0.5 моль
Відповідь: ����(O) = 0.5 моль.
48. У якому зразку більше молекул: у
Відомо:
����(O2 ) = 100 г, ���� (O2 ) = 32 г/моль
����(O3 ) = 100 г, ���� (O3 ) = 48 г/моль
) = ���� ���� = 100 32 =3.
)
а) ����(HNO3 ) ?
б) ����(N) — ?
в) ����(H) — ?
г) ����(O) — ?
shkola.in.ua
= 2 моль
б) У 1 молекулі HNO3 міститься 1 атом Нітрогену, тому
����(N) = ����(HNO3 ) ⋅ 1=2 ⋅ 1= 2 моль в) У 1 молекулі HNO3 міститься 1 атом Гідрогену, тому ����(H) = ����(HNO3 ) ⋅ 1=2 ⋅ 1= 2 моль г) У 1 молекулі HNO3 міститься 3 атоми Оксигену, тому ����(O) = ����(HNO3 ) ⋅ 3=2 ⋅ 3= 6 моль
Відповідь:
а) ����(HNO3 ) = 2 моль; б) ����(N) = 2 моль; в) ����(H) = 2 моль; г) ����(O) = 6 моль.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відомо:
���� =0.8 г, ���� = 0 05 моль
���� ?
Формула сполуки? shkola.in.ua
Розв’язання: 1. Обчислимо молярну
16 г/моль. Молярна маса метану CH4 : ���� (CH4 ) = 12 +4 ⋅ 1= 16 г/моль
Вона збігається з обчисленим значенням.
Відповідь: ���� = 16 г/моль, формула сполуки CH4 (метан).
Розуміння явищ природи (робота в групах) 51. Поясніть малюнок і складіть діаграму
маса» і «молярна
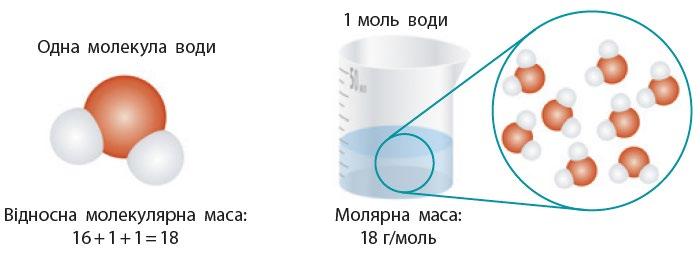
shkola.in.ua
(����2 )—?
shkola.in.ua
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
масою 7 г.
Відомо:
а) ����(CaO) =0,5 моль б) ����(CaO) = 7 г
shkola.in.ua
а) ����(Ca(OH)2 ) ?
б) ����(Ca(OH)2 ) — ?
Розв’язання: Рівняння реакції: CaO +H2 O → Ca(OH)2 .
За рівнянням: ����(CaO)
����(Ca(OH)2 ) = 1 1 .
а) ����(Ca(OH)2 ) = ����(CaO) =0,5 моль.
б) Знаходимо ����(CaO): ���� (CaO) = 40 + 16 = 56 г/моль,
����(CaO) = ���� ���� = 7 56 =0,125 моль
Отже, ����(Ca(OH)2 ) =0,125 моль.
Відповідь: а) ����(Ca(OH)2 ) =0,5 моль;
б) ����(Ca(OH)2 ) = 0,125 моль
����(N2 ) — ?
����(H2 O) — ? shkola.in.ua
. ����(O2 ) ?
Кисень:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
кількістю речовини 0,15 моль.
Відомо:
����(CO2 ) = 0,15 моль
����(NH4 HCO3 ) ?
Сторінка 60 58. Карбон(ІV)
CH4.
����(C) ? ����(CH4 ) —? ����(CH4 ) ����(C) —?
Розв’язання:
Рівняння реакції:
NH4 HCO3 → NH3 ↑ + CO2 ↑ + H2 O
За рівнянням: 1 моль NH4 HCO3 розкладається з утворенням
1 моль CO2 .
Тобто: shkola.in.ua
����(NH4 HCO3 ) = ����(CO2 ) =0,15 моль.
Знаходимо масу розпушувача: ���� (NH4 HCO3 ) = �������� (N) + �������� (H) ⋅ 5+ �������� (C) + �������� (O) ⋅ 3= = 14 + (1 ⋅ 4) +1+ 12 + (16 ⋅ 3) = 79 г/моль. ����(NH4 HCO3 ) = ����⋅���� =0,15 ⋅ 79 = 11,85 г.
Відповідь: ����(NH4 HCO3 ) = 11,85 г.
���� (CO2 ) = �������� (C) + �������� (O) ⋅ 2= 12 + 16 ⋅ 2= 44 г/моль
����(CO2 ) = ���� ���� = 55 44 =1,25 моль
2. Реакції: а) C+O2 → CO2 За рівнянням: 1 моль C дає 1 моль CO2 .
Отже: shkola.in.ua
����(C) = ����(CO2 ) =1,25 моль
���� (C) = �������� (C) = 12
����(C) = ����⋅���� =1,25 ⋅ 12 = 15 г
б) CH4 +2����2 → CO2 +2H2 O За рівнянням: 1 моль CH4 дає 1 моль CO2 .
Отже:
����(CH4 ) = ����(CO2 ) =1,25 моль
���� (CH4 ) = �������� (C) + �������� (H) ⋅ 4= 12 +1 ⋅ 4= 16 ����(CH4 ) = ����⋅���� =1,25 ⋅ 16 = 20 г 3. Порівняння мас: ����(CH4 ) ����(C) = 20 15 = 4 3 ≈ 1,33
15
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відомо: ����(N2 O) = 5 г Розв’язання: 1. Знайдемо
Відповідь: ����(NH4 NO3 ) = 9,1 г. ����(NH4 NO3 ) ? shkola.in.ua
речовини N2 O: ���� (N2 O) = �������� (N) ⋅ 2+ �������� (O) = 14 ⋅ 2+ 16 = 44 г/моль
����(N2 O) = ���� ���� = 5 44 =0,114 моль
2. За рівнянням реакції:
NH4 NO3 → N2 O+2H2 O
1 моль амоній нітрату
Отже:
1 моль N2 O.
����(NH4 NO3 ) = ����(N2 O) =0,114 моль
3. Знайдемо масу амоній нітрату: ���� (NH4 NO3 ) = �������� (N) ⋅ 2+ �������� (H) ⋅ 4+ �������� (O) ⋅ 3= = 14 ⋅ 2+1 ⋅ 4+ 16 ⋅ 3= 28 +4+ 48 = 80 г/моль
����(NH4 NO3 ) = ����⋅���� =0,114 ⋅ 80
Відомо:
����(NaClO) = = 5 кг = 5000 г
Розв’язання:
1. Запишемо рівняння реакції розкладу: 2NaClO → 2NaCl +O2
Відповідь: ����(NaCl) ≈ 3,93 кг. ����(NaCl) — ?
2. Знайдемо кількість речовини NaClO:
���� (NaClO) = �������� (Na) + �������� (Cl) + �������� (O) = = 23 + 35,5+ 16 = 74,5 г/моль
����(NaClO) = ���� ���� = 5000 74,5 ≈ 67,11 моль
3. За рівнянням: 2����(NaClO) =2����(NaCl).
Отже: shkola.in.ua
����(NaCl) = ����(NaClO) = 67,11 моль
4. Знаходимо масу NaCl:
���� (NaCl) = �������� (Na) + �������� (Cl) = 23 + 35,5= 58,5 г/моль
����(NaCl) = ����⋅���� = 67,11 ⋅ 58,5 ≈ 3927 г =3,93 кг
Відомо:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
����(Fe2 O3 ) = 54 г Розв’язання:
����(Fe) ?
shkola.in.ua
1. Рівняння реакції (термітна): 2Al +Fe2 O3 → 2Fe +Al2 O3
2. Знайдемо кількість речовини ферум(III) оксиду:
���� (Fe2 O3 ) = �������� (Fe) ⋅ 2+ �������� (O) ⋅ 3
���� (Fe2 O3 ) = 56 ⋅ 2+ 16 ⋅ 3= 112 + 48 = 160 г/моль
����(Fe2 O3 ) = ���� ���� = 54 160 =0,3375 моль
3. За рівнянням: 1 моль Fe2 O3 → 2 моль Fe.
����(Fe) =0,3375 ⋅ 2=0,675 моль
4. Обчислюємо масу заліза:
���� (Fe) = �������� (Fe) = 56 г/моль
����(Fe) = ����⋅���� =0,675 ⋅ 56 = 37,8 г
Відповідь: ����(Fe) ≈ 37,8 г.
Розуміння явищ природи (робота в групах)
62. Створіть модель реакції
параграфі на с. 55.
Рівняння реакції горіння метану:
CH4 +2O2 → CO2 +2H2 O
Модель (у молях): shkola.in.ua - 1 моль метану реагує
(FeS) = 1моль
����(Fe) ?
����(S) — ? ����(Fe) ���� (S) —?
реакції: Fe +S → FeS
рівнянням: shkola.in.ua
(Fe) ∶����(S) =1 ∶ 1
����(FeS) =1
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
спостерігаючи, що під час нагрівання або хімічних
беруть участь у різних процесах. Наприклад,
(кисень), а інша — ні (азот). Вони могли помітити,
об’єм повітря зменшується, тобто частина
що повітря не є однорідним, а складається
Отже, гіпотеза: Повітря
Поміркуйте
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
1. За чистотою:
2. За походженням:
o Природне (атмосферне) — те, яким ми дихаємо, що оточує Землю.
o Штучне — створене або змінене людиною (наприклад, у лабораторіях, киснево-азотні суміші).
3. За вологістю: shkola.in.ua
o Сухе повітря — без водяної пари.
o Вологе повітря — містить водяну пару, її кількість залежить від погоди.
4. За складом:
o Атмосферне повітря — суміш газів: азоту (≈78%), кисню (≈21%), вуглекислого газу та домішок.
o Збагачене киснем
68. Чи можна
•
азоту — N2,
• молекула кисню — O2, shkola.in.ua
• молекула вуглекислого
Пояснення:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Пояснення:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Сторінка
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
кисню (через фотосинтез водоростей) і
• Джозеф Прістлі (1774): сфокусував сонячне
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
створивши нову сполуку, яку згодом
� Відкриття: shkola.in.ua
У 1786 році Бертолле, працюючи з хлором, відкрив
легко виділяє кисень при нагріванні, тому стала
� Основні властивості:
• Біла кристалічна речовина;
• При нагріванні розкладається з виділенням
2����������������3 → 2������������ +3����2
• Добре окиснює інші речовини, через що
� Внесок Бертолле:
• Першим показав, що кисень
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
• Марган(IV) оксид (MnO₂) —
•
Висновок: shkola.in.ua Каталізатори — це «помічники»
Відомо:
(����2 ) = 32 г/моль ���� (повітря
ρ(����2 )
ρ(повітря) ? shkola.in.ua 77. У хімічну
масою 375 г.
Обчисліть: а)
початковому розчині.
Відомо:
����розчину = 400 г ����(H2 O) = 375 г
����(O2 ) ?
���� (H2 O2 ) ?
Розв’язання: shkola.in.ua
Реакція: 2H2 O2 MnO2 �⎯⎯� 2H2 O+O2 ↑ 1. Маса кисню: газ вийшов зі склянки, отже ����(O2 ) = ����поч −����після = 400 375 = 25 г. 2. Знаходимо, скільки H2 O2 розклалося (через вихід O2 ): ���� (O2 ) = �������� (O) ⋅ 2= 16 ⋅ 2= 32 г/моль, ����(O2 ) = ���� ���� = 25 32 =0,78125 моль.
За рівнянням: ����(H2 O2 ) ����(O2 ) = 2 1 ����(H2 O2 ) =2 ⋅ 0,78125 =1,5625 моль. ���� (H2 O2 ) = �������� (H) ⋅ 2+ �������� (O) ⋅ 2=1 ⋅ 2+ 16 ⋅ 2= 34 г/моль, ����(H2 O2 ) = ����⋅���� =1,5625 ⋅ 34 = 53,125 г.
3. Масова частка H2 O2 у початковому розчині: ���� (H2 O2 ) = ����(H2 O2 ) ����розчину = 53,125 400 =0,1328125 ≈ 0,133 = 13,3%.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відповідь: shkola.in.ua
а) ����(O2 ) = 25 г; б) ���� (H2 O2 ) ≈ 13,3%.
Сторінка 74
78. Порівняйте
Відомо:
KMnO4 (калій
перманганат) і
KClO3 (бертолетова сіль).
����O (KMnO4 ) ? ����O (KClO3 ) ? shkola.in.ua
Розв’язання:
1. Для KMnO4 : ���� (KMnO4 ) = �������� (K) + �������� (Mn) + �������� (O) ⋅ 4= = 39 + 55 + 16 ⋅ 4= 158 г/
����(O у KMnO4 ) = �������� (O) ⋅ 4= 16 ⋅ 4=
2. Для KClO3 : ���� (KClO3 ) = �������� (K) + �������� (Cl) + �������� (O) ⋅ 3=
(O2 ) ? (для KClO3 і для KMnO4 )
(O2 ) — ? за (0∘ C, 1 атм)
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
����(O2 )
����(KClO3 ) = 3 2 ⇒����(O2 ) =8,163 ⋅ 3 2 ≈ 12,245 моль.
Маса та об’єм кисню:
����(O2 ) = ����⋅���� = 12,245 ⋅ 32 ≈ 392 г
���� (O2 ) = ����⋅�������� = 12,245 ⋅ 22,4 ≈ 274 л
б) Із калій перманганату KMnO4
Молярні маси: shkola.in.ua
���� (KMnO4 ) = �������� (K) + �������� (Mn) + �������� (O) ⋅ 4=
= 39 + 55 + 16 ⋅ 4= 158 г/моль (���� (O2 ) = 32 г/моль — як вище.)
Кількість речовини: ����(KMnO4 ) = 1000 158 ≈ 6,329 моль
За рівнянням: ����(O2 ) ����(KMnO4 ) = 1 2 ⇒����(O2 ) =6,329 ⋅ 1 2 ≈ 3,165 моль.
Маса та об’єм кисню: ����(O2 ) =3,165 ⋅ 32 ≈ 101 г
���� (O2 ) =3,165 ⋅ 22,4 ≈ 70,9 л
Висновок: за однакової
- Отримують малі кількості речовини; - Потрібні невеликі реактори, пробірки; - Використовується для навчання і дослідів;
- Реакції короткотривалі, контроль простий.
- Отримують великі обсяги речовини; - Використовують великі установки, тиск, каталізатори;
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
дослідження в класі.
Каталізатори: чому вони такі важливі?
1) Що таке каталізатор
• Речовина, яка прискорює реакцію
• Допомагає реакції йти
2) Промисловість (заводи)
• Майже
• Аміак (Haber–Bosch): азот
•
• Переваги:
3) Техніка й довкілля
• Автомобілі: каталітичний
(NOx, CO, вуглеводні) на
(N₂, CO₂, H₂O).
• SCR у дизелях: додавання сечовини + каталізатор → значно менше NOx.
• Інші приклади: очищення димових газів на ТЕС, виробництво «зеленого» водню й пального з біомаси. 4) У живих організмах
• Ферменти (ензими) — природні каталізатори з білків.
• Приклади:
o Амілаза розщеплює крохмаль у роті.
o Каталаза руйнує пероксид водню (H₂O₂) у клітинах.
o Рубіско допомагає рослинам «захоплювати» CO₂ у фотосинтезі.
• Без ферментів реакції в клітинах
• Каталізатори
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
2.
4.
• спочатку азот (найлегше кипить),
• потім
76
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
тиску.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
1.
2. Після припинення
3. У дві пробірки налити однакові об’єми свіжого H₂O₂: – А (контроль): без каталізатора; – Б (повтор): додати той самий
4. Порівняти початок і інтенсивність виділення
Очікування: у пробірці
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
є полум’я; - виділяється багато тепла й світла.
повільна реакція; - без полум’я; - виділяється небагато тепла. - реакції окиснення;
участь кисню; - виділення енергії (тепла).
shkola.in.ua
- дуже швидке окиснення; - виділяється багато тепла й газів; - утворюється ударна хвиля.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
а) 4Li + O₂ → 2Li₂O
б) 2Ca + O₂ → 2CaO
в) Si + O₂ → SiO₂
98. Обчисліть масу (г) сірки, яка згоріла, якщо було
кисень масою 11,2 г. Відомо: ����(����2 ) = 11,2 г
����(����) ? shkola.in.ua
99. Унаслідок
Відомо:
(
Розв’язання: Реакція: ���� + ����2 →��������2
1. ����(����2 ) = ����(����2 ) ���� (����2 ) = 11,2 32 =0,35 моль
2.Зарівняннямреакції ����(����) = ����(����2 ) =0,35 моль
3. ����(����) = ����(����) × ���� (����) =0,35 × 32 = 11,2 г
Відповідь: 11,2 г
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Ознаки горіння: виділення теплоти, світла, появa полум’я і диму.
Полум’я — це розжарені гази й частинки речовини, які згорають у повітрі.
Дим з’являється через незгорілі частинки речовини.
Теплота і світло виникають тому, що
енергія. shkola.in.ua
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Сторінка 95
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
дихання, утворюючи
вуглекислий газ і воду. shkola.in.ua
3. Під час горіння та гниття речовин кисень також витрачається.
4.
Утворення
Сторінка
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
магмі та газах. Основні хімічні процеси:
• Окиснення сірки: S + O2 → SO2 (утворюється сірчистий газ — сульфур(IV) оксид)
• Окиснення вуглецю: C + O2 → CO (утворюється вуглекислий газ)
• Окиснення водню:
2H2 + O2 → 2H2O (утворюється
Під час вивержень вулканів
— водяна пара (H2O), shkola.in.ua
— вуглекислий газ (CO2),
— сірчистий газ (SO2),
— сірководень (H2S),
— оксиди азоту (NO, NO2).
Отже, кисень
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відомо:
об’єм кисню авто = 21 м3 = 21000 л
витрата людини = 20 л/год
Знайти: час дихання t. shkola.in.ua
Розв’язання: ���� = ���� ���� = 21000 л
20 л/год = 1050 год
1050 год: 24 ≈ 43,75 доби ≈ 44 доби.
Відповідь: приблизно
122. Бензин є сумішшю речовин, але приблизно
формулою C8H18. Запишіть рівняння реакції
самі,
горіння бензину (C8H18):
C8H18 + 12,5O2 → 8CO2 + 9H2O
Або, щоб не було дробу:
2C8H18 + 25O2 → 16CO2 + 18H2O
Висновок:
шляхи: спалювання пального на електростанціях і
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
shkola.in.ua
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
— удосконалити фільтри на заводах і ТЕС;
— менше спалювати сміття та суху траву;
— збільшити кількість зелених насаджень у

108
Сторінка 110
Поміркуйте Якщо
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
0,5 моль; в) фтору кількістю речовини 0,25 моль; г) сірководню H2S кількістю речовини 2,9 моль; д) амоніаку NH
Азот N2
Відомо: n = 2 моль. Розв’язання: V = n · Vm = 2 моль · 22,4 л/моль = 44,8 л. Відповідь: 44,8 л. V – ?
shkola.in.ua
б) Кисень O2
Відомо: n = 0,5 моль. Розв’язання: V = n · Vm = 0,5 моль · 22,4 л/моль = 11,2 л.
Відповідь: 11,2 л. V – ?
в) Фтор F2
Відомо: n = 0,25 моль.
V – ?
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Розв’язання:
V = n · Vm = 0,25 моль · 22,4 л/моль = 5,6 л.
Відповідь: 5,6 л.
г) Сірководень H2S
Відомо: n = 2,9 моль.
Розв’язання:
V = n · Vm = 2,9 моль · 22,4 л/моль = 64,96 л ≈ 65,0 л.
Відповідь: 65 л. V – ?
д) Амоніак NH3
Відомо: n = 4,2 моль.
V – ?
Розв’язання:
V = n · Vm = 4,2 моль · 22,4 л/моль = 94,08 л ≈ 94,1 л.
Відповідь: 94,1 л. shkola.in.ua
138. У чотирьох однакових посудинах
NH3, азоту N2, сірчистого
Відомо: Однакові
а якої найменша.
NH3, N2, SO2, O2
однакова (за законом Авоґадро).
Розв’язання:
Знайдемо молярні маси газів:
NH3: M = 14 + 3·1 = 17 г/моль
N2: M = 2·14 = 28 г/моль
O2: M = 2·16 = 32 г/моль
SO2: M = 32 + 2·16 = 64 г/моль
Маса газу m =
масою, а найменшу — з найменшою.
Відповідь: найбільша
139. Обчисліть масу (г) сірководню H2S об’ємом 16,8 л (н. у.).
Відомо: V(H2S) = 16,8 л Vm = 22,4 л/моль
m(H2S) – ? shkola.in.ua
Розв’язання:
посудини з NH3.
n(H2S) = V(H2S) : Vm = 16,8 л : 22,4 л/моль = 0,75 моль M(H2S) = 2 · 1 + 32 = 34 г/моль
m(H2S) = n(H2S) · M(H2S) = 0,75 моль · 34 г/моль = 25,5 г
Відповідь: m(H2S) = 25,5 г.
116 140. Обчисліть об’єм (н. у.) водню: а) масою 10 г;
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відомо:
m(H2) = 10 г.
V(H2) – ?
б)
Відомо:
n(H2) = 10 моль.
V(H2) – ?
Розв’язання:
M(H2) = 2 г/моль.
n(H2) = m(H2) : M(H2) = 10 г : 2 г/моль = 5 моль.
V(H2) = n(H2) · Vm = 5 моль · 22,4 л/моль = 112 л.
Відповідь: V(H2) = 112 л.
Розв’язання:
V(H2) = n(H2) · Vm = 10 моль · 22,4 л/моль = 224 л.
Відповідь: V(H2) = 224 л.
141. Є зразки двох газів, узятих за нормальних
об’ємом 20 л.
Відомо:
V(CH4) = 10 л (н. у.)
V(Cl2) = 20 л (н. у.)
Знайти: 1.
Розв’язання:
Обчислимо кількість молекул (кількість речовини) у
n(CH4) = V(CH4) : Vm = 10 л : 22,4 л/моль ≈ 0,446 моль; n(Cl2) = V(Cl2) : Vm = 20 л : 22,4 л/моль ≈ 0,893 моль.
Більше молекул у зразку Cl2, бо кількість речовини більша: n(Cl2) : n(CH4) = 0,893 : 0,446 ≈ 2 рази.
Обчислимо кількість атомів
зразку: CH4: 1 молекула містить 5 атомів (1 C + 4 H); n(атомів у CH4) = 0,446 · 5 ≈ 2,23 моль атомів. Cl2: 1 молекула містить 2 атоми Cl; n(атомів у Cl2) = 0,893 · 2
Відомо: n(CO2) = 1,5 моль; n(O2) = 1,5 моль; Vm = 22,4 л/моль.
m(CO2), m(O2), V(CO2), V(O2) – ? shkola.in.ua
Розв’язання: 1. Обчислимо маси газів.
M(CO2) = 12 + 2 · 16 = 44 г/моль. M(O2) = 2 · 16 = 32 г/моль.
m(CO2) = n(CO2) · M(CO2) = 1,5 моль · 44 г/моль = 66 г.
m(O2) = n(O2) · M(O2) = 1,5 моль · 32 г/моль = 48 г.
Отже, маси не однакові: m(CO2) > m(O2).
2. Обчислимо об’єми газів за н. у.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
V(CO2) = n(CO2) · Vm = 1,5 моль · 22,4 л/моль = 33,6 л.
V(O2) = n(O2) · Vm = 1,5 моль · 22,4 л/моль = 33,6 л.
(66
143. Обчисліть
у зразку метану CH4 об’ємом 100 л (н. у.).
Відомо:
V(CH4) = 100 л (н. у.); Vm = 22,4 л/моль.
V(NH3) – ?
Розв’язання: n(CH4) = V(CH4) : Vm = 100 л : 22,4 л/моль ≈ 4,46 моль. n(NH3) = 3 · n(CH4) = 3 · 4,46 моль ≈ 13,38 моль.
V(NH3) = n(NH3) · Vm = 13,38 моль · 22,4 л/моль ≈ 300 л.
Відповідь: V(NH3) ≈ 300 л.
144. У якому зразку амоніаку
Відомо:
m(NH3) = 100 г;
V(NH3) = 100 л (н. у.); Vm = 22,4 л/моль
У якому зразку NH3 більше молекул?
Розв’язання:
M(NH3) = 14 + 3 · 1 = 17 г/моль. n1(NH3) = m(NH3) : M(NH3) = 100 г : 17 г/моль ≈ 5,88 моль. n2(NH3) = V(NH3) : Vm = 100 л : 22,4 л/моль ≈ 4,46 моль. Оскільки 5,88 моль > 4,46
масою 100 г. shkola.in.ua Відповідь:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
маємо: 3H2 + N2 = 2NH3.
як 3 : 1 : 2,
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
циліндри, ваги, фільтрувальний папір
Реактиви: H2O2 (3 %), CaCO3, оцтова кислота (6 %), розчин NaCl (10 %)
Сторінка 118
4. Визначення молярного об’єму кисню (O2)
Маса розчину H2O2 (3 %): 5,5 мл
Приблизна кількість речовини кисню (за об’ємом пероксиду):
����(����2 ) ≈ 0,00275 моль
Виміряний об’єм кисню: shkola.in.ua
���� (����2 ) = 58 мл =0,058 л
5. Визначення молярного об’єму вуглекислого газу (CO2)
Маса CaCO3: 0,32 г
����(������������ ����3 ) = ���� ���� = 0,32 100 =0,0032 моль
За рівнянням реакції кількість CO2 така сама:
����(��������2 ) =0,0032 моль
Виміряний об’єм вуглекислого газу:
���� (��������2 ) = 72 мл =0,072 л
6. Приведення об’ємів газів до
����н.у. = ����⋅����⋅ 0,0027 ���� + 273,15 Для кисню: ����н.у. (����2 ) =
��������2
(����2 ) =0,00275 моль
(��������2 ) =0,0032 моль
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
shkola.in.ua
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
• часткові втрати газу;
• нещільні з’єднання приладу; shkola.in.ua
• неточне вимірювання маси або об’єму;
• температура й тиск, що відрізняються від нормальних;
• вологість газу або домішки.
7. Як ви вважаєте, навіщо використовували сіль в експерименті
вуглекислого газу?
Сіль додають для того, щоб вуглекислий газ
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
синім. shkola.in.ua Гіпотеза:
• Усі вони утворилися
Відмінне:
•
shkola.in.ua
2 (H2
Відмінне:
•
•
•
Сторінка
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
• калій оксиду → K2O
• фосфор(ІІІ) оксиду → P2O3
• аргентум(1+) оксиду → Ag2O
• ферум(2+) оксиду → FeO
• хлор(IV) оксиду → ClO2
• нітроген(V) оксиду → N2O5
• сульфур(VI) оксиду → SO3
• ванадій(V) оксиду → V2O5
Класифікація:
• Основні оксиди (метали
K2O, Ag2O, FeO
• Кислотні оксиди: P2O3, ClO2, N2O5, SO3, V2O5
148. Запишіть формули гідроксидів: Калію, Магнію, Стануму(2+),Хрому(3+), Купруму(2+), Барію. Підкресліть
• Калію – KOH shkola.in.ua
• Магнію – Mg(OH)2
• Стануму(2+) – Sn(OH)2
• Хрому(3+) – Cr(OH)3
• Купруму(2+) – Cu(OH)2
•
– Ba(OH)2
2O, P2O5, CO2, SO3, SO2, CrО, ВаО, Cu2O, SiО2, Mn2O7, Li2O, N2O5, MnO, SnO2, I2O5.
P2O5, CO2, SO3, SO2, SiO2, Mn2O7, N2O5, SnO2, I2O5.
shkola.in.ua Na2O, CrO, BaO, Cu2O, Li2O, MnO.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
→ основи (луги):
• Na2O + H2O = 2NaOH
• Li2O + H2O = 2LiOH
• BaO + H2O = Ba(OH)2
Кислотні оксиди → кислоти: shkola.in.ua
• P2O5 + 3H2O = 2H3PO4
• CO2 + H2O = H2CO3
• SO3 + H2O = H2SO4
• SO2 + H2O = H2SO3
• Mn2O7 + H2O = 2HMnO4
• N2O5 + H2O = 2HNO3
• SnO2 + H2O = H2SnO3
• I2O5 + H2O = 2HIO3
Для оксидів, що з
• CrO → Cr(OH)2
• Cu2O → CuOH shkola.in.ua
• MnO → Mn(OH)2
• SiO2 → H2SiO3 (силікатна кислота)
150. Доповніть
Li2O + H2O → 2LiOH –
SO2 + H2O → H2SO3 –
BaO + H2O → Ba(OH)2
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Якщо розчин
могли бути такі гази:
• CO2 (карбон(IV) оксид) shkola.in.ua
• SO2 (сульфур(IV) оксид)
• SO3 (сульфур(VI) оксид,
• NO2 (нітроген(IV) оксид)
Сторінка 129
158.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Сторінка130
Кислота (оцет)
Луг (питна
Вода (нейтральна)
Кухонна сіль (нейтр.)
Висновок:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html

https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
а) N2 + 3H2 → 2NH3
б) H2 + Cl2 → 2HCl
в) C + 2H2 → CH4 163.
розчині?
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html


https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
shkola.in.ua
за 20°C в 1 л води розчиняється:
���� (����2 ) = 18,8 мл =0,0188 л;
���� (����2 ) =6,7 мл =0,0067 л;
густина: ρ(����2 ) =0,09 г/л, ρ(����2 ) =1,43 г/л;
маса води ����води = 1000 г.
Знайти: масові частки ���� (����2 ) і ���� (����2 );
(����2 ) = ρ(����2 ) ⋅���� (����2 ) =0,09 ⋅ 0,0188 =0,001692 г.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
максимальний об'єм (н. у.). Густина паладію — 12,02 г/см3.
розрахунків використайте дані з параграфа.
Відомо:
ρ(Pd) = 12,02 г/см3;
ρ(H2) = 0,09 г/л.
���� (����2 ) ?
shkola.in.ua
Розв’язання: У 1 см3 паладію розчиняється 850 см3 водню (н.у.); Візьмемо 1 см3 паладію: ����(�������� ) = ρ(�������� ) ⋅���� = 12,02 ⋅ 1= 12,02 г.
Об’єм водню: 850 см3 = 0,85 л. ����(����2 ) = ρ(����2 ) ⋅���� =0,09 ⋅ 0,85 =0,0765 г.
Масова частка водню: ���� (����2 ) = ����(����2 ) ����(�������� ) + ����(����2 ) = 0,0765 12,02 +0,0765 ≈ 0,0063
У відсотках: ���� (����2 ) ≈ 0,63%.
Відповідь: масова частка
�������� (����2 ���� ) =2 ⋅
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
(���� ) = 2 18 ≈ 11,1%,
(���� ) = 16 18 ≈ 88,9%.
shkola.in.ua
транспортування?
Відомо:
����балона (����2 ) = 40 л,
����балона (����2 ) = 560 г
���� (�������� ) = 40 л = 40 000 см3
ρ(�������� ) = 12,02 г/см3
Розчинність: 850 об’ємів H2
ρ(����2 ) =0,09 г/л
Розв’язання
Pd
1. Маса паладієвого бруска: shkola.in.ua ����(�������� ) = ����⋅ρ = 40 000 см3 ⋅ 12,02 г/см3 = 480 800 г = 480,8 кг 2. Об’єм
Pd: ���� (����2 )в Pd = 40 л⋅ 850 = 34 000 л
3. Маса цього водню: ����(����2 )в Pd = ρ(����2 ) ⋅���� =0,09 г/л⋅ 34 000 л = 3 060 г 4. Порівняння мас водню:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
(§15):
Для кисню (§9):
����пл. = 219°���� ,
= 183°���� .
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Сторінка 142
Одержання водню Поміркуйте
H2 + F2 = 2HF.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
H2 + Cl2 = 2HCl.
Реакція
2H2 + O2 = 2H2O. Потрібно підпалити
H2 + S = H2S. Реакція йде за
З азотом:
3H2 + N2 = 2NH3.
Потрібні
(сажею):
2H2 + C = CH4.
Реакція
2K + H2 → 2KH
2Li + H2 → 2LiH
Mg + H2 → MgH2
Sr + H2 → SrH2
2Al + 3H2 → 2AlH3
Відомо:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
m(Fe2O3) = 160 кг = = 160000 г
V(H2) (н. у.) ?
shkola.in.ua
Розв’язання:
1. Записуємо рівняння реакції:
Fe2O3 + 3H2 → 2Fe + 3H2O
2. Обчислюємо кількість речовини ферум(3+) оксиду: M(Fe2O3) = 2·56 + 3·16 = 160 г/моль
n(Fe2O3) = 160000 : 160 = 1000 моль
3. За рівнянням: з 1 моль Fe2O3 реагує 3 моль H2, отже
n(H2) = 3 · 1000 = 3000 моль
4. За н. у. Vм = 22,4 л/моль, тоді
V(H2) = n · Vм = 3000 · 22,4 = 67200 л = 67,2 м3
Відповідь: 67,2 м3 водню.
об’ємом 5,6 л (н. у.).
Відомо:
V(H2) = 5,6 л (н. у.)
Vм = 22,4 л/моль
m(Zn) ? shkola.in.ua
Розв’язання:
1. Записуємо рівняння реакції:
Zn + 2HCl → ZnCl2 + H2
2. Обчислюємо кількість речовини водню: n(H2) = V : Vм = 5,6 : 22,4 = 0,25 моль
3. За рівнянням реакції: 1 моль Zn → 1 моль H2, тому n(Zn) = n(H2) = 0,25 моль
4. Обчислюємо масу цинку: M(Zn) = 65 г/моль m(Zn) = n · M = 0,25 · 65 = 16,25 г
Відповідь: 16,25 г цинку.
температури. Обчисліть
г.
Відомо:
m(СH4) = 44 г Vм = 22,4 л/моль
2) (н. у.) ? shkola.in.ua
Розв’язання:
метану: M(CH4) = 12 + 4·1 = 16 г/моль
n(CH4) = 44 : 16 = 2,75 моль
рівнянням
2) = 2 · 2,75 = 5,5
V(H2) = n · Vм = 5,5 · 22,4 = 123,2
Відомо:
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
V(H2) = 2 м3 = = 2000 л (н. у.) Vm = 22,4 л/моль
m(H2O) ?
V(O2) — ?
shkola.in.ua
Розв’язання:
1. Рівняння реакції
2H2O → 2H2 + O2
2. Знаходимо кількість речовини водню:
n(H2) = V : Vm = 2000 : 22,4 = 625/7 ≈ 89,3 моль
3. За рівнянням 2H2O → 2H2 видно, що кількості H2O і H2
однакові, тобто
n(H2O) = n(H2) = 89,3 моль
4. Обчислюємо масу води:
M(H2O) = 18 г/моль
m(H2O) = n · M = 89,3 · 18 ≈ 1607 г ≈ 1,6 кг
5. За рівнянням 2H2O → 2H2 + O2 об’єм газів
як 2 : 1, тобто V(O2) = V(H2) : 2 = 2000 : 2 = 1000 л = 1 м3
Відповідь: m(H2O) ≈ 1,6 кг, V(O2) = 1 м3
shkola.in.ua shkola.in.ua
масою 340 кг.
Відомо:
m(NH3) = 340 кг = = 340000 г
Vм = 22,4 л/моль
V(H2) (н. у.) ? shkola.in.ua
Розв’язання: Рівняння реакції:
N2 + 3H2 → 2NH3
M(NH3) = 14 + 3·1 = 17 г/моль
n(NH3) = 340000 : 17 = 20000 моль За рівнянням: з 3 моль H2 утворюється 2 моль NH3, тобто
n(H2) = 3 2·n(NH3) = 1,5·20000 = 30000 моль
тоді
V(H2) = n·Vм = 30000·22,4 = 672000 л = 672 м3 Відповідь: 672 м3 водню.
(іржавіння). Обчисліть
водень об’ємом 44,8 л (н. у.). Обчисліть
Відомо:
V(H2) = 44,8 л Vм = 22,4 л/моль
m(Cr2O3) ?
m(Cr) — ?
Розв’язання:
1. Записуємо рівняння реакції: Cr2O3 + 3H2 → 2Cr + 3H2O
2. Обчислюємо кількість речовини водню: n(H2) = V : Vm = 44,8 : 22,4 = 2 моль
3. За рівнянням 3 моль H2 відповідають 1 моль Cr2O3, тому: n(Cr2O3) = 2 : 3 = 0,67 моль (приблизно)
4. Обчислюємо масу Cr2O3: M(Cr2O3) = 2·52 + 3·16 = 152 г/моль m(Cr2O3) = n·M = 0,67·152 ≈ 101 г
5. За рівнянням з 1 моль Cr2O3 утворюється 2 моль Cr: n(Cr) = 2·n(Cr2O3) = 2·0,67 ≈ 1,33 моль
6. Обчислюємо масу хрому: M(Cr) = 52 г/моль m(Cr) = 1,33·52 ≈ 69,2 г
Відповідь: m(Cr2O3) ≈ 101 г, m(Cr) ≈ 69,2 г.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Сторінка 144
виділити, зокрема, такі: -сполучення: А + В → АВ; -розкладу: AВ → А + В;
-обміну: АВ + CD → AD + CB; -заміщення: АВ + С → СВ + А.
Проаналізуйте
До якого типу
Горіння водню:
2H2 + O2 → 2H2O.
Це реакція сполучення, оскільки
CuO
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
щоб нічого не зробити неправильно.
■ Як ви оцінюєте свою роботу?
Сторінка
Сторінка 154
Робота з інформацією 194. Назвіть солі: а) K2SO4; б) Сr(NO3)3; в) MgCl
BaSO3; к) BaS; л) BaSO4; м) Na2SiO3; н) NaBr; п) MnSO4; р) Ag2S; с) Mg3(PO4)2
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
р) меркурій(2+) нітрату; с) купрум(1+) фториду.
а) магній карбонат → MgCO3
б) цинк нітрат → Zn(NO3 )2
в) алюміній нітрат → Al(NO3 )3
г) натрій сульфат → Na2 SO4
д) кальцій силікат → CaSiO3
е) аргентум(1+) хлорид → AgCl
ж) магній сульфіт → MgSO3
и)
алюміній сульфід → Al2 S3
к) ферум(3+) сульфат → Fe2 (SO4 )3
л) хром(3+) ортофосфат → CrPO4
м) магній бромід → MgBr2
н) кальцій йодид → CaI2
п) кальцій ортофосфат → Ca3 (PO4 )2
р) меркурій(2+) нітрат → Hg(NO3 )2
фторид → CuF
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відомо:
m(розчину) = 120 г w(CuSO4) = 4 % = = 0,04
n(CuSO4) ?
shkola.in.ua
Сторінка 155
Розв’язання:
1.
купрум(2+) сульфату
розчині: m(CuSO4) = w · m(розчину) = 0,04 · 120 г = 4,8 г 2. Обчислимо кількість речовини: М(CuSO4) ≈ 160 г/моль n(CuSO4) = m / M = 4,8 г : 160 г/моль = 0,03 моль Відповідь: n(CuSO4) = 0,03 моль.
198. Обчисліть маси: а) хром(3+) сульфату кількістю речовини 0,35 моль; б) кальцій фториду кількістю речовини 0,7
Відомо:
а) n(Cr2(SO4)3) = 0,35 моль б) n(CaF2) = 0,7 моль в) n(MgSiO3) = 1,2 моль
m(Cr2(SO4)3) ?
m(CaF2) — ?
m(MgSiO3) — ? shkola.in.ua
Розв’язання:
1. Формули солей і молярні маси: – хром(3+) сульфат: Cr2(SO4)3
M(Cr2(SO4)3) = 2·52 + 3·(32 + 4·16) = 392 г/моль – кальцій фторид: CaF2
M(CaF2) = 40 + 2·19 = 78 г/моль – магній силікат: MgSiO3
M(MgSiO3) = 24 + 28 + 3·16 = 100 г/моль
2. Обчислюємо маси:
а) m(Cr2(SO4)3) = n · M = 0,35 моль · 392 г/моль = 137,2 г б) m(CaF2) = 0,7 моль · 78 г/моль = 54,6 г в) m(MgSiO3) = 1,2 моль · 100 г/моль = 120 г Відповідь: а) 137,2 г; б) 54,6 г; в) 120 г.
m(NaCl) ?
shkola.in.ua
m(NaCl) = w·m(розчину) = 0,009 · 5000 г = 45 г Відповідь: m(NaCl) = 45 г.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відомо: m(води) = 532,8 г n(CaCl2) = 0,2 моль
w(CaCl2) ? shkola.in.ua
202. Із-поміж
Розв’язання: 1. Обчислюємо
хлориду: M(CaCl2) = 40 + 2·35,5 = 111 г/моль
2. Обчислюємо масу кальцій хлориду: m(CaCl2) = n·M = 0,2 моль · 111 г/моль = 22,2 г
3. Обчислюємо масу розчину: m(розчину) = m(води) + m(CaCl2) = 532,8 г + 22,2 г = 555 г
4. Обчислюємо масову частку солі: w(CaCl2) = m(CaCl2) : m(розчину) = 22,2 г : 555 г = 0,04 = 4 %
Відповідь: w(CaCl2) = 4 %.
4.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Mg + 2HCl = MgCl2 + H2
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2
Cu + 2HCl = реакція
За спостереженнями: Mg > Zn > Fe > Cu
Mg, Zn, Fe, Cu
Ряд активності металів
магній
Рефлексуємо
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html

https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Mg + 2HCl → MgCl2 + H2
Sn + 2HCl → SnCl2 + H2
206.
металом реакція відбуватиметься? Відповідь
Реакція відбуватиметься із залізною пластиною.
Залізо в ряду активності металів
відбувається.
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
SO3 + H2O → H2SO4
CO2 + H2O → H2CO3
209. Визначте
H2SO4(розб.); б) Fe і HBr; в) Hg і HCl;
HCl; и) Pb і HCl;к) Sn і H2SO4 (розб.); л) Zn і HBr; м) Mn і H2SO4 (розб.). Для
реакцій запишіть хімічні рівняння та
а) реакція можлива
Mg + H2SO4 → MgSO4 + H2
продукти: магній сульфат і водень
б) реакція можлива
Fe + 2HBr → FeBr2 + H2
продукти: ферум(2) бромід і водень
в) реакція не відбувається (Hg правіше від H2)
г) реакція можлива
2Al + 6HI → 2AlI3 + 3H2
продукти: алюміній йодид і водень
д) реакція не відбувається (Cu правіше від H2)
е) реакція можлива
Ni + H2SO4 → NiSO4 + H2
продукти: нікель(2) сульфат і водень
ж) реакція не відбувається (Au правіше від H
и) реакція можлива, але дуже повільно;
малорозчинного PbCl2 на поверхні
Pb + 2HCl → PbCl2↓ + H2
продукти: плюмбум(2) хлорид і
к) реакція можлива
Sn + H2SO4 → SnSO4 + H2
продукти: станум(2) сульфат і
реакція можлива
Zn + 2HBr → ZnBr2 + H2 продукти: цинк
Mn + H2SO4 → MnSO4 + H2
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
(правіше) з розчину його солі.
а) FeSO4 і Sn
реакція не відбувається (Sn менш активний за Fe)
б) AgNO3 і Cu
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
продукти: купрум(2) нітрат і срібло
в) NiCl2 і Al
2Al + 3NiCl2 → 2AlCl3 + 3Ni
продукти: алюміній хлорид і нікель
г) CuSO4 і Hg
реакція не відбувається (Hg менш активний за Cu)
д) Hg(NO3)2 і Cu
Cu + Hg(NO3)2 → Cu(NO3)2 + Hg
продукти: купрум(2) нітрат і ртуть
е) Hg(NO3)2 і Ag
2Ag + Hg(NO3)2 → 2AgNO3 + Hg
продукти: аргентум(1)
ж) CrCl3 і Zn
3Zn + 2CrCl3 → 3ZnCl2 + 2Cr продукти:
Al2(SO4)3 і Pb
к) SnCl2 і Zn
Zn + SnCl2 → ZnCl2 + Sn продукти:
л) FeCl2 і Zn
Zn + FeCl2 → ZnCl2 + Fe
NiSO4 і Fe
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Fe + NiSO4 → FeSO4 + Ni
продукти: ферум(2) сульфат і нікель
н) CuBr2 і Al
2Al + 3CuBr2 → 2AlBr3 + 3Cu
продукти: алюміній бромід і мідь
п) Pb(NO3)2 і Ni
Ni + Pb(NO3)2 → Ni(NO3)2 + Pb
продукти: нікель(2) нітрат і свинець
Сторінка 166
212. Які з речовин реагують із водою: Na, Fe, Fe2O3, H2SO4, NaOH, CaO, ZnО?
підтвердьте рівняннями реакцій.
З
наведених речовин з водою реагують Na, CaO, H2SO4, NaOH.
2Na + 2H2O → 2NaOH + H2
CaO + H2O → Ca(OH)2
H2SO4 + H2O → H3O+ + HSO4
NaOH + H2O → Na+ + OH
Fe з
Fe2O3 з
ZnO з водою не реагує.
213.
а) Zn і PbO — реакція можлива
Zn + PbO → ZnO + Pb
продукти: цинк(II) оксид і свинець
б) Fe2O3 і Ca — реакція
3Ca + Fe2O3 → 3CaO + 2Fe
в) NiO і Al — реакція можлива
2Al + 3NiO → Al2O3 + 3Ni
продукти: алюміній
CuO і Au
Відомо: m(Cu) = 3,2 г
m(Zn) ? shkola.in.ua
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Розв’язання: Реакція:
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu За рівнянням реакції
Молярні маси:
M(Cu) = 64 г/моль
M(Zn) = 65 г/моль
Кількість речовини міді: n(Cu) = m(Cu) / M(Cu) = 3,2 / 64 = 0,05 моль
Отже, n(Zn) = 0,05 моль
Маса цинку:
m(Zn) = n(Zn) · M(Zn) = 0,05 · 65 = 3,25 г
Відповідь: 3,25 г.
Cu.
масою 0,54 кг.
Відомо:
m(Al) = 0,54 кг = 540 г
m(Sn) ? shkola.in.ua
Рівняння реакції:
3SnO + 2Al → Al2O3 + 3Sn
Розв’язання:
Молярні маси:
M(Al) = 27 г/моль
M(Sn) = 119 г/моль
Кількість речовини
n(Al) = m(Al) / M(Al) = 540 / 27 = 20 моль За рівнянням реакції: 2 моль Al → 3
n(Sn) = (3 / 2) · 20 = 30 моль
Маса олова:
m(Sn) = n(Sn) · M(Sn) = 30 · 119 = 3570 г = 3,57 кг
Відповідь: 3,57 кг.
= 97,5
V(H2) ?
shkola.in.ua
= 65 г/моль
n(Zn) = m(Zn) / M(Zn) = 97,5 / 65 = 1,5 моль
рівнянням реакції: n(Zn) : n(H2) = 1 : 1, отже n(H2) = 1,5 моль
у.: Vm = 22,4 л/моль
V(H2) = n(H2) · Vm = 1,5 · 22,4 = 33,6 л Відповідь: 33,6 л
Відомо:
m(Mg) = 12 г
n(H2SO4) ?
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
m(MgSO4) — ?
V(H2) — ?
shkola.in.ua
Рівняння реакції: Mg + H2SO4 → MgSO4 + H2
Розв’язання:
M(Mg) = 24 г/моль
n(Mg) = m(Mg) / M(Mg) = 12 / 24 = 0,5 моль
За рівнянням:
n(H2SO4) = n(Mg) = 0,5 моль
n(MgSO4) = 0,5 моль
n(H2) = 0,5 моль
M(MgSO4) = 24 + 32 + 64 = 120 г/моль
m(MgSO4) = n(MgSO4) · M(MgSO4) = 0,5 · 120 = 60 г
Vm = 22,4 л/моль
V(H2) = n(H2) · Vm = 0,5 · 22,4 = 11,2 л
Відповідь:
n(H2SO4) = 0,5 моль; m(MgSO4) = 60 г; V(H2) = 11,2 л
218. Обчисліть кількість речовини
сульфату, що містить 32 г цієї солі.
Відомо:
m(CuSO4) = 32 г
n(Cu) ?
shkola.in.ua 219.
Відомо:
m(Mg) = 6,0 г
m(Fe) = 16,8 г
V(H2) ? shkola.in.ua
Розв’язання:
M(CuSO4) = 64 + 32 + 64 = 160 г/моль
n(CuSO4) = m(CuSO4) / M(CuSO4) = 32 / 160 = 0,2 моль За
n(Cu) : n(CuSO4) = 1 : 1
Отже:
n(Cu) = 0,2 моль
Відповідь: 0,2 моль
Рівняння реакцій:
Mg + H2SO4 → MgSO4 + H2
Fe + H2SO4 → FeSO4 + H2
Розв’язання:
M(Mg) = 24 г/моль, M(Fe) = 56 г/моль
n(Mg) = m/M = 6,0/24 = 0,25 моль
n(Fe) = m/M = 16,8/56 = 0,30 моль За рівняннями: 1 моль металу → 1 моль H2, тому
n(H2) = 0,25 + 0,30 = 0,55 моль
Vm = 22,4 л/моль
V(H2) = n·Vm = 0,55·22,4 = 12,32 л
Відповідь:
V(H2) = 12,32 л
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
m(AgNO3) = 85 г
w(AgNO3) = 2%
m(Ag) ?
Δm — ?
shkola.in.ua
Рівняння реакцій:
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Розв’язання:
m(AgNO3) = 0,02 · 85 = 1,7 г
M(AgNO3) = 108 + 14 + 48 = 170 г/моль
n(AgNO3) = m/M = 1,7/170 = 0,01 моль
За рівнянням реакції 2 моль AgNO3 утворюють 2 моль Ag, отже
n(Ag) = n(AgNO3) = 0,01 моль
m(Ag) = n · M = 0,01 · 108 = 1,08 г
Цинку витратиться вдвічі менше (1 моль Zn на 2 моль
AgNO3):
n(Zn) = 0,01/2 = 0,005 моль
m(Zn) = 0,005 · 65 = 0,325 г
Зміна маси пластинки:
Δm = m(Ag) − m(Zn) = 1,08 − 0,325 = 0,755 г
Відповідь:
m(Ag) = 1,08 г; маса пластинки
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
стані.
Рівняння реакції:
Fe + 2HCl
Сторінка 167 223. Алюміній
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Mg + 2H2O → Mg(OH)2 + H2 (дуже
Модель: магній
Цинк
Реакція не відбувається.
Модель: атоми
Ряд металів за зменшенням активності (за
K > Ca > Mg > Zn
Порівняння з рядом активності металів
Отриманий експериментальний ряд повністю
калій є найактивнішим, далі
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
г/л.
Відомо:
V
= 1 л Розчинність CO2 за н. у. = 1,73 г
Розчинність CO2 за 25°C = 1,45 г
ρ(CO2) за н. у. = 1,977 г/л
ρ(CO2) за 25°C = 1,8 г/л
Знайти:
V(CO2) за н. у.
V(CO2) за 25°C
Розв’язок:
Знайдемо об’єм
За н. у.:
V(CO2) = 1,73 / 1,977 ≈ 0,875 л.
За 25°C:
V(CO2) = 1,45 / 1,8 ≈ 0,806
231.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
1. З магній оксидом:
MgO + CO2 = MgCO3
2. З натрій оксидом:
Na2O + CO2 = Na2CO3
3. З натрій гідроксидом:
2NaOH + CO2 = Na2CO3 + H2O
4. З калій гідроксидом:
2KOH + CO2 = K2CO3 + H2O
5. З барій гідроксидом:
Ba(OH)2 + CO2 = BaCO3 + H2O
Відомо: V(CO2) = 1,12 м3 = = 1120 л (н. у.)
m(CaCO3) ? shkola.in.ua
Розв’язання:
CaCO3 = CaO + CO2
н. у. 1 моль газу займає 22,4 л.
кількість речовини CO2: n(CO2) = 1120 / 22,4 = 50 моль Отже, n(CaCO3) = 50 моль. Знайдемо молярну масу CaCO3: M(CaCO3) = 40 + 12 + 16·3 = 100 г/моль
m = n · M = 50 · 100 = 5000 г = 5
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Відомо:
m(NaHCO3) = 10 г
m(HCl) ?
V(CO2) (н. у.) — ? shkola.in.ua
Розв’язання:
Запишемо рівняння реакції:
NaHCO3 + HCl = NaCl + H2O + CO2
Знайдемо кількість речовини соди:
M(NaHCO3) = 23 + 1 + 12 + 16·3 = 84 г/моль
n(NaHCO3) = 10 / 84 ≈ 0,119 моль
За рівнянням реакції:
n(HCl) = n(NaHCO3) = 0,119 моль
n(CO2) = n(NaHCO3) = 0,119 моль
Знайдемо масу гідроген хлориду:
M(HCl) = 1 + 35,5 = 36,5 г/моль
m(HCl) = 0,119 · 36,5 ≈ 4,34 г
Знайдемо об’єм вуглекислого газу (н. у.):
V(CO2) = n · 22,4 = 0,119 · 22,4 ≈ 2,67 л
Відповідь:
Для «гасіння» 10 г соди
Відомо:
Vпов = 45 м3 = = 45000 л (н. у.) ���� (��������2 )
= 0,056 % = = 0,00056
m(Ca(OH)2) ? shkola.in.ua
V(CO2) = 45000 · 0,00056 = 25,2 л
Запишемо рівняння реакції: Ca(OH)2 + CO2 = CaCO3↓ + H2O
н. у. 1 моль газу
22,4 л. Знайдемо кількість речовини CO2: n(CO2) = 25,2 / 22,4 = 1,125 моль За рівнянням реакції: n(Ca(OH)2) = n(CO2) = 1,125 моль Знайдемо молярну масу Ca(OH)2: M(Ca(OH)2) = 40 + 16·2 + 1·2 = 74 г/моль
m = n · M = 1,125 · 74 = 83,25 г
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
m(CO2) = 1 кг = = 1000 г
Поглинач: CaO Розв’язання:
m(CaO) ? shkola.in.ua
CaO + CO2 = CaCO3
Знайдемо кількість речовини вуглекислого газу:
M(CO2) = 12 + 16·2 = 44 г/моль
n(CO2) = 1000 / 44 ≈ 22,73 моль
За рівнянням реакції:
n(CaO) = n(CO2) = 22,73 моль
Знайдемо молярну масу кальцій оксиду:
M(CaO) = 40 + 16 = 56 г/моль
Знайдемо масу кальцій оксиду:
m(CaO) = 22,73 · 56 ≈ 1273 г ≈ 1,27 кг
Відповідь:
Відомо: V(CH4) = 560 л (н. у.)
m(CaCO3) ? shkola.in.ua
Розв’язання:
CH4 + 2O2 = CO2 + 2H2O
За рівнянням: з 1 моль CH4 утворюється 1 моль CO2. Знайдемо кількість речовини метану: n(CH4) = 560 / 22,4 = 25 моль
Отже, n(CO2) = 25 моль
2. Запишемо рівняння реакції одержання кальцій
карбонату: Ca(OH)2 + CO2 = CaCO3↓ + H2O
За рівнянням: 1 моль CO2 → 1 моль CaCO3 Отже, n(CaCO3) = 25 моль
3. Знайдемо молярну масу CaCO3: M(CaCO3) = 40 + 12 + 16·3 = 100 г/моль
Знайдемо масу осаду: m(CaCO3) = n · M = 25 · 100 = 2500 г = 2,5 кг Відповідь: Із 560 л метану можна
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Сторінка 177
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
екстракція, тобто вибіркове розчинення
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
4.
Сторінка 182
Поміркуйте
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
4.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
6. Що ви спостерігаєте?
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Як працюють такі прилади (основні типи сенсорів):
1. Електрохімічний сенсор:
електричний сигнал, і прилад вмикає
побуті).
2. Напівпровідниковий (metal-oxide): при потраплянні CO змінюється
і спрацьовує сигнал.
3. Біоміметичний: гель змінює колір, коли поглинає CO,
C5H11OH (C5H12O).
5·12 + 12·1 + 16 = 88.
60.
60/88
0,68 (68%).
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
бензин має згоряти кіптявим полум’ям?
Метан має формулу CH4.
Молярна маса: 12 + 4·1 = 16.
Маса Карбону: 12.
Масова частка Карбону: 12/16 = 0,75 (75%).
Бензин умовно має формулу C8H18.
Молярна маса: 8·12 + 18·1 = 96 + 18 = 114.
Маса Карбону: 96.
Масова частка Карбону: 96/114 ≈ 0,84 (84%).
Отже, у бензині масова частка
Рівняння повного окиснення:
CH4 + 2O2 = CO2 + 2H2O
2C8H18 + 25O2 = 16CO2 + 18H2O
Оскільки бензин
3O4) = 1 кг = = 1000 г
V(CO) ? shkola.in.ua
Розв’язання:
реакції: Fe3O4 + 4CO = 3Fe + 4CO2
Молярна маса Fe3O4: 3·56 + 4·16 = 232 г/моль.
Кількість речовини Fe3O4: n = 1000 / 232 ≈ 4,31 моль.
рівнянням реакції на 1 моль Fe3O4 потрібно 4 моль CO,
отже: n(CO) = 4 · 4,31 ≈ 17,24 моль.
Об’єм за н. у.: V = 17,24 · 22,4 ≈ 386 л.
Відомо:
V(C8H18) = 1 л
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
ρ(C8H18) = 750 г/л
m(CO) = 200 г
ω(C8H18), % ? shkola.in.ua
Розв’язання:
М(CO) = 12 + 16 = 28 г/моль
n(CO) = 200 / 28 ≈ 7,14 моль
Рівняння (неповне згоряння):
2C8H18 + 17O2 = 16CO + 18H2O
З рівняння:
16 моль CO утворюються з 2 моль C8H18, тобто
1 моль C8H18 → 8 моль CO
n(C8H18) = 7,14 / 8 ≈ 0,893 моль
М(C8H18) = 8·12 + 18·1 = 114 г/моль
m(C8H18, що згорів з утворенням CO) = 0,893 · 114 ≈ 102 г
Маса 1 л бензину:
m(усього) = ρ · V = 750 · 1 = 750 г
Масова частка:
ω = 102 / 750 ≈ 0,136 = 13,6 %
Відповідь: приблизно 13,6 % бензину
чадного газу.
Сторінка 192
Розуміння
Сторінка
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
розчинення.
Відомо:
m(води) = 1000 г
m(CH4) = 0,04 г
m(CO2) = 3,5 г
m(O2) = 0,07 г
ω(CH4), ω(CO2), ω(O2) — ?
shkola.in.ua
Розв’язання:
Для метану:
m(розчину) = 1000 + 0,04 = 1000,04 г
ω(CH4) = 0,04 / 1000,04 · 100% ≈ 0,004 %
Для вуглекислого газу:
m(розчину) = 1000 + 3,5 = 1003,5 г ω(CO2) = 3,5 / 1003,5 · 100% ≈ 0,349 %
Для кисню:
m(розчину) = 1000 + 0,07 = 1000,07 г
ω(O2) = 0,07 / 1000,07 · 100% ≈ 0,007 %
Висновок:
ω(CO2) > ω(O2) > ω(CH4).
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
• за участю бактерій,
• із гною, харчових відходів, рослинних решток,
Для цього використовують спеціальні установки — біореактори або метантенки.
Біогаз використовують:
• як паливо для опалення і приготування їжі, • для виробництва електроенергії, • як заміну природному газу, • залишки
кг. Відомо: m(води) = 1000 кг = = 1 000 000 г Розчинність CH4: 0,04 г на 1000 г
V(CH4)
розчиниться: m(CH4) = 0,04 · 1000 = 40 г
М(CH4) = 16 г/моль n(CH4) = 40 / 16 = 2,5 моль
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
років: 1500 : 34 ≈
Сторінка 198
1.
2.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
3. Є відомі
для одоризації газу.
4. Бувають і випадки, коли сильний
у Сан-Антоніо, 18 червня 2025).
272. Природний
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
m(Al4C3) = 360 г Розв’язання:
V(CH4) ?
shkola.in.ua
М(Al4C3) = 4·27 + 3·12 = 108 + 36 = 144 г/моль
n(Al4C3) = 360 / 144 = 2,5 моль
Рівняння реакції: Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
З рівняння:
1 моль Al4C3 → 3 моль CH4
n(CH4) = 2,5 · 3 = 7,5 моль
V(CH4) = 7,5 · 22,4 = 168 л
Відповідь: V(CH4) = 168 л.
200
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Сторінка 203
Поміркуйте
природний газ і виробництво цементу. Найбільше викидів
вугілля.
Причини збільшення викидів:
• зростання кількості заводів і фабрик;
• збільшення кількості транспорту;
• більше спалюють палива (вугілля, нафти, газу);
• зростання населення і
Сторінка 204
Поміркуйте
Порівняйте
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html

1.

https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html





https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
1. Середня температура на Землі буде підвищуватися
2.
3. Льодовики
4.
5. Кліматичні умови
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Неправильне. Земна поверхня випромінює
■
атмосферою.
Правильне. Відбивається
Сторінка
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
пристосуватися.
Листівка 2 (заклична)
ЩО МОЖЕ ЗРОБИТИ КОЖЕН?
• Економити електроенергію і тепло.
• Частіше ходити пішки або користуватися громадським транспортом.
• Менше користуватися одноразовими речами.
• Сортувати сміття.
• Саджати дерева і берегти природу.
Навіть маленькі дії багатьох людей дають великий результат!
Листівка 3 (коротка, для швидкого читання)
ЗЕМЛЯ ПЕРЕГРІВАЄТЬСЯ!
• Причина: надлишок парникових газів
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
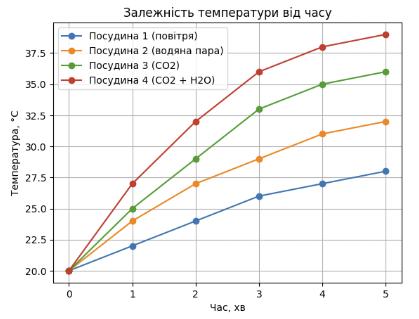
2.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
зберігають тепло.
3. Чи можна стверджувати,
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
Calcify (Carbon Footprint
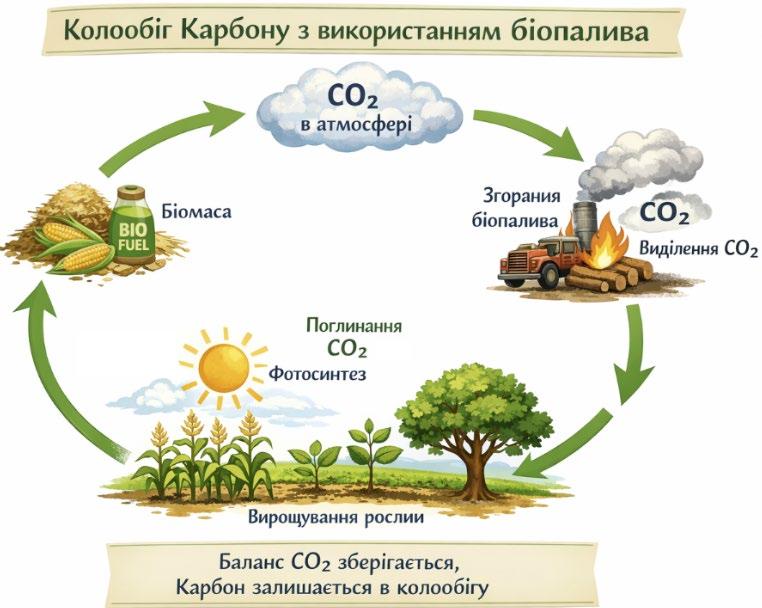
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
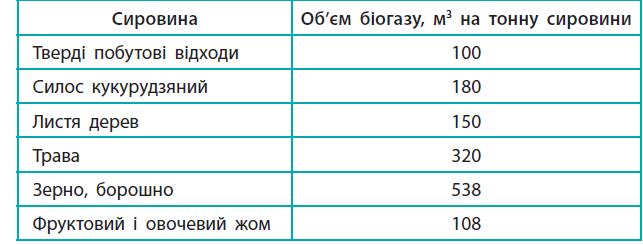
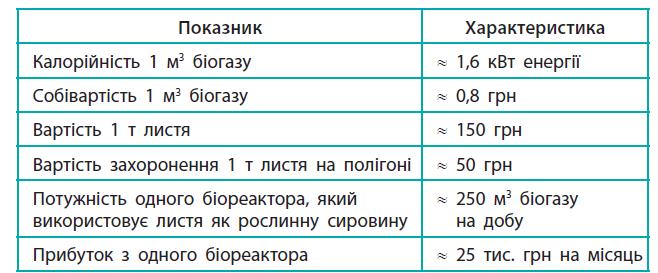
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
250 × 1,6 = 400
400 ×
=
12 000 × 4 ≈ 48 000 грн на місяць.
Отже, економія на електроенергії становить приблизно
добре узгоджується
• Сортуйте сміття.
• Саджайте дерева.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
посудині.
Сторінка 221
Що ми маємо зробити?
1. Для дослідження обрано
групах).
2. Рівняння реакції:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Молярна маса CaCl2 = 111 г/моль
Молярна маса CaCO3 = 100 г/моль Для повного перебігу
CaCl2. 3.
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
https://shkola.in.ua/2417-hdz-khimiia-8-klas-hryhorovych-2016.html
