https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html









































































































1.1
1.2
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
змінюється форма, агрегатний стан, розміри речовини.
відбуваються зміни.
змінюється склад, утворюються нові речовини.
shkola.in.ua
1.3 Хімічні реакції завжди супроводжуються
1.Утворення або поглинання газу.
2.Утворення або зникнення осаду.
3.Зміна смаку.
4. Зміна кольору.
5.Зміна запаху.
6. Виділення або поглинання температури.
7.Випромінювання або поглинання світла.

https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
1.6 Прочитайте
відповідними літерами.
A – деревна тирса (спливає на поверхні води).
B – глина (залишається нерозчиненою у воді).
C – кухонна сіль (розчиняється у воді). shkola.in.ua
D – залізні ошурки (відділяються магнітом).
Сторінка 5
2.1 Доповни визначення йонів Йони — це
заряд:
2.3
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Cl⁻ O²⁻ N³⁻
K⁺ KCl K₂O K₃N
Ca²⁺ CaCl₂ CaO Ca₃N₂
Al³⁺ AlCl₃ Al₂O₃ AlN
Сторінка 6
2.4 Гра «Хрестики й нулики».
сполук.
shkola.in.ua
2.5 Запишіть назви речовин
Na₂O натрій оксид
MgS — магній сульфід
AlP — алюміній фосфід
P₂O₃ — фосфор(III) оксид
SnS₂ — станум(IV) сульфід
MgO — магній оксид
K₂O — калій оксид
MgCl₂ магній хлорид
shkola.in.ua
2.6 Запишіть формули сполук.
калій оксид K₂O
сульфур(VI) оксид — SO₃
фосфор(V) оксид — P₂O₅
кальцій сульфід — CaS
фосфор(III) оксид — P₂O₃
арґентум(1+) фосфід — Ag₃P
ферум(2+) бромід — FeBr₂
арсен(V) оксид As₂O₅
GaBr₃ галій бромід
CS₂ — карбон дисульфід
MnS — манган(II) сульфід
CuCl₂ — купрум(II) хлорид
BaI₂ — барій йодид
Mg₃P₂ — магній фосфід
Ca₃P₂ — кальцій фосфід
LiBr літій бромід
купрум(1+) нітрид Cu₃N
манган(2+) фторид — MnF₂
хром(3+) сульфід — Cr₂S₃
цинк оксид — ZnO
ауром(3+) оксид — Au₂O₃
бром(V) оксид — Br₂O₅
ванадій(3+) сульфід — V₂S₃
плюмбум(2+) нітрид Pb₃N₂ shkola.in.ua
2.7
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
амоніак — NH₃ (Гідроген + Нітроген)
фосфін — PH₃ (Гідроген + Фосфор)
арсин — AsH₃ (Гідроген + Арсен)
стибін — SbH₃ (Гідроген + Стибій) shkola.in.ua
2.9 Підкресліть формули речовин, які за наведеними
окиснення) хімічних
правильні.
Неправильно Правильно
SiO₄ SiO₂
NaO Na₂O
CS CS₂ shkola.in.ua
2.10
формулах речовин.
Cr₂O₃ → Cr³⁺ O²⁻
SF₆ → S⁶⁺ F⁻
Ca₃P₂ → Ca²⁺ P³⁻
Al₄C₃ → Al³⁺ C⁴⁻
CaF₂ → Ca²⁺ F⁻
PCl₅ → P⁵⁺ Cl⁻
CuO → Cu²⁺ O²⁻
NO₂ → N⁴⁺ O²⁻
HF → H⁺ F⁻
SiO₂ → Si⁴⁺ O²⁻ shkola.in.ua
8
Cl₂O₇ → Cl⁷⁺ O²⁻
MnO₂ → Mn⁴⁺ O²⁻
H₂Se → H⁺ Se²⁻
Cu₂O → Cu⁺ O²⁻
Na₂O → Na⁺ O²⁻
HCl → H⁺ Cl⁻
I₂O₅ → I⁵⁺ O²⁻
K₂S → K⁺ S²⁻
CCl₄ → C⁴⁺ Cl⁻
NaCl → Na⁺ Cl⁻
FeCl₃ → Fe³⁺ Cl⁻
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
shkola.in.ua
3.3
3.4
He, F, Zn, K, N, S, Ca, Cl, B, Fe.
Розв’язання (Ar): He 4; B 11; N 14; F 19; S 32; Cl 35; K 39; Ca 40; Fe 56; Zn 65.
Сторінка 9
3.5
разів.
Розв’язання (Ar):
He = 4, N = 14, O = 16, S = 32, Fe = 56, Si = 28, C = 12, Cu = 64, Ca = 40, Na = 23, Li = 7)
> Ar(He) 12 / 4 =
(Ar): Cu = 64, C = 12, O = 16, P = 31, Si = 28, Cr = 52, Mn = 55, F = 19, Ne = 20, Ag = 108, Hg = 201. shkola.in.ua
= 2·64 = 128 > 10·Ar(C) = 10·12 = 120
= 4·16 = 64 < 3·Ar(P) = 3·31 =
= 4·19 = 76 > 3·Ar(Ne) = 3·20 = 60
= 6·108 = 648 > 3·Ar(Hg) = 3·201 = 603
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Сторінка 10
3.8
маса атома більшa за 1/12 маси атома Карбону-12.
дорівнює сумі відносних атомних мас усіх атомів у молекулі. - відносні, - не мають одиниць, - використовуються для обчислень у хімії.
shkola.in.ua
shkola.in.ua
3.9
Розв’язання (Ar): H=1, C=12, N=14, O=16, Na=23, Mg=24, Al=27, Si=28, P=31, S=32, Cl=35, K=39, Ca=40, Cr=52, Cu=64, Ag=108):
Mr(Cl₂) = 2·35 = 70 shkola.in.ua
Mr(CaO) = 40 + 16 = 56
Mr(H₂S) = 2·1 + 32 = 34
Mr(CaSO₄) = 40 + 32 + 4·16 = 136
Mr(CaCO₃) = 40 + 12 + 3·16 = 100
Mr(H₂SO₄) = 2·1 + 32 + 4·16 = 98
Mr(K₂SO₄) = 2·39 + 32 + 4·16 = 174
Mr(Na₃PO₄) = 3·23 + 31 + 4·16 = 164
Mr(Cu(NO₃)₂) = 64 + 2·(14 + 3·16) = 64 + 2·62 = 188
Mr(Cr₂(SO₄)₃) = 2·52 + 3·(32 + 4·16) = 104 + 3·96 = 392
Mr(Ag(NH₃)₂OH) = 108 + 2·(14 + 3·1) + (16 + 1) = 108 + 34 + 17 = 159
11 3.10
Ar: C = 12, H = 1.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
формулу перекису водню.
Розв’язання: Відношення
Mr(HO) = 1 + 16 = 17.
Mr(H₂O₂) = 2 · 17 = 34. shkola.in.ua
34 : 17 = 2, отже у
(Fe, Ar = 56)
FeS: Mr = 56 + 32 = 88 (не підходить, бо в умові Mr = 120).
FeS₂: Mr = 56 + 2·32 = 56 + 64 = 120. shkola.in.ua
Відповідь: формула піриту — FeS₂.
3.13 Прочитайте завдання №24 у
молекулярну масу жасмоналю.
Розв’язання:
Формула жасмоналю: C₆H₅CHC(C₅H₁₁)CHO.
Підрахуємо кількість атомів: C = 14, H = 18, O = 1. shkola.in.ua
Mr = 14·12 + 18·1 + 16 = 168 + 18 + 16 = 202.
Відповідь: Mr(C₁₄H₁₈O) = 202.
3.14 Закріпимо нові знання.
Сторінка 12 4. Масова частка
(S, Ar = 32).
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
1) NO₂ shkola.in.ua
7) Na₂SO₄
8)
9) Ca(NO₃)₂ �������� (��������(��������3 )2 ) = 40 +2 ⋅ (14 +3 ⋅ 16) =
1. C6H12O6
2. C12H22O11
Обчислити:
ω(O) — ?
shkola.in.ua
4.4
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Відомо: ��������3 Розв’язання: shkola.in.ua
3.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Відомо: ����(��������2 ����3 ) = 1т = = 1000 кг
Обчислити: ����(�������� )—?
Розв’язання: shkola.in.ua
�������� (��������2 ����3 ) =2 ⋅�������� (�������� ) +3 ⋅�������� (����) =2 ⋅ 56 +3 ⋅ 16 = 112 + 48 = 160 Обчислимо масову
ω(�������� ) = 2 ⋅�������� (�������� ) �������� (��������2 ����3 ) = 112 160 =0,7 або 70%
Феруму.
відбуваються технологічні втрати.
Додатково:
Назва гематит походить від грец. haima — «кров»,
назви
орнаментів
Сторінка 14
4.8 Обчисліть
(H = 1, O = 16, Na = 23, Ca = 40, Fe = 56, Pb = 207, Al = 27, Zn = 65, Br = 80, Cl = 35,5)
Pb �������� (������������) = 207 + 16 = 223
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Crx Oy
1. Визначимо відносну формульну масу сполуки:
�������� = ����(Cr) ⋅�������� (Cr) ���� (Cr) = 1 ⋅ 52 0,52 = 100
2. Маса Оксигену: shkola.in.ua
100 52 = 48
3. Число атомів Оксигену:
48 ∶ 16 =3
Відповідь: CrO3 .
5.2 Визначте хімічну формулу
Оксигену становить 63,2%.
Відомо: ���� (O) = 63,2% =0,632
Необхідно визначити: хімічну формулу сполуки.
Nx Oy
1. Визначимо відносну формульну масу сполуки: �������� = ����(O) ⋅�������� (O) ���� (O) = 1 ⋅ 16 0,632 = 25,32
2. Маса Нітрогену: shkola.in.ua 25,32 16 =9,32
3. Число атомів Нітрогену: 9,32 ∶ 14 =0,665 (дробове)
4. Домножуємо індекси на 3 → N2 O3 .
Відповідь: N2 O3
5.3 Визначте хімічну формулу
становить 81,82%.
Відомо: ���� (C) = 81,82% =0,8182.
визначити:
Cx Hy
1. Визначимо відносну
2.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
�������� = 184.
Cux Fey Sz
1.
2. Для Феруму:
3. Для Сульфуру:
shkola.in.ua
формула
1. Для Феруму: shkola.in.ua
232.
2.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
(Al) = 52,9%
1.
2.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Відомо:
���� (Me) = 60% =0,60. �������� = 100 (беремо умовно, бо не задано).
Необхідно визначити: хімічну формулу сполуки.
Mex Oy
1. Для металічного елемента: shkola.in.ua
����(Me) = 100 ⋅���� (Me) �������� (Me)
Припустимо, що цим металом є Магній (�������� (Mg) = 24): ����(Mg) = 100 ⋅ 0,60 24 = 60 24 =2,5
2. Для Оксигену: w(O) =1 w(Me) =1 0,60 =0,40
����(O) = 100 ⋅���� (O) �������� (O) = 100 ⋅
3. Відношення атомів 2,5 : 2,5 = 1 : 1. Відповідь: формула сполуки MgO. Назва:
Сторінка 17 6. Кількість речовини. Молярна
6.1 Основні поняття:
Кількість речовини (n) —
частинок (атомів, молекул, йонів) у
Позначається: (n). shkola.in.ua
Одиниця вимірювання: моль (моль).
1 моль — це кількість речовини, яка містить
Число Авогадро (�������� ) — кількість частинок в 1
речовини. �������� =6.02 ⋅ 1023 частинок/моль
Молярна маса (M) —
Позначається: M.
Одиниця вимірювання: г/моль.
Чисельно дорівнює відносній
Відносна молекулярна маса (�������� ) —
6.5
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
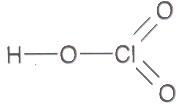
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
19
сама кількість молекул.
Кисень
Хімічна формула: ����2
Молярна маса:
���� (����2 ) =2 ⋅�������� (���� ) =2 ⋅ 16 = 32 г/моль
Кількість речовини:
����(����2 ) = ���� ���� = 48 32 =1.5 моль shkola.in.ua
Сірка
Хімічна формула: ����8
Кількість речовини:
����(����8 ) = ����(����2 ) =1.5 моль
Молярна маса:
���� (����8 ) =8 ⋅�������� (����) =8 ⋅ 32 = 256 г/моль
Маса:
����(����8 ) = ����⋅���� =1.5 ⋅ 256 = 384 г
Відповідь: маса сірки становить
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
сульфіду кількістю речовини 1 моль.
Відомо:
����(FeS) = 1моль
����(Fe) ?
����(S) — ?
����(Fe)
���� (S) —?
Розв’язання:
Рівняння реакції:
Fe +S → FeS
За рівнянням: shkola.in.ua
����(Fe) ∶����(S) =1 ∶ 1
Коефіцієнти 1 і 1 ⇒ змішувати у рівних кількостях речовини.
Для ����(FeS) =1 моль маємо: ����(Fe) = 1 моль, ����(S) = 1 моль.
Маси реактантів:
����(Fe) = ����(Fe) ⋅���� (Fe), ����(S) = ����(S) ⋅���� (S)
���� (Fe) = �������� (Fe) = 56 г/моль, ���� (S) = �������� (S) = 32 г/моль ����(Fe) =1 ⋅ 56 = 56 г, ����(S) =1 ⋅ 32 = 32 г
Відповідь: змішувати у відношенні ����(Fe) ∶����(S) =1 ∶ 1. Для добування 1 моль FeS потрібно ����(Fe) = 56 г і ����(S) = 32 г.
Сторінка 23
8.1
(N₂) 78 %
(O₂) 21 % shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Сторінка 27
9.5
- Отримують малі кількості речовини;
- Потрібні невеликі реактори, пробірки;
- Використовується для навчання і дослідів;
- Реакції короткотривалі, контроль простий.
Сторінка 28
9.7
Промисловий спосіб
- Отримують великі обсяги речовини;
- Використовують великі установки, тиск, каталізатори; - Використовується для виробництва; - Реакції безперервні,
shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
дзеркальне покриття. Вакуум
теплове випромінювання. shkola.in.ua
③ Які є обмеження
тощо). ① Зробіть підписи до малюнків.
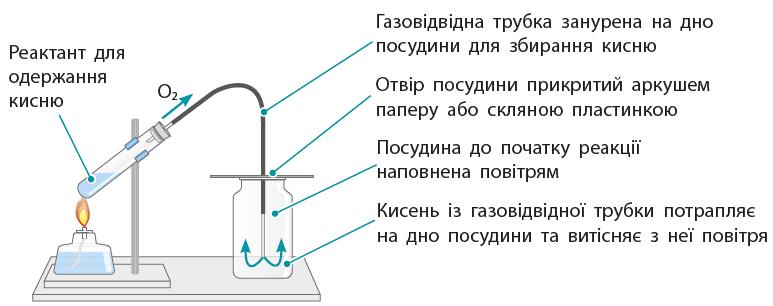
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
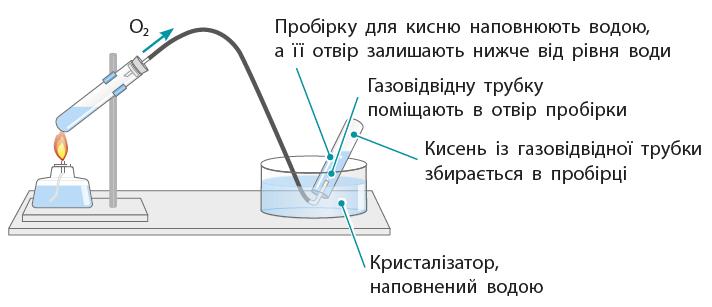
shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
2Mg + O₂ → 2MgO
4P + 5O₂ → 2P₂O₅
4Fe + 3O₂ → 2Fe₂O₃
2H₂ +
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
плюмбум(IV) оксид — PbO₂
купрум(1+) оксид — Cu₂O
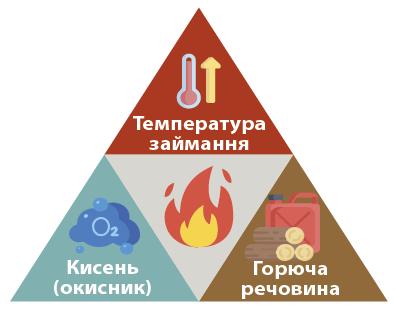
- швидке окиснення; - є полум’я; - виділяється багато тепла й світла.
Повільне окиснення Горіння
- виділення енергії (тепла);
- виділяється небагато тепла. - реакції окиснення; - участь кисню;
- повільна реакція; - без полум’я;
- швидке, але не миттєве;
- полум’я звичайне;
- виділення газів помірне.
- утворюються продукти-оксиди shkola.in.ua
shkola.in.ua
вибух
- окиснення з виділенням тепла/світла;
- потрібна температура займання й окисник
shkola.in.ua
shkola.in.ua
- надзвичайно швидке (миттєве);
- різке утворення великої кількості газів;
- ударна хвиля й руйнування.
–
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
(водою);
– перекривають доступ повітря (піском, ковдрою,
газу чи пального).
10.7 Запишіть рівняння реакцій із киснем простих речовин:
а) літію — 4�������� + ����2 → 2��������2 ���� б) кальцію — 2�������� + ����2 → 2������������
силіцію — �������� + ����2 → �������� ����2
фосфору — 4���� +5����2 → 2����2 ����5 Сторінка 34
10.8
оксиду — ����2 + ����2 → 2��������

https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
а) H₂S + 3O₂ = SO₂ + H₂O 2H₂S + 3O₂ → 2SO₂ + 2H₂O
б) CuO + HCl = CuCl₂ + H₂O CuO + 2HCl → CuCl₂ + H₂O
в) ZnS + O = ZnO + SO₂ 2ZnS + 3O₂ → 2ZnO + 2SO₂
г) Ca + Br₂ = CaBr Ca + Br₂ → CaBr₂
Ag 2 O,
HgO
Обчислити:
розкладу: 2Ag 2 O → 4Ag +O2 ,2HgO → 2Hg +O2 . �������� (Ag) = 108, �������� (Hg) = 201, �������� (O) = 16. Молярні маси: ���� (Ag 2 O) =2�������� (Ag) + �������� (O) =2 ⋅ 108 + 16 = 232 г/моль, ���� (HgO) = �������� (Hg) + �������� (O) = 201 + 16 = 217 г/моль.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
����1 (���� ) у Ag 2 O; ����2 (���� ) у HgO; зробити
висновок.
shkola.in.ua
���� (���� ) = �������� (O) ���� (сполуки) ⋅ 100%.
����1 (���� ) = 16 232 ⋅ 100% =6,9%,
����2 (���� ) = 16 217 ⋅ 100% ≈ 7,4%. Висновок: 6,9% < 7,4%, тому
36
19,2 г.
Відомо:
(��������2 ) = 19,2 г Розв’язання: Реакція: ��������2 +3
Обчислити: ����(����2 ) ?
shkola.in.ua
����(����2 ) = 11,2 г
Обчислити: ����(����) ? shkola.in.ua
1. ����(����2 ) = ����(����2 ) ���� (����2 ) = 11,2 32 =0,35 моль
2.Зарівняннямреакції ����(����) = ����(����2 ) =0,35 моль
3. ����(����) = ����(����) × ���� (����) =0,35 × 32 = 11,2 г
Відповідь: 11,2 г
Обчислити: ����(O2 )
shkola.in.ua
����(CH4 ) = 4 г Розв’язання: Реакція: CH4 +2O2 →CO2 +2H2 O ����(CH4 ) = ����(CH4 ) ���� (CH4 ) = 4 16 =0,25 моль ����(O2 ) =2 ⋅����(CH4 ) =2 ⋅ 0,25 =0,50 моль
����(O2 ) = ����(O2 ) ⋅���� (O2 ) =0,50 ⋅ 32 = 16 г
Відповідь: 16 г.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
клітинах. shkola.in.ua У ракетній техніці:
як окисник пального;
забезпечує роботу ракетних двигунів.
У металургії:
для зварювання й різання металів;
О2
забезпечує згоряння пального;
підвищує потужність двигунів.
приклади:
прискорює горіння в доменних печах. У медицині: – подається хворим при
акваріуми з аераторами;
кисневі коктейлі;
використання в дайвінгу.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
= 20 дм3/год t = 6 уроків = 4,5 год O2 в
= 21 % = 0,21
����1 = 20 ⋅ 4,5= 90 дм3 2.
shkola.in.ua
Сторінка
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
рештках.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Для знезараження води, очищення повітря, вибілювання тканин і паперу, а також для обробки харчових продуктів від бактерій.
У супермаркетах: Для знезараження повітря, холодильних камер і продовження терміну зберігання овочів, фруктів, м’яса та риби. shkola.in.ua У медицині: Для дезінфекції приміщень і медичних інструментів, лікування ран, шкірних захворювань, у складі озонотерапії. У закладах громадського харчування: Для очищення та дезінфекції води, посуду, кухонного обладнання й повітря, щоб запобігти поширенню мікроорганізмів. О3
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Сторінка 44
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
45
Відомо:
n(O2) = 1 моль.
m(O2) – ?
Відомо:
���� (����2 ) = 1 л (н. у.), �������� = 22,4 л/моль.
Розв’язання:
����(����2 ) = ����(����2 ) ⋅���� (����2 ) ���� (����2 ) = 32 г/моль ����(����2 ) = 1 моль ⋅ 32 г/моль = 32 г
Відповідь: маса важка
Розв’язання: Спочатку знайдемо кількість речовини: ����(����2 ) = ���� (����2 ) �������� ����(����2 ) = 1 л 22,4 л/моль ≈ 0,0446 моль
Тепер масу: ����(����2 ) = ����(����2 ) ⋅���� (����2 ) ����(����2 ) ≈ 0,0446 моль ⋅ 32 г
на малюнку.
Хімічна формула вуглекислого
CO2
Молярна маса: M(CO2) = 12 + 16 ∙ 2 = 44
Кількість речовини: shkola.in.ua ���� = ���� ���� = 33 44 =0,75 моль
Об’єм (н. у.): ���� = ����⋅�������� =0,75 ⋅ 22,4= 16,8 л
Відповідь: 16,8 л.
малюнку. Обчисліть
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
NH3
Водень H2
(n), моль (m), г (M), г/моль (V) (за н. у.), л
���� (����2 ) = 2 г/моль,
���� = 1 2 =0,5 моль,
���� = ������������ =0,5 ⋅ 22,4= 11,2 л
Азот N2 (V = 1,12 л)
���� (����2 ) = 28 г/моль,
���� = ���� �������� = 1,12 22,4 =0,05 моль,
���� = �������� =0,05 ⋅ 28 =1,4 г
Кисень O2 (m = 256 г)
���� (����2 ) = 32 г/моль,
���� = 256 32 = 8 моль,
���� =8 ⋅ 22,4= 179,2 л
Амоніак NH3 (n = 0,5 моль)
���� (��������3 ) = 17 г/моль,
���� =0,5 ⋅ 17 =8,5 г,
���� =0,5 ⋅ 22,4= 11,2 л
shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Урахувати: температуру, тиск, втрати газу та точність вимірювань.
Запишіть обладнання та реактанти, з якими ви працюватимете.
Обладнання: кристалізатор, конічна колба, корок з газовідвідною трубкою, мірні
циліндри, ваги, фільтрувальний папір
Речовини: H2O2 (3 %), CaCO3, оцтова кислота (6 %), розчин NaCl (10 %)
① Занотуйте умови здійснення експерименту:
Температура 20 °C
Тиск (мм рт. ст.) 760
Тиск (Па) 101000
② Визначення молярного об’єму
shkola.in.ua Точне значення
(розч. H2O2) = 5,5 мл ρ(розч. ����2 ����2 ) = 1 г/
(����2 ����2 ) = 3%
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
(��������2 ) =
наважки крейди. shkola.in.ua
Хімічне рівняння реакції:
���� (������������ ����3 ) = 100 г/моль
����(������������ ����3 ) = 0,32 100 =0,0032 моль
����(��������2 ) = ����(������������ ����3 ) =0,0032 моль
Виміряне значення
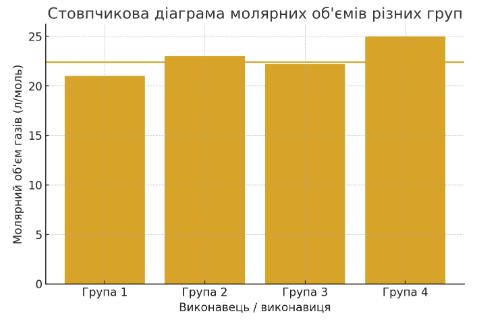
�������� = ����н.у. ���� = 0,0670 0,0032 ≈ 20,9 л/моль
Сторінка 50 Складіть
3
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
14.2 Заповніть таблицю. Характеристика
Хімічні елементи, які містяться у складі оксидів
Приклади оксидів
Na2O + H2O = 2NaOH
б) SO2 + H2O = H2SO3
в) CO2 + H2O = H2CO3
г) P2O5 + 3H2O = 2H3PO4
д) SO3 + H2O = H2SO4
е) BaO + H2O = Ba(OH)2
ж) K2O + H2O = 2KOH
и) N2O5 + H2O = 2HNO3 Сторінка 53
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Карбонатна (вугільна)
Нітратна
Нітритна (азотиста)
Силікатна (кремнієва)
Сульфатна (сірчана)
Сульфітна (сірчиста)
Ортофосфатна (фосфорна)
Хроматна (хромова)
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
а) K2O + H2O = 2KOH
б) SO2 + H2O = H2SO3
в) Na2O + H2O = 2NaOH
14.12
CaO + H2O = Ca(OH)2
shkola.in.ua
г) P2O5 + 3H2O = 2H3PO4
д) BaO + H2O = Ba(OH)2
е) SiO2 + H2O –
Сторінка 55
14.14
магнію: Mg(OH)2
стануму(2+): Sn(OH)2
феруму(2+): Fe(OH)2
14.15
SO3 + H2O → H2SO4; Na2O + H2O → 2NaOH; CaO + H2O → Ca(OH)2. shkola.in.ua
г) хрому(3+): Cr(OH)3
д) барію: Ba(OH)2
е) купруму(2+): Cu(OH)2
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Друга серія пробірок (метилоранж)
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Чи можна її замінити на водопровідну
спотворити результати. shkola.in.ua
4. Зважаючи на відомі вам якісні реакції
зміна забарвлення
Сторінка 58
Обладнання: одноразові стаканчики, ніж, лійка, фільтр, тертка.
Речовини: буряк, наявні зразки засобів
Опишіть колір індикаторів,
2
3 період
4
5
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html



https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Сторінка 62
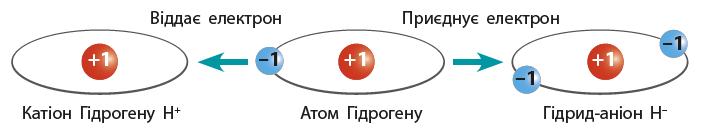
H2 + O2 → H2O
+ Cl2 → 2HCl
H2 + S → H2S
N2 + 3H2 → 2NH3
H2 + F2 → 2HF
C + 2H2 → CH4
2Na + H2 → 2NaH
+ H2 → MgH
+ H2 → CaH2
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Сторінка 63
16.4 Запишіть рівняння
а) Ag2O + H2 → 2Ag + H2O
б) MnO + H2 → Mn + H2O
16.5 Приклади розв’язання
Сторінка 64
НАВЧАЛЬНЕ ДОСЛІДЖЕННЯ № 5 «Досліджуємо водень»
Обладнання: апарат Кіппа, кристалізатор із водою,
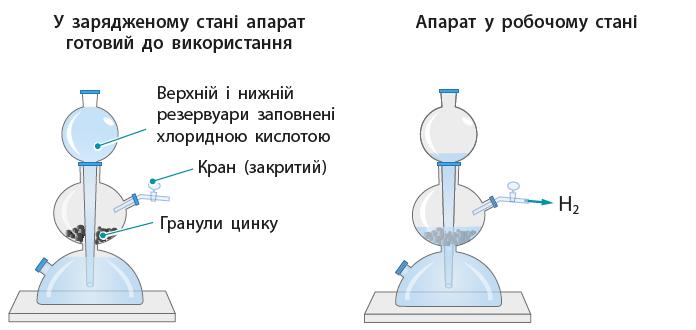
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
За виділенням бульбашок газу в
2.
3.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
2 SO4 (K + , SO4 2 )
Cr(NO 3) 3 (Cr 3+ , NO3 )
MgCl 2 (Mg 2+ , Cl )
CuSO4 (Cu2+ , SO4 2 )
SnCl2 (Sn2+ , Cl )
AgNO3 (Ag + , NO3 )
AlPO4 (Al3+ , PO4 3 )
BaSO3 (Ba2+ , SO3 2 )
BaS (Ba2+ , S 2 )
BaSO4 (Ba2+ , SO4 2 )
Na2 SiO3 (Na+ , SiO3 2 )
4 (Mn2+ , SO4 2 )
2 S (Ag + , S 2 )
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
кислоту. Запишіть
1. Розклад ферум(3+)
Fe2(SO4)3 = Fe2O3 + 3SO3 2.
SO3 + H2O = H2SO4 Сторінка 70
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Приклад, якщо брали метали Mg, Zn, Fe, Cu і розбавлену хлоридну кислоту HCl.
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Cu + 2HCl = реакція не відбувається
Розташуйте символи
Mg > Zn > Fe > Cu
Порівняйте
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
18.1 Запишіть продукти
схемах. метал + кислота → сіль + водень↑ метали (Li, K, Ca, Na) + H2O → луг + водень↑ метали (Al, Mn, Zn, Fe) + H2O
18.2 Схарактеризуйте хімічні
рівняння
Zn + H2SO4 → ZnSO4 + H2↑
Fe + H2SO4 → FeSO4 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
Mg + 2HCl → MgCl2 + H2↑
Pb + 2HCl → PbCl2↓ + H2↑
Cu + HCl →
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Zn + H2O →
Fe + CuSO4 → FeSO4 + Cu
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
Cu + FeSO4 →
2Al + Fe2O3 → Al2O3 + 2Fe
PbCl2
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Сторінка 74
18.8 Визначте
рівняння.
а) Mg + H2SO4(розб.) → MgSO4 + H2↑
б) Fe + 2HBr → FeBr2 + H2↑ в) Hg + HCl —
2Al + 6HI → 2AlI3 + 3H2↑
Cu + H3PO4 —
е) Ni + H2SO4(розб.) → NiSO4 + H2↑
ж) Au + HCl —
и) Pb + 2HCl → PbCl2↓ + H2↑ к) Sn + H2SO4(розб.) → SnSO4 + H2↑ л) Zn + 2HBr → ZnBr2 + H2↑
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
а) FeSO4 + Sn — реакція не відбувається
б) 2AgNO3 + Cu → Cu(NO3)2 + 2Ag
продукти: купрум(2) нітрат і срібло
в) 3NiCl2 + 2Al → 2AlCl3 + 3Ni
продукти: алюміній хлорид і нікель
г) CuSO4 + Hg — реакція не відбувається
д) Hg(NO3)2 + Cu → Cu(NO3)2 + Hg
продукти: купрум(2) нітрат і ртуть
е) Hg(NO3)2 + Ag — реакція не відбувається
ж) 2CrCl3 + 3Zn → 3ZnCl2 + 2Cr
продукти: цинк хлорид і хром
и) Al2(SO4)3 + Pb — реакція не відбувається
к) SnCl2 + Zn → ZnCl2 + Sn
продукти: цинк хлорид і олово
л) FeCl2 + Zn → ZnCl2 + Fe
продукти: цинк хлорид і залізо
м) NiSO4 + Fe → FeSO4 + Ni
продукти: ферум(2) сульфат і
н) 3CuBr2 + 2Al → 2AlBr3 + 3Cu
продукти: алюміній бромід і
реакцій.
Fe
Fe2O3
H2SO4
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
а) Zn + PbO → ZnO + Pb
продукти: цинк оксид і свинець
б) 3Ca + Fe2O3 → 3CaO + 2Fe
продукти:
в) 2Al + 3NiO → Al2O3 + 3Ni
продукти: алюміній оксид і нікель
г) CuO + Au — реакція не відбувається
д) Al2O3 + Cr — реакція не відбувається
е) 3Zn + Cr2O3 → 3ZnO + 2Cr
продукти: цинк оксид і хром
Сторінка 75
18.13 Приклади розв’язання
Сторінка 76
18.14
2Na + 2H2O → 2NaOH + H2
②
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
формула CO2 Відносна молекулярна маса 44
умов
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
CO2 + H2O = H2CO3
CaO + CO2 = CaCO3
Na2O + CO2 = Na2CO3
2NaOH + CO2 = Na2CO3 + H2O
Ca(OH)2 + CO2 = CaCO3
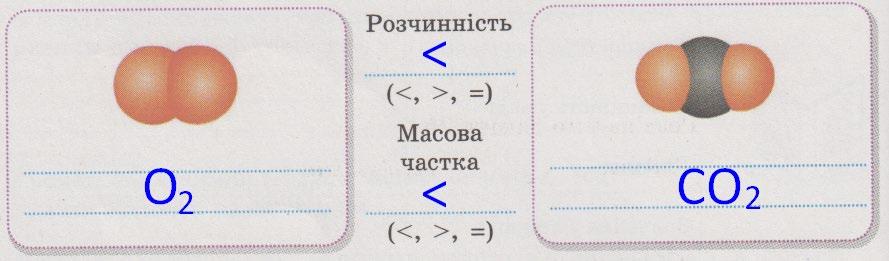
V(CO2, н. у.)
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
79
19.7
CO2 + MgO = MgCO3
CO2 + Na2O = Na2CO3
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + Ba(OH)2 = BaCO3↓ + H2O 19.8
80
19.9 Прочитайте завдання № 243 у
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
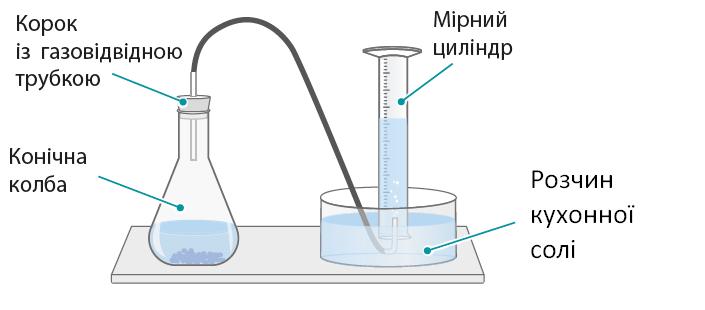
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Юля, бо її результат (1,80 г/л) найближчий
довідникового (1,83 г/л). ⑤ Чим пояснюється розбіжність результату Артема з довідниковим?
У колбі залишилося повітря, тому маса газу вийшла меншою.
⑥ Чи можна вважати результат Юлі помилковим? Чому?
Ні, він близький до довідникового,
Сторінка 83
Запишіть
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Прочитайте опис дослідження в підручнику на с. 183.
Запишіть обладнання та реактанти, з якими ви працюватимете.
Обладнання: апарат Кіппа або інший пристрій для одержання вуглекислого газу, склянка, штатив із пробірками, свічка, сірники, склянка з соломинкою.
Речовини: мармур, хлоридна кислота, вода, вапняна вода, універсальний індикатор.
① Запропонуйте спосіб, у
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
утворення кіптяви?
C2H5OH (C2H6O)
M(C2H6O) = 2·12 + 6·1 + 16 = 46 г/моль
m(C) = 2·12 = 24 г
ω(C) = 24 / 46 ≈ 0,52 = 52 %
C5H11OH (C5H12O)
M(C5H12O) = 5·12 + 12·1 + 16 = 88 г/моль
m(C) = 5·12 = 60 г
ω(C) = 60 / 88 ≈ 0,68 = 68 %
Порівняння:
ω(C) у C5H12O > ω(C) у C2H6O
Висновок: твердження
20.7
CH4
M(CH4) = 12 + 4·1 = 16 г/моль
m(C) = 12 г
ω(C) = 12 / 16 = 0,75 = 75 %
C8H18
M(C8H18) = 8·12 + 18·1 = 96 + 18 = 114 г/моль
m(C) = 8·12 = 96 г
ω(C) = 96 / 114 ≈ 0,84 = 84 %
Порівняння:
ω(C) у C8H18 > ω(C) у CH4
Рівняння повного окиснення:
CH4 + 2O2 = CO2 + 2H2O
2C8H18 + 25O2 = 16CO2 + 18H2O
Висновок:
(Fe3O4) = 1 кг = = 1000 г
V(CO) ? shkola.in.ua
реакції: Fe3O4 + 4CO = 3Fe + 4CO2
Fe3O4: 3·56 + 4·16 = 232 г/моль.
Fe3O4: n = 1000 / 232 ≈ 4,31 моль.
Fe3O4 потрібно 4
CO,
n(CO) = 4 · 4,31 ≈ 17,24 моль. Об’єм за н. у.: V = 17,24 · 22,4 ≈ 386 л.
20.9
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Відомо:
V(C8H18) = 1 л
ρ(C8H18) = 750 г/л
m(CO) = 200 г
ω(C8H18), % ? shkola.in.ua
Розв’язання:
М(CO) = 12 + 16 = 28 г/моль
n(CO) = 200 / 28 ≈ 7,14 моль
Рівняння (неповне згоряння):
2C8H18 + 17O2 = 16CO + 18H2O
З рівняння:
16 моль CO утворюються з 2 моль C8H18, тобто
1 моль C8H18 → 8 моль CO
n(C8H18) = 7,14 / 8 ≈ 0,893 моль
М(C8H18) = 8·12 + 18·1 = 114 г/моль
m(C8H18, що згорів з утворенням CO) = 0,893 · 114 ≈ 102 г
Маса 1 л бензину: m(усього) = ρ · V = 750 · 1 = 750 г
Масова частка: ω = 102 / 750 ≈ 0,136
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
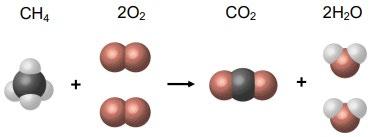
CH4 + 2O2 = CO2 + 2H2O
2CH4 + 3O2 = 2CO + 4H2O
CH4 + O2 = C + 2H2O
Відомо:
m(води) = 1000 г
m(CH4) = 0,04 г
m(CO2) = 3,5 г
m(O2) = 0,07 г
ω(CH4), ω(CO2),
ω(O2) — ? shkola.in.ua
Розв’язання:
Для метану:
m(розчину) = 1000 + 0,04 = 1000,04 г
ω(CH4) = 0,04 / 1000,04 · 100% ≈ 0,004 %
Для вуглекислого газу:
m(розчину) = 1000 + 3,5 = 1003,5 г
ω(CO2) = 3,5 / 1003,5 · 100% ≈ 0,349 %
Для кисню:
m(розчину) = 1000 + 0,07 = 1000,07 г
ω(O2) = 0,07 / 1000,07 · 100% ≈ 0,007 %
Висновок:
ω(CO2) > ω(O2) > ω(CH4).
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
масою 1000 кг.
Відомо: m(води) = 1000 кг = = 1 000 000 г
Розчинність CH4: 0,04
1000 г води Розв’язання: У 1000 г води розчиняється 0,04 г CH4 У 1 000 000 г
V(CH4) ?
shkola.in.ua
розчиниться: m(CH4) = 0,04 · 1000 = 40 г М(CH4) = 16 г/моль
n(CH4) = 40 / 16 = 2,5 моль
За н. у. 1 моль газу займає 22,4 л, отже: V(CH4) = 2,5 · 22,4 = 56 л Відповідь: з такого розчину
21.6 Обчисліть мінімальний
Відомо: S = 10 м2 h = 2,5
V(CH4) ? shkola.in.ua
Розв’язання: V(повітря) = S · h = 10 ·
повітрі — 4,4 %. V(CH4) = 4,4 100 · 25 = 1,1 м3
+ 12H2O = 4Al(OH)3 + 3CH4
4C3) = 4·27 + 3·12 = 108 + 36 = 144
4C3) = 360 / 144 = 2,5
рівняння: 1 моль Al4C3 → 3 моль CH4 V(CH4) ? shkola.in.ua
реакції: Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
n(CH4) = 2,5 · 3 = 7,5

Сторінка 93
22.3
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
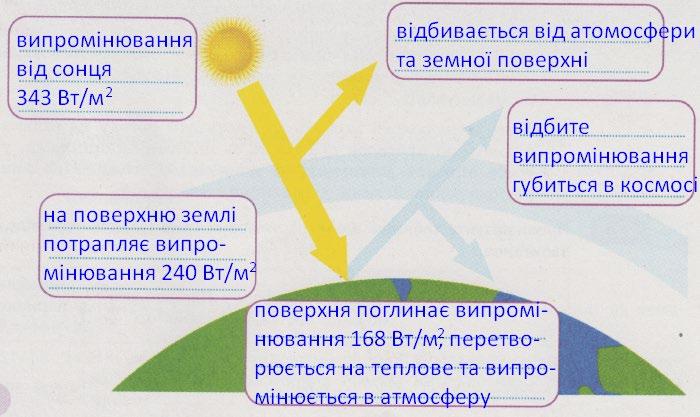
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
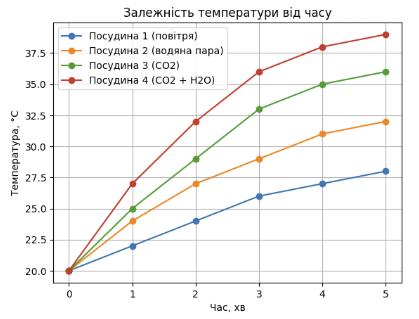
№ 9 «Моделюємо парниковий ефект»
Запишіть обладнання та реактанти, з якими
Обладнання: скляні банки, невеликі акваріуми, пластикові бутлі на 5 або 10 л,
термометри, джерело вуглекислого газу.
Речовини: Пісок, водяна пара, вуглекислий газ.
Поміркуйте
① Схарактеризуйте
1) Які об’єкти слід
термометр.
2) Які умови експерименту мають бути постійними,
Постійні: форма та об’єм посудин,
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html