


































































































































































1.
чи складною є ця речовина?
5.
формули C2H6O, CuO, N2, O3, Н2, S, Сa, KOH, Mg, C5H12, KNO3, Mg3N2.
6. Укажи формули речовин,
1. NаNO3. 2. NH4NO3. 3. HNO2. 4. HNO3. 5. NaOH. A 1, 2, 3 Б 2, 3, 4
3, 4, 5

1, 3, 5














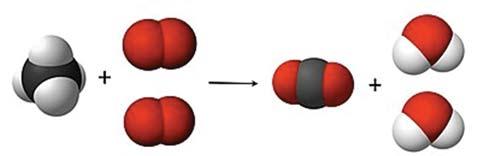
СH4 + 2О2 = CО2 + 2Н2O







































































































2.
3. Знайди
СаН, Al2O3, KBr, NaCl2, Zn2O2, НCl4
4. Назвè якомога
а) N2O, NO, NH3;
б) N2O, Cl2O, H2O;
в) РН3, B2O3, NH3.
5.
























Mr(SO3) = Аr(S) + Аr(О) + Аr(О) +Аr(О) = 32 + 16 +16 + 16 = 80.
або: Mr(SO3) = Аr(S) + 3 • Аr(О) = 32 + 3 • 16 = 80.
Відносну


































За наведеними формулами обчислюють масову частку
будови.
Розглянемо приклади.
Приклад 1. Обчислимо масову
С2Н4О2 (речовина молекулярної будови).
Відомо: Допоміжні дані:
C2H4O2 Ar(C) = 12
w (C) — ? Ar(H) = 1 Ar(O) = 16
Розв’язання
1) Mr(C2H4O2) = 2Ar(C) + 4Ar(H) + 2Ar(O) = 2 • 12 + 4 • 1 + 2 • 16 = 60;
2) w (C) = 2 12 64 . = 0,4.
Відповідь: w (C) = 0,4 або 40 %.
Приклад 2. Обчислимо масові частки Феруму
Відомо: Допоміжні дані: Fe2O3 Ar(Fe) = 56
w (Fe) — ? Ar(О) = 16
Оксигену у ферум(ІІІ) оксиді (сполука немолекулярної будови). () = nA w M r r E (спол.) () = nA w M r r E (спол.) w w w w
w (O) — ? Розв’язання
1) Mr(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2 • 56 + 3 • 16 = 160;
2) w (Fe) = 2 56 160 . = 0,7 ( або 70 %);
3) w(O) = 100 %– 70 % = 30 % або w(O) = 3 16 160 . = 0,3 (або 30 %).


— 0,3 або








1.
2.
3.








2.
3.
4.
5.



















































2.
3.
4.
5.







2. Записуємо значення молярної
і в ньому міститься 6,02 • 1023 молекул.
Приклад 3. Обчислимо молярну масу ферум(ІІІ) хлориду FeCl3.
1. Обчислюємо відносну молекулярну масу ферум(ІІІ) хлориду: Мr(FeCl3) = Аr(Fe) + 3 • Аr(Cl) = 56 + 3 • 35,5 = 162,5.
2. Записуємо значення молярної маси ферум(ІІІ) хлориду: M(FeCl3) = 162,5 г/моль.
1 моль ферум(ІІІ)




























N(H3PO4) = 12,04•1023 молекул

2.
5
3.
4.
води: N(H) = 2N(H2O) = 2•5 моль = 10 моль.
10
6,02•1023•10 = 6,02•1024 атомів.
5 моль води: N(O) = N(H2O) = 5 моль.
5.
5 моль: 6,02•1023•5 = 3,01•1024 атомів.













































Перший спосіб: n(Н2) = 3 • n(N2) = 3 • 4 = 12 моль.
Другий спосіб:
4 x = ;
x = 4 • 3 = 12 моль.
4. За формулою m = n • M
m(H2) = 12 моль • 2 г/моль = 24 г.
Відповідь: маса водню дорівнює 24 г.



n(N2) = 4
Mr(H2) = 2 • 1 = 2 m(H2) — ? M(H2) = 2
n(MgO) = 6 моль Mr(O2) = 2
= 32
1. Записуємо рівняння
2.








реакції: а) n(H2) = m(H2) : M(H2) = 180 г : 2 г/моль = 90
б) оскільки n(H2) : n(NH3) = 3 : 2, то n(NH3) становить (90·2)/3 = = 60 моль; в) m(NH3) = n(NH3) • M(NH3) = 60 моль • 17
= 1020 г.











2.
3.



https://qr.orioncentr.com.ua/C7WqX

















































































1.
2.




ZnO, HNO3, O2, NaH,
формулах: SO2, Fe3O2, СаО2, CH4, Na2O, AlO, Mg2O2.
3. Установи
4.
5.
6.







3Н2SO4


































































Відомо:
n(О2) = 1 моль
ρ(О2) за
у. = 1,43 г/л
V(О2) за н. у. — ?
N(О2) — ?



Mr(О2) = 2
r(О) = 2 • 16 = 32; M(О2) = 32 г/моль; m


Відомо:

n(F2)












2.






1.
2.
3.




































































1.
2.



















Мr(O2) = 2 • 16 = 32;
Мr(пов.) = 29;
Dпов.(O2) = 32 : 29 = 1,1.

















0,18: w(H) = 1 – w(N) = 1 – 0,82 = 0,18; y • Ar(H) = w(H) •





6.
7.







































































H2O2 → H2O2 + O2 ↑
HgO → Hg + O2 ↑
NaNO3 → NaNO2 + O2
KMnO4 → K2MnO4 + MnO2 + O2↑
























































4.
Ag2O → Ag + O2↑; KClO3 →



6.















V
1. N2 + О2 = 2NО.
2. 1 моль : 1 моль : 2 моль.
3. 1V : 1V : 2V.
4. V(N2) = 1/2V(NО) = 100 : 2 = 50 (л).
5. V(О2) =1/2V(NО) = 100 : 2 = 50 (л).



























































































Zn x Oy, MgxCly, СrxOy, FexOy, BrxOy, HxBry, AlxOy, NaxSy, NxOy.




1.
2.














































+ SO3 = K2SO4 +
MgO + HCl = MgCl2 + H2O.





5.
KOH, C, Fe, CuO, CO2, H2SO4, HCl, Ca(OH)2, N2, NO, BaO, Ba(OH)2.
Li2O + H2O → LiOH; H2O + SO2 → H2SO3.













































































3.






4.



1.
2.
3.
4.
5.
























































































5.















































































1.
2.
3.
4.
5.
6.















































2.
3.
4.

https://qr.orioncentr.com.ua/W612v





























































































































2.
3.


















Zn + Br2 → ZnBr2; HgO → Hg + O2;
Fe + CuSO4 → FeSO4 + Cu;
Al + O2 → Al2O3; MgCO3 → MgO + CO2. 8.
13.1.

13.3.
14.
15.
→ СаO + CO2.











































































































5.
6.









































2.
3.
















1.
2.
3.







3


2.1.
2.2.
2.4.




2.
3.
4.















F2,


Ne) (мал. 46).


































2.
3.
5.
7.
8.
4)
























































2.
4.
5.










































6.
7.
8.


























1.
2. Відносна атомна маса
3. Період:
а) період і ряд короткої форми періодичної таблиці б) період довгої форми періодичної
4. Група: а) група, підгрупа короткої
5.

6.
7.
















2.
6.



https://qr.orioncentr.com.ua/mPWB9




























між



періодичної зміни
властивостей
хімічних елементів у































Пропонував/пропонувала










































1.
2.
3.
4.


























































































































Na1s22s22p63s
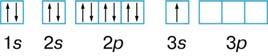
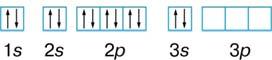
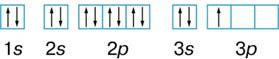




















3.
4.














O, Cl, N, Br, I, S, C, P, H, B, Si, Al, Mg, Li, Na, K, Cs.
























































































NaCl 77,8
MgCl2 10,9 MgSO4 4,7 KCl2,5
2,5




1.
2.
5.

























1.
2.

3.




2.




2.
3.







































































2.
3.
4.
5.
6.




https://qr.orioncentr.com.ua/zSZNq
































































































2.
3.
4.
5.
6.
8.
9.




15.
16.
17.
18.
+9, 2
+20, 2







Актиноїди ............................162 Аморфні речовини..................204 Аніон ...................................187 Атом .......................................8
Атомна орбіталь.....................138
Атомний номер .....................143 Б
Бінарні сполуки ......................16
Біогаз...................................120
В
Валентність ............................16
Відносна атомна маса ...............21
Відносна густина газів..............65
Відносна молекулярна маса ......21
Водень..................................104
Вуглекислий газ ....................111
Г
Галогени...............................152
Горіння ..................................87
Графічна електронна
формула ...............................180
Група ...................................160
Е
Електрон ..............................132
Електронегативність ..............188
Електрони валентні
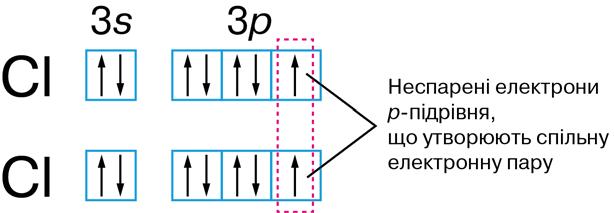
неспарені .........................181 – спарені ............................180
Енергетична комірка ..............180
підрівень ..........140

Нейтрон................................132 Нейтронне число ....................134
речовин .............16 Нормальні умови .....................54
Нуклід .................................134
Нуклонне (масове) число .........134
.....................................148
.....................................91
..................................160
система хімічних
форма ...................160
............................161
число .....................134
/ реактанти








§ 4. 6. Mr(C2H6O) = 46. 7. 4 молекули.
§ 5. 1. w(H) = 0,03 (або 3 %); w(Р) = 0,32 (або 32 %); w(О) = 0,65 (або 65 %).
2. w(Са) = 29 %. 4. m(Al) = 3,78 г. 6. w(С) = 0,49 (або 49 %); w(Н) = 0,05 (або 5 %); w(N) = 0,29 (або 29 %); w(О) = 0,17 (або 17 %).
§ 6. 3. 54,18·1023 атомів. 4. n(N2) = 0,3 моль. 5. 0,602·1023 формульних одиниць. 6. 30,1·1023 молекул. 7. 60,2·1023 молекул.
§ 7. 6. m(C3H6O3) = 450 г.
§ 8. 2. а) m(NH3) = 85 г; б) m(Mg) = 72 г. 3. m(O2) = 96 г; N(C) = 6,02·1023 атомів; n(Na) = 2 моль. 5. N(Fe) = 1,6·1022 атомів; N(K) = 1,3·1022 атомів; N(Mg) = 2,4·1021 атомів. 6. n(Ca) = 0,03 моль.
§ 9. 4. n(CH4) = 20 моль
§ 11. 5. w(N) = 0,22 (або 22 %). 7. m(Н2) = 2 г; m(С6Н12O6) = 360 г; m(СaS) = 216 г. 8. n(H2O) = 15 моль; n(С6Н12O6) = 1,5 моль; n(HNO3) = 3 моль N(H2O) = 90,3·1023 молекул; N(С6Н12O6) = 9,03·1023 молекул; N(HNO3) = 18,06·1023 молекул. 10. m(SО2) = 704 г. 11. а) m(O2) = 256 г; б) n (O2) = 8 моль.
§ 12. 3. V(Cl2) = 112 л.
§ 13. 1. V(повітря) = 3333 л.
§ 14. 5. а) m(газу) = 1,98 г; б) Dпов.(газу) = 1,5. 6. С3Н8.
§ 15. 3. V(О2) = 89,6 л. 4. V(О2) = 4055 л; V(СО2) = 4055 л.
§ 17. 1. V(С2Н2) = 200 л; V(О2) = 500 л. 2. V(О2) = 60 л. 3. V(NО2) = 80 л.
§ 18. 4. V(О2) = 672 м3; V(СО2) = 336 м3.
§ 19. 5. m(LiOH) = 192 г; m(H2SО3) = 328 г.
§ 21. 2. V(О2) = 600 л; m(О2) = 857 г.
§ 22. 5. V(Н2) = 33,6 л; V(О2) = 16,8 л.
§ 23. 2. V(СО) = 224 л. 3. V(повітря) = 533 л; V(СО2) = 112 л.
§ 24. 2. V(СО2) = 200 м3. 5. 3,5 місяці.
§ 26. 3. Dн2(газу) = 17. 5. m(С) = 54 г. 11. m(О2) = 0,8 г. 18. w(О) = 0,07 (або 7 %).


2.


5.
2. Таємниці вогню.
3.
4. Збереження
5.
6. Створення моделі, що ілюструє
7. Об’єми газів: математика
8.
9.
10.
11. Біогаз
1.
відкриття його таємниць.
2. Історія і сучасність періодичної системи.
3. Цікаві історії з відкриття хімічних елементів.
4. Хімічні елементи в організмі людини.
5.
6.
7.

Навчальне видання
ЯРОШЕНКО Ольга Григорівна
КОРШЕВНЮК Тетяна Валеріївна
ХІМІЯ
Підручник
Рекомендовано Міністерством
Підручник відповідає Державним санітарним нормам і правилам
«Гігієнічні вимоги до друкованої продукції для дітей»
Головна редакторка І. В. Красуцька Редактор О. С. Ісак
Головна художниця І. П. Медведовська Художня редакторка І. П. Медведовська Коректорки О. В. Должикова, Ю. А. Полулященко Художниця О. С. Шуклінова
В оформленні посібника використано світлини І. Красуцького, В. Соловйова, а також матеріали із фотобанку Shutterstok.com та інших вільних інтернет-джерел
Бренди та ресурси зображуються лише з освітньою метою та не є закликом до їх купівлі / відвідування
Формат 70 100 1/16. Ум. друк. арк. 18,2 + 0,324 форзац. Обл. вид. арк. 16,38 + 0,55 форзац. Зам. №
ТОВ «Український освітянський видавничий центр “Оріон”» Свідоцтво «Про внесення суб’єкта видавничої справи до державного реєстру видавців, виготівників і розповсюджувачів видавничої продукції» Серія ДК № 4918 від 17.06.2015 р.
Адреса видавництва: 03061, м. Київ, вул. Миколи Шепелєва, 2











