
Nº15 | Octubre 2025


Nº15 | Octubre 2025
Una verdadera alianza se construye abordado juntos los desafíos de forma integral. Llevamos 30 años poniendo a los profesionales del sector en el centro. Por eso hemos desarrollado vacunas, servicios y tecnologías punteras, herramientas eficientes pensadas para hacer tu negocio sostenible en el tiempo.







La ciencia ha aprendido a leer, poco a poco, el lenguaje con el que la vida escribe sus instrucciones. En el código genético no solo se descifran las claves de la herencia, sino también las de la adaptación, la vulnerabilidad y la promesa de futuro.
Cada avance en genética y reproducción porcina nos recuerda que no estamos ante simples mecanismos biológicos, sino ante la expresión de una inteligencia natural que la investigación intenta comprender, sin llegar nunca a poseer del todo.
El desarrollo de herramientas capaces de editar el genoma o de seleccionar con precisión milimétrica los rasgos que garantizan la viabilidad de una camada representa uno de los mayores logros de la biotecnología moderna. Sin embargo, más allá del asombro que despiertan estos avances, la verdadera revolución está en cómo la ciencia ha aprendido a mirar.
Lo que antes era invisible —la placenta que modula el crecimiento fetal, las sutiles interacciones entre inmunidad y reproducción, o el papel de un solo receptor celular frente a un virus— hoy puede analizarse con un nivel de detalle que roza lo inimaginable.
La reproducción, a menudo entendida como un proceso rutinario, se revela como un equilibrio delicado entre energía, comunicación celular y memoria genética. Un equilibrio que la nutrición, el ambiente o el estado inmunitario pueden alterar con facilidad.
La inmunidad y la genética, que durante décadas siguieron caminos paralelos, hoy se encuentran en un punto de convergencia: la defensa y la herencia son, al fin y al cabo, dos formas complementarias de preservar la vida.
Cada célula, cada embrión en formación, responde a una lógica que combina azar y necesidad.
La selección genética no solo busca más lechones o mayor eficiencia, sino la armonía entre rendimiento y bienestar, entre productividad y sostenibilidad. Comprender esa armonía —y no forzarla— es el desafío de nuestro tiempo.
Porque la ciencia, cuando se adentra en el origen, debe hacerlo con humildad.
La genética nos ofrece la posibilidad de transformar, pero también la responsabilidad de comprender. Los algoritmos que hoy predicen fertilidad o resistencia no sustituyen la sensibilidad del ojo que observa, ni el conocimiento del técnico que interpreta los signos de una cerda en celo, ni la intuición del veterinario que reconoce un equilibrio alterado.
Quizá el mayor logro de esta era no sea la capacidad de editar genes, sino la de integrar saberes: genómica, inmunología, fisiología, manejo. Entender que la vida no es una suma de partes, sino un sistema en diálogo constante. Y que cada mejora —por pequeña que parezca— forma parte de una historia más amplia, la de nuestra relación con los animales que nos alimentan y nos acompañan desde hace milenios.
El futuro de la reproducción porcina no está solo en la precisión de nuestras herramientas, sino en la madurez con la que sepamos usarlas. Avanzar sin perder el asombro, innovar sin olvidar la biología. Tal vez ese sea el verdadero acto de respeto hacia la vida: escuchar su lenguaje invisible y aprender a responderle con sabiduría.
EDITOR GRUPO DE COMUNICACIÓN AGRINEWS S.L.
PUBLICIDAD
Laura Muñoz +34 629 42 25 52 laura@mediatarsis.com
Luis Carrasco +34 605 09 05 13 lc@agrinews.es
REDACCIÓN
Daniela Morales
ADMINISTRACIÓN
Mercè Soler
Barcelona
España
Tel: +34 93 115 44 15 info@agrinews.es
www.porcinews.com www.porcinews.com/revista-porcisapiens/
Precio de suscripción anual: España 45 € Extranjero 120 €
ISSN (Revista impresa) 2696-8142
ISSN (Revista digital) 2696-8151
DIRIGIDA A VETERINARIOS DE PORCINO Depósito Legal PorciSapiens B 7620-2021
Revista Cuatrimestral
4/12
IMPACTO DE LA PLACENTACIÓN EN EL PESO FETAL
Leticia P. Moreira, Saffir D. Fernandes, João Vitor L. Ferreira, Abner L. Shinkawa, Dayanne K. O. Pires, Isadora M. S. de Oliveira, Stephanny R. Rainha, Tulio C. C. de Alkmim y Fernanda R. C. L. Almeida
Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais
La eficiencia placentaria influye directamente en el peso fetal y en la incidencia de crecimiento intrauterino restringido en lechones.
14/18
CÓMO IMPACTA HOY LA MEJORA
GENÉTICA EN LAS LÍNEAS MATERNAS DE PIC® EN LA PRODUCCIÓN PORCINA EUROPEA
Juan Manuel Herrero1 y Pablo Magallón2
1Especialista Servicios Genéticos PIC Sur de Europa 2Director de Servicios Técnicos PIC Sur de Europa
20/27
CONCENTRACIÓN SEMINAL Y EFICIENCIA
REPRODUCTIVA PORCINA
Raquel Fernández Rodríguez1, Henar González Ramiro1, Anselmo Martínez Moreno1, Álvaro Guerrero Masegosa1, Juan Conesa Navarro1 y Paula Sánchez Giménez2 1Agropor S.L. 2Técnico Veterinario
¿Puede un aumento del 20 % en la concentración espermática mejorar los resultados reproductivos en granjas de alto estatus sanitario? Este estudio lo analiza con datos de campo.
28/32
SISTEMA MULTIDOSIS DE INSEMINACIÓN ARTIFICIAL: CÓMO
OPTIMIZAR LA REPRODUCCIÓN
Marina López R. y Pedro J. Llamas
Servicio técnico de Import-vet 34/38
IMPACTO DE LA CONDICIÓN CORPORAL AL DESTETE EN LA EFICIENCIA REPRODUCTIVA DE LA CERDA
Rafael Pallás Alonso Director técnico de KUBUS – España
Una condición corporal deficiente al destete puede desencadenar trastornos reproductivos como el Síndrome del Segundo Parto. Descubre cómo abordarlos y mejorar los resultados.
40/46
VACUNACIÓN CON IDAL®: ¿QUÉ OPINAN LOS USUARIOS?
César Llorente Carnicer, María Luisa Pérez-Breña Martín, Marcial Marcos Cienfuegos, Rut Menjón Ruiz y Marta Jiménez Salvador Departamento técnico de MSD Animal Health
48/58
NUEVAS PERSPECTIVAS SOBRE EL TROPISMO TESTICULAR DEL VIRUS DEL PRRS
Kassandra Durazo-Martínez1,2, Fernando A. Osorio1,3 , Gustavo Delhon3 , Jesús Hernández4 e Hiep L. X. Vu1,2
1Centro de Virología de Nebraska, Universidad de Nebraska-Lincoln, EE. UU.
2Departamento de Ciencia Animal, Universidad de Nebraska-Lincoln, EE. UU.
3Facultad de Medicina Veterinaria y Ciencias Biomédicas, Universidad de NebraskaLincoln, EE. UU.
4Laboratorio de Inmunología, Centro de Investigación en Alimentación y Desarrollo A.C. (CIAD, A.C.), México
Nuevas evidencias sobre el tropismo testicular del PRRSV revelan el riesgo potencial en la diseminación mediante semen.
ESTUDIO COMPARATIVO DE EFICACIA DE VACUNAS COMBINADAS O COMBINABLES FRENTE A MYCOPLASMA HYOPNEUMONIAE Y PCV2
Carlos Casanovas y David Espigares
Servicio Técnico Porcino, Ceva Salud Animal
MICOTOXINAS: ENEMIGAS OCULTAS DE LA REPRODUCCIÓN PORCINA
A. Quiles
PHD Universidad de Murcia
Las micotoxinas, incluso a bajas dosis, pueden comprometer la reproducción porcina al alterar el equilibrio hormonal y afectar la viabilidad embrionaria.
EJE INTESTINO-RESPIRATORIO: EL EJEMPLO DE LA ESTREPTOCOCIA
Guillermo Ramis Departamento de Producción Animal, Facultad de Veterinaria, Universidad de Murcia
IMPACTO DE LA EDICIÓN GÉNICA EN LA PRODUCCIÓN PORCINA

MVZ/PhD Laura Batista Batista & Asociados
La edición génica redefine el futuro de la producción porcina, impulsando avances en resistencia a enfermedades y eficiencia productiva.
Agradecemos a nuestros anunciantes por hacer posible la publicación de esta revista: Boehringer Ingelheim, Ceva Salud Animal, Elanco, Import-Vet, Minitube, MSD Animal Health, PIC, Vetia Animal Health, Vetoquinol y Zoetis.


Leticia P. Moreira, Saffir D. Fernandes, João Vitor L. Ferreira, Abner L. Shinkawa, Dayanne K. O. Pires, Isadora M. S. de Oliveira, Stephanny R. Rainha, Tulio C. C. de Alkmim y Fernanda R. C. L. Almeida
Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais
Descarga el PDF
a placenta desempeña un papel esencial en el desarrollo fetal, actuando como el principal puente fisiológico entre la cerda y sus lechones. A través de ella se produce el intercambio de nutrientes, gases y señales metabólicas que determinan la viabilidad y el peso al nacimiento. Su estructura, vascularización y eficiencia están moduladas por una compleja interacción de factores genéticos, nutricionales, uterinos y ambientales. Comprender cómo estos elementos influyen en la placentación permite explicar fenómenos como el crecimiento intrauterino restringido y las variaciones en la uniformidad de las camadas, ofreciendo una base sólida para mejorar el rendimiento reproductivo y la productividad en la especie porcina.
PEl periodo de gestación es fundamental para determinar la salud y el desarrollo de los lechones, siendo esencial mantener unas condiciones morfológicas y fisiológicas adecuadas para un desarrollo prenatal satisfactorio.
El desarrollo en el periodo prenatal está determinado por factores genéticos, nutricionales y morfofuncionales del útero y la placenta.
En condiciones adversas, el feto utiliza una serie de estrategias para sobrevivir, entre ellas una reducción del metabolismo, lo que impide que exprese el potencial de crecimiento acorde con su edad gestacional, dando lugar a una condición conocida como crecimiento intrauterino restringido (CIR).
En esta situación, el flujo sanguíneo se dirige preferentemente al cerebro, órgano clave para la supervivencia, en detrimento de otros órganos.
El CIR es responsable de elevadas tasas de mortalidad en las primeras semanas de vida y de una menor ganancia de peso a lo largo del desarrollo de los lechones, lo que conlleva importantes pérdidas económicas para el sector.
Existen pruebas de que la insuficiencia placentaria es la principal causa de esta afección en los cerdos, ya que su placenta epiteliocorial difusa prácticamente no permite el contacto entre la sangre materna y la fetal. Por tanto, la caracterización de la arquitectura placentaria resulta crucial para comprender el CIR y el correcto desarrollo de la camada.
La placenta es el principal órgano responsable del intercambio de nutrientes, metabolitos y gases respiratorios entre la madre y el feto. Además, produce hormonas, citoquinas y otras sustancias que influyen en el crecimiento y desarrollo fetal durante la gestación.
En la especie porcina, la placenta se clasifica como difusa, plegada, no invasiva y epiteliocorial, (el tejido fetal no invade el endometrio materno).
La placentación epiteliocorial es la más superficial —no invasiva—, y el epitelio uterino permanece intacto durante toda la gestación.
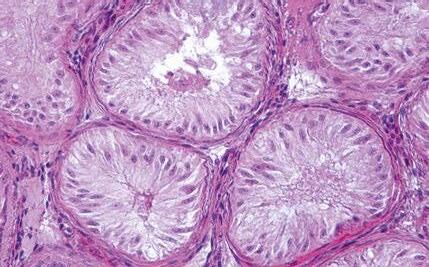
La placenta epiteliocorial está formada por seis capas celulares que separan la sangre materna de la fetal (Figura 1):
Vasos maternos
Tejido conjuntivo
Epitelio endometrial
Epitelio trofoblástico
Tejido conjuntivo
Vasos fetales

FIGURA 1
En el cerdo, la placenta epiteliocorial está formada por seis capas celulares que separan la sangre materna de la fetal: (1) capilares endometriales (vasos endoteliales maternos), (2) intersticio endometrial (tejido conjuntivo materno), (3) epitelio endometrial, (4) epitelio trofoblástico (capa fetal del corion), (5) intersticio coriónico (tejido conjuntivo fetal) y (6) capilares coriónicos (vasos endoteliales fetales). El lado materno corresponde al epitelio endometrial, mientras que el lado fetal está formado por el corion. Ambos permanecen separados durante toda la gestación, sin invasión del tejido materno por parte del fetal (Alvarenga-Dias & Almeida, 2021).
La placentación, es decir, la formación de la placenta, comienza con la implantación, adhesión y migración celular, procesos que conducen a la unión del trofectodermo (membrana fetal) con el epitelio endometrial materno.
Este proceso incluye la rápida expansión y el desarrollo del corion (trofectodermo) y de la alantoides entre los días 18 y 30 de gestación.
La fusión de ambas membranas se produce entre los días 30 y 60.
Entre los días 60 y 70 se completa el desarrollo placentario en términos de peso, superficie y número de areolas placentarias.
Las depresiones del epitelio luminal y del trofectodermo reducen la distancia entre la sangre materna y la fetal, acortando así la distancia de difusión a través de la interfase materno-fetal (Figura 2)


FIGURA 2
Microfotografía que muestra la interfase materno-fetal en el día 45 de gestación en cerdas (Tinción con hematoxilina-eosina (HE)). (1) Membrana corioalantoidea – pliegue primario, (2) Membrana corioalantoidea – pliegue secundario, (3) Endometrio – pliegue primario, (4) Endometrio – pliegue secundario, (5) Glándula endometrial y (6) Vasos uterinos (Reis, 2021).
Con la formación de los pliegues placentarios aparecen dos tipos de células trofoblásticas:
Células columnares, situadas en la parte superior de los pliegues.
Células cuboidales, localizadas en la parte inferior y en sus laterales.
La formación de los pliegues placentarios aumenta la superficie de interacción materno-fetal, favoreciendo una nutrición adecuada del feto en crecimiento. Así pues, tienen un impacto significativo en la eficiencia placentaria, que a su vez influye directamente en el desarrollo fetal.
No obstante, los cambios más drásticos se producen a nivel estructural, especialmente en la densidad vascular y en la altura de las células que conforman la interfase.
EDAD GESTACIONAL
La demanda energética aumenta drásticamente a lo largo de la gestación, por lo que el transporte de nutrientes hacia el feto debe volverse progresivamente más eficiente.
Ello requiere:
1 2
Reducir la distancia de intercambio en la interfase materno-fetal.
Favorecer el transporte por difusión pasiva, que no implica gasto energético.
LA CRECIENTE NECESIDAD DE OXÍGENO
ESTIMULA LA ACTIVIDAD ANGIOGÉNICA MEDIANTE LA ACTIVACIÓN DEL VEGF Y OTROS FACTORES DE CRECIMIENTO VASCULAR


Para responder a esta creciente demanda, la estructura placentaria experimenta modificaciones que favorecen una mayor eficiencia en el intercambio materno-fetal. La morfología de la placenta se evaluó en diferentes etapas de la gestación:
Temprana (25 y 30 días)
Intermedia (40, 60 y 70 días)
Avanzado (90 días)
Término (114 días)
Los resultados mostraron que las células de la interfase —el epitelio endometrial en el lado materno y el trofoectodermo en el lado fetal— disminuyen su altura a medida que avanza la gestación, pasando de medir entre 21 y 25 μm a valores inferiores a 2 μm en la placenta a término (Figura 3)
El estudio también evidenció el desarrollo vascular a lo largo de la gestación, con la formación de nuevos vasos en las regiones más próximas a la interfase durante las etapas finales, así como un incremento en el número de vasos de menor calibre (Gráfica 1)
Junto con la dinámica estructural de la placenta a lo largo del desarrollo intrauterino, diversos factores pueden influir en su arquitectura y función, entre ellos el dimorfismo sexual, el tamaño de la camada y el estado sanitario de la cerda.
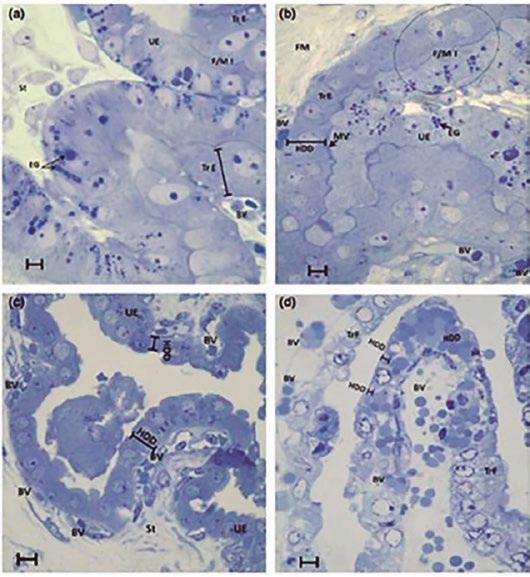
FIGURA 3
Longitud HDD (distancia de difusión hemotrófica) en los lados materno y fetal de la interfase a los 25 días (HDD = 11,4 μm) (a), 40 días (HDD = 15,94 μm) (b), 60 días (HDD = 7,42 y 3,72 μm) (c) y 114 días de gestación (HDD = 2,46, 1,93 y 1,62 μm) (d). Se observa una disminución progresiva de la altura de la capa celular del epitelio endometrial (columnar). BV, venas; EG, gránulos electrodensos; FM, mesénquima fetal; F/M I, interfase materno-fetal; MV, microvellosidades; StE, estroma; EU, epitelio uterino. Escala: 5 μm (Cristofolini et al., 2017).

GRAFICA 1
Intervalos de área vascular y su distribución en diferentes edades gestacionales. El intervalo 2, con un área vascular comprendida entre 100 y 500 μm², predomina en casi todas las edades y su cantidad aumenta significativamente hacia el final de la gestación. Int 1: 1–100 μm²; Int 2: 100–500 μm²; Int 3: 500–2.000 μm²; Int 4: 2000–10.000 μm²; Int 5: 10.000–50.000 μm²; Int 6: 50.000–300.000 μm² (Adaptado de Cristofolini et al., 2017).
DIMORFISMO SEXUAL
En los mamíferos, el sexo del feto influye en el peso al nacimiento, siendo los machos generalmente más pesados que las hembras, diferencia que puede apreciarse ya en las primeras fases de la gestación.
En el porcino, los fetos macho presentan un ritmo de crecimiento más rápido, que se mantiene durante todo el periodo gestacional, así como un mayor volumen de líquido amniótico.
Estas particularidades sugieren la existencia de diferencias en la función placentaria asociadas al dimorfismo sexual fetal.

En varias especies se observan diferencias en el desarrollo fetal entre machos y hembras.
En la especie humana, los fetos masculinos presentan una menor capacidad de respuesta ante condiciones uterinas adversas, y los embarazos de varones se asocian con una mayor incidencia de prematuridad, preeclampsia y diabetes gestacional.
En el porcino, diversos estudios han demostrado que los machos recién nacidos presentan una mayor mortalidad predestete y son más susceptibles a las enfermedades que las hembras, a pesar de su mayor peso al nacimiento, lo que sugiere un posible papel de la placenta en este contexto.
La relación entre el sexo del feto y el desarrollo placentario en cerdos es muy dinámica: aunque en los días gestacionales 50 y 104 no se detectan diferencias estructurales entre las placentas de fetos machos y hembras, en el día 70 el peso de los machos es superior (Figura 4)

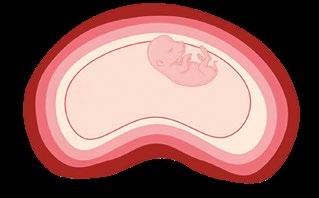
FIGURA 4
Endometrio Placenta
Líquido alanteoideo
Líquido amniótico
Representación esquemática del útero gestante en cerdas con fetos hembra (rosa) y macho (azul). Se observa un mayor volumen de líquido amniótico en los fetos macho.
El estudio realizado por Stenhouse et al. (2019), utilizando células placentarias porcinas cultivadas in vitro (día gestacional 60), demostró que las células procedentes de fetos hembra presentan una mayor capacidad para establecer conexiones entre sí. Estos resultados sugieren, a su vez, que las placentas asociadas a fetos hembra en el día gestacional 60 producen más factores angiogénicos que las de los machos.
Comprender los mecanismos que controlan el crecimiento fetal resulta fundamental para reducir la prevalencia de lechones con bajo peso al nacimiento y, de este modo, optimizar la cadena de producción porcina.
Las discrepancias observadas entre estudios pueden atribuirse a distintos factores, como la raza de los animales empleados y, en consecuencia, una mayor variabilidad biológica, requiriéndose más investigaciones que evalúen los factores angiogénicos placentarios y la metabolómica del líquido amniótico, comparando ambos sexos, con el fin de dilucidar mejor esta cuestión.
Existen evidencias de que el peso medio de los lechones al nacimiento disminuye a medida que aumenta el tamaño de la camada. Sin embargo, no se han encontrado estudios que establezcan una relación clara entre el tamaño de la camada y la vascularización placentaria.
DE LA PLACENTA Y LA INCIDENCIA DE LA MORTALIDAD
PREDESTETE PARECEN
ESTAR ESTRECHAMENTE
VINCULADAS AL PESO DEL LECHÓN AL NACIMIENTO
Se ha observado que la superficie placentaria (−20,4 %) y el peso de la placenta (−14,8 %) son inferiores en los lechones muertos antes del destete en comparación con los que sobreviven.
En camadas más numerosas, el flujo sanguíneo placentario por lechón se reduce y el área placentaria disponible para cada uno es menor, lo que explicaría el menor peso medio al nacimiento y la mayor incidencia de mortalidad antes del destete.
Una mejor comprensión de las complejas interacciones entre el flujo sanguíneo placentario y las características fisiológicas de la cerda moderna puede ofrecer información valiosa para reducir las pérdidas perinatales.
En la producción porcina moderna hay varios factores que afectan al crecimiento del feto y el desarrollo fetal y placentario durante la gestación:
Calidad de los ovocitos
Duración del celo Implantación
Factores genéticos
Factores epigenéticos
Factores ambientales
Nutrición de la cerda
Capacidad uterina
A continuación, se analizan algunos de los factores más relevantes que pueden contribuir a una placentación ineficiente en cerdos.
En los cerdos, el componente genético influye directamente en el desarrollo placentario.
Por ejemplo, las placentas de las cerdas Yorkshire aumentan su tamaño y superficie durante el último tercio de la gestación, mientras que el crecimiento de las placentas de cerdas Meishan se mantiene estable en esa etapa, aunque presentan un marcado incremento en la densidad de vasos sanguíneos en la interfase placenta-endometrio, lo que favorece una mayor irrigación.
Estas diferencias reflejan la influencia del linaje sobre la morfología y la función placentarias, de modo que la placenta de la cerda Yorkshire presenta una mayor eficiencia por unidad de superficie en comparación con la de la cerda Meishan.

Diversos estudios han revelado que la capacidad uterina puede influir significativamente en el crecimiento prenatal.
Según Alvarenga-Dias y Almeida (2021), en el ambiente intrauterino existe una intensa competencia nutricional entre los embriones, que se vuelve crítica a partir del día 30 de gestación.
Como consecuencia, se observa una relación inversa entre el número de fetos y el crecimiento fetal: cuanto mayor es el número de fetos en el útero, menor es el desarrollo individual y mayor la competencia por la irrigación placentaria.
La capacidad uterina, por tanto, es un factor determinante en la variabilidad del peso fetal dentro de la camada, pudiendo verse comprometida a medida que avanza la gestación, lo que incrementa la proporción de fetos de menor tamaño y con mayor índice de mortalidad.
CONDICIÓN CORPORAL
Una vez finalizado el período de lactación, se espera que las cerdas retornen al celo en los cinco días posteriores al destete, iniciando así un nuevo ciclo reproductivo.
Sin embargo, debido al marcado balance energético negativo que se produce durante la lactación, el desarrollo folicular y embrionario puede verse afectado, dando lugar a una condición conocida como síndrome del segundo parto caracterizado por desequilibrios metabólicos que, en última instancia, pueden provocar la muerte embrionaria.
IMPLANTACIÓN Y DESARROLLO PLACENTARIO PUEDEN VERSE COMPROMETIDOS
NUTRICIÓN
El factor nutricional está estrechamente vinculado a la condición corporal y resulta fundamental en todas las etapas productivas de la producción porcina, especialmente durante la gestación, cuando el desarrollo embrionario y fetal está fuertemente influido por la nutrición materna, responsable de modular el metabolismo placentario.
Por tanto, las dietas con restricción de nutrientes provocan estrés y, en consecuencia, afectan el rendimiento productivo de las hembras.
El tamaño de los fetos también puede generar disfunción gastrointestinal al comprimir el tracto digestivo.
Esta compresión produce estrés oxidativo sistémico por la liberación de grandes cantidades de radicales libres, que comprometen la estructura y la función intestinal. En este contexto, el estrés oxidativo puede actuar como un factor desencadenante de complicaciones como el CIR.
Un factor estrechamente relacionado con la eficiencia placentaria es el estado nutricional, ya que en el último tercio de la gestación se requiere un mayor aporte de nutrientes para sostener el crecimiento fetal acelerado sin comprometer la viabilidad de los animales.
LAS CERDAS SELECCIONADAS POR UNA MAYOR EFICIENCIA PLACENTARIA SON CAPACES DE PARIR APROXIMADAMENTE
3,3 LECHONES ADICIONALES POR PARTO

CAPACIDAD UTERINA
La supervivencia embrionaria y la capacidad uterina son los principales factores responsables de la mortalidad prenatal y del CIR.
Este factor puede afectar el crecimiento fetal a partir de los 30 días de gestación, ya que, a medida que aumenta el tamaño de la camada, el flujo sanguíneo uterino disponible por feto se vuelve insuficiente y competencia entre los embriones por el espacio uterino y los nutrientes se vuelve más crítica.
EFICIENCIA PLACENTARIA
La eficiencia placentaria, expresada como la relación entre el peso corporal del lechón y la masa de su placenta, varía sustancialmente entre fetos de una misma camada, lo que indica que se trata de una característica individual.
Una de las principales causas del desarrollo fetal comprometido es el transporte insuficiente de nutrientes a través de la placenta, habiéndose demostrado la existencia de correlaciones positivas significativas entre el flujo sanguíneo placentario, el peso de la placenta y el peso fetal en cerdos.

En este sentido, la placenta de las cerdas Yorkshire aumenta progresivamente su tamaño y superficie durante el final de la gestación, estableciendo un entorno competitivo entre los fetos por los nutrientes. En cambio, las cerdas Meishan incrementan notablemente la densidad de sus vasos sanguíneos en esta fase, lo que les permite mantener un tamaño placentario constante sin comprometer el crecimiento fetal.
En un estudio realizado por Reis (2021) se observó una mayor vascularización a los 45 días de gestación en los fetos hembra de alto peso en comparación con los machos.
El incremento de la vascularización favorece el intercambio maternofetal, permitiendo que los fetos crezcan de forma más eficiente incluso en una capacidad uterina limitada y, en última instancia, mejorando la uniformidad dentro de la camada.
GARANTIZAR UN FLUJO SANGUÍNEO ADECUADO
DENTRO DE LA PLACENTA ES ESENCIAL PARA EL DESARROLLO
PLACENTARIO Y FETAL, JUNTO CON LA SUPERFICIE EFECTIVA DEL ÓRGANO
FLUJO SANGUÍNEO Y ESTRUCTURA
PLACENTARIA
Las tasas de flujo sanguíneo placentario pueden incrementarse mediante la angiogénesis y la vasodilatación, procesos regulados por el factor de crecimiento endotelial vascular (VEGF) y el óxido nítrico (NO), respectivamente.
La eficacia de la placenta está directamente relacionada con su estructura, ya que la longitud de los pliegues microscópicos de la capa epitelial del trofoblasto placentario y del endometrio aumenta en las placentas asociadas a fetos pequeños.
Estos cambios morfométricos amplían la superficie de interacción entre los flujos sanguíneos materno y fetal, mejorando así la eficiencia placentaria ante un tamaño reducido del órgano.
La longitud de la región estromal es menor en las placentas de fetos pequeños que en las de fetos grandes.
Dado que el tejido estromal está formado por fibroblastos, cuyo principal producto son los glicosaminoglicanos, sintetizados a partir de glucosa, el crecimiento restringido de los fetos porcinos podría reflejar un transporte insuficiente de este nutriente.
Las placentas asociadas a fetos con CIR muestran una expresión alterada de proteínas implicadas en el estrés oxidativo, la apoptosis, el metabolismo celular y el transporte de nutrientes.
En las cerdas Yorkshire, el tamaño de la placenta aumenta de forma proporcional al crecimiento fetal durante el último tercio de la gestación. En cambio, las hembras Meishan mantienen una placenta más pequeña pero extremadamente bien vascularizada, sin mostrar incrementos significativos en el peso de los fetos durante el mismo periodo.
La placenta experimenta una serie de modificaciones estructurales que permiten el crecimiento adecuado de la camada. Sin embargo, diversos factores pueden comprometer su desarrollo y función, siendo la insuficiencia placentaria un problema relevante en la producción porcina.
Las placentas ineficientes dan lugar al nacimiento de lechones pequeños, con menor viabilidad y peor desempeño.

Por ello, comprender los factores que influyen en la formación, el desarrollo y la actividad de la placenta constituye el primer paso para diseñar estrategias productivas eficaces que mejoren el rendimiento reproductivo de las cerdas en las granjas porcinas.

5 DOSIS
25 DOSIS
TRIPLE PROTECCIÓN EN CADA DOSIS
EXCELENTE PERFIL DE SEGURIDAD

Juan Manuel Herrero1 y Pablo Magallón2
1Especialista Servicios
Genéticos PIC Sur de Europa
2Director de Servicios Técnicos PIC Sur de Europa
LLDescarga el PDF
a mejora genética en las líneas maternas ha dejado de centrarse exclusivamente en la prolificidad para enfocarse en producir lechones más viables, uniformes y eficientes. Este cambio de paradigma, impulsado por nuevas tecnologías de selección y análisis, busca optimizar el crecimiento, el Bienestar Animal y la sostenibilidad de la producción porcina europea sin comprometer la rentabilidad.

Durante años, los productores han estado muy enfocados en la mejora de prolificidad, estando este parámetro directamente asociado a la rentabilidad en las líneas maternas. Sin embargo, en los últimos 3-5 años ha incremento progresivamente su interés por mejorar la calidad de los lechones, así como su rusticidad y eficiencia de crecimiento en cebo.
En efecto, no debemos subestimar la influencia de las líneas maternas en los caracteres clave como crecimiento e índice de conversión, y es que a menudo parece olvidarse que el 50 % producto final viene de las líneas maternas.
En el programa genético de PIC se asume que una alta prolificidad solo tiene sentido cuando se acompaña de la producción de un lechón con buen crecimiento, alto peso al destete y conversión en todas las fases productivas.
Recientemente hemos publicado un estudio en el que se comparó el crecimiento de machos castrados Camborough® (cruce Landrace X Large White) con el mismo cruce de una genética competidora observándose:
Una ganancia diaria en cebo de 875 g en los machos Camborough® frente a 866 g en el competidor.
Una mejora 80 g en índice de conversión.
SOLO CONSIDERANDO ESTE PUNTO, LA DIFERENCIA
ECONÓMICA ES SIGNIFICATIVA LLEGANDO A LOS
2,68 € POR CERDO
Con todo, este enfoque en la mejora de las líneas maternas busca complementar el enfoque económico de las líneas terminales para:
Aumentar la productividad sin incrementar los costes operativos.
Optimizar el uso del alimento.
Reducir el coste por lechón.
Mejorar la rentabilidad del sistema.

En España y en otras partes del mundo, conseguir mano de obra cualificada para las granjas y retenerla está suponiendo un reto muy difícil de gestionar, especialmente en áreas geográficas poco pobladas, que suelen ser las zonas de mejor bioseguridad.
El programa de mejora genética debe tener en consideración esta realidad.
CAPACIDAD DE AMAMANTAMIENTO
Como resultado de años de mejora en el número de tetas, actualmente el 68 % de cerdas de la Large White L03 de PIC tienen 16 tetas o más.
Con ello buscamos que el aumento de prolificidad venga acompañado de un alto número de lechones bajo la cerda.
HOMOGENEIDAD DE CAMADAS
Siendo conscientes de que el número de tetas no es suficiente para alcanzar este objetivo, durante más de 10 años hemos pesado todos los lechones puros al nacimiento en granjas élite, consiguiendo reducir el porcentaje de lechones pequeños y así aumentar la homogeneidad de camadas.
Con todo ello, se ha conseguido una menor necesidad de movimiento entre lechones y facilitar así el manejo en partos.
CAPACIDAD DE CRECIMIENTO Y CAPACIDAD LECHERA
Para potenciar este punto todavía más, este agosto 2025 hemos incluido en el programa genético un nuevo carácter ligado directamente a la capacidad de crecimiento de los lechones en lactación y a la mayor capacidad lechera de las cerdas.
PREDISPOSICIÓN A HERNIAS
Quizá más asociado al concepto de rusticidad, la continua mejora en reducción de hernias escrotales y umbilicales sigue siendo una prioridad y, por ello, son caracteres incluidos en el programa genético, combinando así el impacto de la genética con el necesario abordaje técnico en granja.
LONGEVIDAD DE LA CERDA
A nivel de cerda productiva, el incremento de la mortalidad en la industria en los últimos años supone un factor que afecta negativamente al trabajo en granja, tanto emocionalmente como en el manejo del día a día.
Hoy disponemos de tecnologías muy avanzadas con las que en el pasado apenas soñábamos.
Un ejemplo es el fenotipado digital de aplomos, que utiliza cámaras y un software de análisis de imagen que captura y procesa datos morfológicos en tiempo real y que ha demostrado tener una alta correlación con la longevidad de la cerda.
De esta forma podemos seleccionar aquellas cerdas con mayor potencial reproductivo y menor riesgo de eliminación temprana.
Con todo, si bien el programa genético ayuda a mejorar la longevidad, es necesario que en granja se haga una buena selección de las primerizas: buena condición corporal, mínimo de 14 tetas y aplomos correctos para seleccionar aquellas con mayor potencial reproductivo y menor riesgo de eliminación temprana.
Todos estos avances actuales y de futuro suponen para el productor:
Una reducción de la carga de trabajo.
Menor necesidad de intervenciones veterinarias.
Mayor estabilidad en el censo reproductor.
LA EFICIENCIA
LA MANO DE
DEDICAR MÁS TIEMPO A TAREAS ESTRATÉGICAS Y MENOS A CUIDADOS
INTENSIVOS, MEJORANDO
LA RENTABILIDAD Y SOSTENIBILIDAD DEL SISTEMA
El Bienestar Animal es un componente esencial en la producción porcina moderna, tanto por razones éticas como por su impacto en la productividad.
Desde un punto de vista genético, este siempre ha sido un apartado muy difícil de trabajar debido a:
Las dificultades a la hora de medir el fenotipo relacionado con el Bienestar Animal.
Las bajas heredabilidades de este tipo de caracteres.
Estamos en una época de desarrollo activo de herramientas tecnológicas de grabaciones y análisis de imagen, y PIC está invirtiendo mucho en estas tecnologías para comprender y mejorar el comportamiento social de los cerdos.
Creemos que esta es la vía futura para aumentar todavía más la productividad a través de la mejora en Bienestar Animal.
Un novedoso estudio con sensores de proximidad, cámaras de video y algoritmos de inteligencia artificial se han analizado las redes sociales (interacciones entre todos los animales de un mismo corral), la postura, la ubicación y la frecuencia de interacción entre animales, permitiendo identificar comportamientos atípicos, como agresividad o aislamiento.
La aplicación de estas tecnologías nos permite confirmar cosas que ya sabemos, como que los cerdos forman jerarquías estables, pero además ahondar en detalles como que ciertos individuos actúan como nodos centrales en la interacción grupal.
Al ser todos los animales del estudio puros con pedigrí conocido, hemos analizado cómo estos patrones de comportamiento llegan a tener heredabilidades estimadas entre el 20 % y el 40 %, que serían valores superiores a caracteres que responden bien a la mejora genética, como el número de nacidos totales.
Estamos convencidos de que, en el futuro, la mejora de caracteres de comportamiento permitirá seleccionar genéticamente animales altamente productivos, sociales y con mayor bienestar y que esta es una estrategia viable y realista para conseguirlo.
La gestión sanitaria eficiente es fundamental para:
Reducir pérdidas.
Minimizar tratamientos.
Prolongar la longevidad de los animales.
Abordar problemas sanitarios desde el punto de vista genético es posible de forma indirecta, pero requiere un programa muy intenso de recogida de datos.
El programa GNX terminal y GNX Materno incluye más 75.000 cerdas F1 criadas en granjas comerciales y 150.000 cerdos comerciales, susceptibles a enfermedades clínicas y subclínicas, y con padre y madre conocidos.
Estas cerdas y cerdos comerciales generan datos para calcular valores genéticos estimados en caracteres relacionados con la longevidad de la cerda y mortalidad del lechón.
Para el productor, esto significa:
Reducción en los sacrificios involuntarios.
Menor uso de medicamentos.
Mayor estabilidad en la producción.

LA MEJORA EN LA SALUD ANIMAL PERMITE MANTENER ANIMALES MÁS TIEMPO EN PRODUCCIÓN, REDUCIR COSTES SANITARIOS Y MEJORAR LA EFICIENCIA GLOBAL DEL SISTEMA
LA INVERSIÓN EN GENÉTICA AVANZADA SE TRADUCE EN SOSTENIBILIDAD, RENTABILIDAD Y RESILIENCIA FRENTE A LOS DESAFÍOS DEL FUTURO

Si bien el impacto de los programas de mejora genética se ha asociado históricamente al aumento de la productividad y rentabilidad de la industria agroalimentaria, su influencia en la reducción del impacto medioambiental es mucho menos conocido y estudiado.
La sostenibilidad y la capacidad de adaptación a cambios regulatorios y de mercado son aspectos a tener muy en cuenta en la producción porcina actual:
Ya hay países que están planteando la posibilidad de incluir impuestos específicos a las granjas de producción en función de su impacto ambiental.
No es descartable en absoluto que, en un futuro, grandes superficies o empresas de alimentación consideren factores de sostenibilidad ambiental para elegir a sus proveedores de carne.
El hecho de que PIC haya desarrollado programas genéticos y tecnológicos para seleccionar animales robustos, longevos y eficientes hace que la mejora genética contribuya directamente en la sostenibilidad de las granjas.
A este respecto, ¿se puede cuantificar el impacto ambiental?
Hoy en día, la ciencia aplicada incluye modelos de análisis del ciclo de vida (LCA) que se puede aplicar a la producción porcina para cuantificar el impacto ambiental de cada línea genética.
En un estudio reciente que se realizó comparando la genética PIC con la media de la industria se demostró que los programas de mejora genética porcina reducen significativamente:
La emisión de gases de efecto invernadero.
El uso de recursos naturales.
La generación de residuos.
Este impacto ambiental puede ser cuantificado de manera creíble y defendible mediante una evaluación del ciclo de vida (LCA) conforme a la norma ISO.
El estudio comparativo del impacto ambiental de la genética en el año 2021 con el impacto previsto en el año 2030 concluye que la mejora genética se asocia a una reducción en la emisión de gases efecto invernadero de del 7-9 % en el periodo de 9 años analizado asociado a la mejora genética.
Tanto si buscas optimizar costes con la Camborough® como maximizar la productividad con la PIC®X54, PIC® te ofrece soluciones genéticas personalizadas. Como el único proveedor que lidera ambos segmentos, nuestras hembras destacan por su rentabilidad, facilidad de manejo, bienestar, resiliencia sanitaria e innovación preparada para el futuro. Porque los productores de hoy no deberían elegir entre dos caminos para lograr su éxito: Pueden dominar ambos. Descubre más en es.pic.com


a concentración de espermatozoides en las dosis utilizadas para inseminación artificial es un factor clave en el rendimiento reproductivo de las granjas porcinas. Sin embargo, su impacto real sobre parámetros como la tasa de partos y el tamaño de camada sigue siendo objeto de estudio. Este trabajo analiza el efecto de incrementar en un 20 % la concentración seminal en una explotación de alto estatus sanitario, evaluando si este ajuste puede traducirse en mejoras significativas en la eficiencia reproductiva.






Descarga el PDF
Raquel Fernández Rodríguez1, Henar González Ramiro1, Anselmo Martínez Moreno1, Álvaro Guerrero Masegosa1, Juan Conesa Navarro1 y Paula Sánchez Giménez2
1Agropor S.L.
2Técnico Veterinario

CLa inseminación artificial (IA) es una técnica ya implementada como un manejo básico en todas nuestras granjas, imposible de desligar ya a la mejora productiva que se ha visto con los años.
Ha sido fundamental para facilitar mejoras globales en la fertilidad, el avance genético, el trabajo en granja y la sanidad del hato reproductivo.
Desde que su uso generalizado comenzó en los años 80, cuando también se establecieron los primeros centros de inseminación, se ha ido perfeccionando la técnica hasta hoy en día.
Aun así, no tenemos explicación para los distintos resultados que se ven en granjas que, a priori, la usan en igualdad de condiciones. Sigue existiendo una gran dispersión de resultados entre granjas y entre verracos.
Se sabe que hay parámetros relacionados con la técnica de IA que tienen gran influencia en los resultados, sobre todo de fertilidad y del tamaño de camada. Por ejemplo:
La proporción de espermatozoides útiles en la dosis utilizada, a la que hay que restar del total los anormales e inmóviles.
El intervalo de inseminación con respecto al momento de la ovulación de la cerda1
Los resultados obtenidos en relación al tamaño de camada están muy influenciados por la línea genética de la madre. No obstante, en estos momentos, con la mejora genética y la evolución del sector, el objetivo de fertilidad en una granja que cuente con una buena sanidad debería situarse siempre por encima del 90%.
Existen muchos factores que entran en juego para poder alcanzar el objetivo de fertilidad, incluyendo manejo, sanidad, bioseguridad, calidad seminal, correctas instalaciones con unas óptimas condiciones ambientales, personal, etc. Ninguna, por sí misma, permite garantizar una fertilidad óptima, pero un fallo en cualquiera de ellas puede arruinar los resultados reproductivos de nuestra granja.
A continuación, se muestran los resultados de un estudio sobre cómo la concentración de espermatozoides de las dosis seminales contribuye a maximizar la eficiencia reproductiva.


A la hora de evaluar las dosis seminales, los principales parámetros que puedan afectar a su calidad son, entre otros:
Nivel de contaminación
Motilidad
Grado de aglutinación
Concentración de espermatozoides
Morfología de los espermatozoides
Integridad del acrosoma
Funcionalidad espermática
El volumen de dosis ideal sería de 45 ml para uso postcervical si queremos tener un margen de seguridad, aunque con una dosis de entre 30 y 35 ml sería más que suficiente.
Se ha señalado que utilizar dosis superiores a 60 ml podría provocar un proceso de defensa uterina más agresivo de lo normal, exacerbando la destrucción de espermatozoides. Esto conllevaría una reducción de ovocitos fecundados y una disminución del número de lechones nacidos2.
Pero ¿qué sabemos de la concentración ideal?
Realmente hay muy pocos estudios a nivel de campo que hablen de cuál sería la concentración ideal para obtener el máximo potencial de nuestro hato reproductivo.
La cifra varía entre un amplio rango y en los primeros trabajos se hablaba de concentraciones de 5.000 y 10.000 millones sptz/dosis para obtener la fertilidad óptima.
Al ir avanzando en el campo de los diluyentes de mayor duración y calidad y en el análisis y control del propio semen, las concentraciones usadas han ido reduciéndose gradualmente, estando ahora en valores de entre 1.000 y 3.000 millones sptz/dosis3, dependiendo del análisis y la pauta de inseminación elegida.
Según bibliografía, se han descrito incluso efectos adversos al usar dosis altamente concentradas (60-100 x 106 spz/ml), reduciendo la motilidad de los espermatozoides y reflejando que, para obtener una motilidad adecuada, las dosis no pueden superar una concentración superior a 55 x 106 sptz/ml4.
Muchos trabajos lanzan datos demostrando el poco o nulo efecto sobre la tasa de fertilidad o los lechones nacidos totales por camada cuando aumenta la concentración de la dosis1,5–7
Otros estudios sugieren que, a medida que aumenta el número de espermatozoides (de 2.500 a 4.500 millones sptz/dosis), el tamaño de camada también aumenta8
Un estudio comparó dosis de 1.000, 2.000 y 3.000 millones espermatozoides y solo la dosis de 1.000 millones redujo la tasa de parto y el tamaño de la camada9.
Datos propios de hace ya unos años (2017-2018) sobre la inseminación postcervical de cerdas multíparas con concentraciones (1.200 x millones vs 2.400 millones) y volúmenes (90 ml vs 45 ml) distintos también revelaron diferencias importantes en prolificidad, pero siempre con grandes variaciones entre granjas, ya que en ellas se estaba trabajando con líneas genéticas distintas (Tabla 1).
En este sentido, la concentración óptima es un parámetro controvertido en cuanto a resultados a nivel de campo y seguimos teniendo grandes diferencias entre países, empresas, regiones, genéticas, proveedores y granjas.
Granja 1
2
3
3 90 ml 16,18 17,17 13,33 12,64
ml 14,81 14,46 12,38 12,53
TABLA 1
Diferencias en lechones nacidos totales (LNT) usando distintos volúmenes en cerdas multíparas (Fuente propia).


Con el fin de saber qué es lo que mejor se adapta a nuestras condiciones, seguimos haciendo pruebas y buscando siempre la combinación óptima, descartando distintos factores y afianzando otros. A continuación, detallamos la última de ellas, hecha en una de nuestras granjas.
La granja en cuestión es una multiplicadora con capacidad para unas 2.000 cerdas con autorreposición, donde se trabaja con cerdas SPF (libres de patógenos específicos) y de raza Large White.
El objetivo del estudio fue evaluar el efecto de dos concentraciones de espermatozoides (sptz) diferentes sobre el rendimiento reproductivo, la tasa de partos y el tamaño de la camada:
La concentración estándar en dosis comerciales.
Una concentración que garantizase al menos un 20 % adicional de espermatozoides totales en las dosis.
PREPARACIÓN DE LAS DOSIS
Los formatos de dosis que utilizamos en nuestro estudio fueron (Gráfica 1):
Concentración estándar: 27 x 106 sptz/ml.
Concentración alta (+20%): >30 x 106 sptz/ml.
En cuanto al volumen de las dosis:
Para las inseminaciones tradicionales utilizamos un volumen de 90ml.
Para las inseminaciones postcervicales utilizamos un volumen de 60 ml.
Para no sesgar los resultados por el efecto verraco, cada eyaculado se dividió en dos alícuotas que fueron diluidas hasta alcanzar las dos concentraciones objetivo. La concentración inicial en el eyaculado previa dilución, y en las dosis finalmente preparadas, fue confirmada mediante análisis con Nucleocounter (SP100, Chemometec).
Así, las concentraciones reales medidas en los grupos prueba fueron:
Dosis estándar: 26,2 ± 0,52 millones sptz/ml.
Dosis concentración alta: 31,8 ± 0,57 millones sptz/ml.
Las dosis se prepararon con el mismo diluyente y bajo las mismas condiciones de preparación y análisis de calidad. Solo se emplearon eyaculados que cumplieran con los criterios mínimos de calidad (motilidad y porcentaje de formas anormales).
Las dosis se identificaron con información del verraco, fecha y tipo de concentración utilizada.
Todas las cubriciones se realizaron con el protocolo de inseminación habitual por el personal de la granja y se registraron en el programa de gestión de la explotación.
Las cerdas fueron distribuidas aleatoriamente en ambos grupos, procurando evitar sesgos por motivos de ciclo y número de cubrición o repetición. También se pesaron y se evaluó su condición corporal en el momento de la inseminación para evitar dichos factores discriminatorios entre grupos.
Los resultados analizados incluyeron:
Tasa de parto
Nacidos totales por camada (LNT)
Nacidos vivos por camada (LNV)
El estudio incluyó resultados de cubriciones realizadas en cerca de 600 cerdas de ciclo 1, 2 y 3 (mayoritariamente ciclo 2) durante 12 semanas entre los meses de marzo a mayo 2024.

TABLA 2
Resultados de la Tasa de partos tras la inseminación de cerdas con distintas concentraciones seminales.
En la Tabla 2 se muestran los datos de la Tasa de partos de ambos grupos, sin diferencias.
TABLA 3
Resultados de Lechones Nacidos
Totales (LNT) tras la inseminación de cerdas con distintas concentraciones seminales.
En cuanto al resultado de esos partos, tampoco se vieron distinciones en el número de lechones nacidos totales por camada (Tabla 3) ni en el de lechones nacidos vivos (Tabla 4).
TABLA 4
Resultados de Lechones Nacidos
Vivos (LNV) tras la inseminación de cerdas con distintas concentraciones seminales.
Algunos ejemplos de factores que no siempre se llevan bien o que no pueden evitarse en todas las granjas son:
Mala detección de celo y momento de inseminación inadecuado (demasiado pronto o demasiado tarde).
Condiciones ambientales adversas (estrés por calor).
Mala conservación de las dosis seminales hasta el momento de su uso.
Condición corporal y alimentación subóptimos durante todo el ciclo.
Crisis sanitarias en el hato reproductivo.
A este respecto, sería interesante comprobar si el uso de más espermatozoides en las dosis podría contribuir a paliar el efecto de estas circunstancias en los resultados de nuestras granjas.
En este caso, no se observaron mejoras en la tasa de partos o el tamaño de camada al aumentar el número de espermatozoides de nuestras dosis.
Cuando se realiza un buen manejo en la cubrición, en buenas instalaciones y con un buen nivel sanitario, el incremento del número de espermatozoides en la dosis no supone un beneficio porque los resultados reproductivos de la granja ya son buenos, lo que permite un margen muy estrecho de mejora.
Quedaría pendiente evaluar si aumentar el número de espermatozoides en las dosis (mediante el uso de mayores volúmenes o concentraciones) podría resultar beneficioso en situaciones en las que las condiciones no sean óptimas, pues muchas granjas trabajan con manejos, instalaciones y sanidad con margen de mejora.
BIBLIOGRAFÍA
1. Steverink DWB, Soede NM, Bouwman EG, Kemp B. Influence of insemination-ovulation interval and sperm cell dose on fertilization in sows. J Reprod Fertil. 1997;111:165–71.
2. Gil J. Características de las dosis de semen: volumen, concentración y conservación. www.3tres3.com. 2021.
3. Knox R V. Artificial insemination in pigs today. Theriogenology. 2016;85:83–93.
4. Quirino M, da Rosa GT, Spohr Christ T, Valadares WR, da Rosa Ulguim R, Bernardi ML, et al. Estimation of sperm concentration limits to produce intrauterine insemination doses in swine. Reproduction in Domestic Animals. 2023;58:785–92.
5. Broekhuijse MLWJ, Šoštarić E, Feitsma H, Gadella BM. The value of microscopic semen motility assessment at collection for a commercial artificial insemination center, a retrospective study on factors explaining variation in pig fertility. Theriogenology. 2012;77.
6. Broekhuijse MLWJ, Šoštarić E, Feitsma H, Gadella BM. Application of computer-assisted semen analysis to explain variations in pig fertility. J Anim Sci. 2012;90:779–89.
7. Park S. Effects of sow, boar and semen traits on sow reproduction. 2013;
8. Reicks DL, Levis DG. Fertility of semen used in commercial production and the impact of sperm numbers and bacterial counts. Theriogenology. 2008;70:1377–9.
9. Watson PF, Behan JR. Intrauterine insemination of sows with reduced sperm numbers: results of a commercially based ®eld trial. Theriogenology. 2002;57:1683–93.

Marina López R. y
Pedro J. Llamas
Servicio técnico de Import-vet
LLDescarga el PDF
a inseminación artificial ha transformado la producción porcina, impulsando el progreso genético y la eficiencia en granja. En este contexto, el Sistema Multidosis se presenta como una alternativa innovadora que combina practicidad, sostenibilidad y optimización del trabajo reproductivo.
La inseminación artificial (IA) en el porcino se desarrolló en los años 80 y, con ella, surgieron múltiples estilos de catéteres y distintos envases para contener la dosis seminal, como el tubo, la botella y el blíster.
Las técnicas de IA tradicional y post-cervical han revolucionado la producción porcina, principalmente, al permitir:
Un avance genético más rápido.
Una mayor eficiencia en el tiempo de inseminación en granja.
La eficiencia en la inseminación en granja no solo depende de la calidad del eyaculado, sino también de la logística (transporte), la conservación adecuada y la precisión en la aplicación de la dosis.
Hoy más que nunca, la eficiencia reproductiva, la optimización del tiempo de trabajo, la escasez de mano de obra y el manejo en bandas hacen que el sistema de inseminación multidosis sea una alternativa capaz de aportar soluciones a los retos de la producción porcina actual.
Al mismo tiempo, observamos cómo la sostenibilidad y la eficiencia han adquirido un papel central en la industria porcina moderna.
A medida que la Unión Europea endurece la normativa sobre envases y residuos, especialmente a través del Reglamento (UE) 2025/40, la búsqueda de soluciones operativas que optimicen la producción y minimicen el impacto ambiental se vuelve crucial.
LEER REGLAMENTO (UE) 2025/40
Desde Import-vet nos enfocamos en la transición hacia una economía circular y de bajas emisiones, ofreciendo alternativas eficientes.
El Sistema Multidosis se presenta como una solución integral aplicada a la inseminación post-cervical que, además de cumplir los objetivos de reducción de plásticos establecidos por el nuevo Reglamento, impulsa la eficiencia en granja al reducir la necesidad de mano de obra y optimizar el tiempo destinado a la inseminación.
BENEFICIOS INMEDIATOS DEL SISTEMA MULTIDOSIS
VELOCIDAD DE APLICACIÓN
VELOCIDAD DE APLICACIÓN
El sistema permite una inseminación segura con el método “manos libres”, lo que facilita inseminar múltiples cerdas en menor tiempo, tanto multíparas como primerizas.
REDUCCIÓN DE INVERSIÓN Y CARGA DE TRABAJO
Se trata de una solución "todo en uno" que requiere menor inversión para alcanzar una productividad superior y demanda menos carga de trabajo en comparación con el proceso de inseminación estándar.
CONSERVACIÓN SEMINAL
CONSERVACIÓN SEMINAL
Gracias al mayor volumen de semen en las bolsas multidosis, se obtiene una mayor homogeneidad térmica, lo que garantiza una mejor conservación y una mínima variación de temperatura durante el almacenamiento y el transporte.
Las bolsas cuentan con una capa externa de aluminio que protege a los espermatozoides de la exposición a la luz ambiental y reduce la peroxidación.
MENOR ESPACIO REQUERIDO
MENOR ESPACIO REQUERIDO
El sistema reduce significativamente el espacio necesario para almacenamiento y transporte en comparación con el envasado individual (hasta 65 dosis por bolsa).
Permite optimizar el tiempo en el laboratorio y constituye una alternativa eficaz de respaldo en caso de avería del equipo de envasado.
SOSTENIBILIDAD
SOSTENIBILIDAD

El sistema multidosis contribuye a reducir los residuos plásticos al sustituir los blísters por una única bolsa, alineándose directamente con los objetivos centrales del Reglamento Europeo.
EFICIENCIA REPRODUCTIVA Y
OPERACIONAL
El sistema es un kit completo que consta de una bolsa seminal de 2 o 3 litros conectada a un catéter mediante una pistola dosificadora.
Incluye un fuelle volumétrico y permite volúmenes ajustables de 30, 40 o 45 ml, además de una mochila isotérmica.
La bolsa está fabricada en plástico y aluminio, proporcionando su capa externa de aluminio un mejor aislamiento térmico y protegiendo a los espermatozoides de la exposición a la luz ambiental.
IMPORTANTE: es fundamental que, una vez extraída de la nevera la bolsa con el semen diluido, se homogenice el contenido mediante suaves movimientos de balanceo. De esta manera, el diluyente y las células que se han sedimentado de forma natural se reconstituyen fácilmente.
Se recomienda que, antes de la inseminación, se realice nuevamente un movimiento de balanceo con la mochila isotérmica para garantizar que la dosis contenga la concentración adecuada.
Posteriormente, el movimiento natural del operario durante la aplicación contribuye a la homogeneización continua del fluido seminal, asegurando la uniformidad de las dosis administradas.

EL SISTEMA MULTIDOSIS SE EMPLEA EXCLUSIVAMENTE EN LA TÉCNICA DE INSEMINACIÓN ARTIFICIAL POST-CERVICAL
En la técnica cervical tradicional, la cerda debe absorber la dosis a su propio ritmo —un proceso más lento— y la introducción de presión podría provocar reflujo seminal.
Por ello, se recomienda el uso del catéter Soft & Quick post-cervical en cualquiera de sus presentaciones y formatos, diseñado para nulíparas y multíparas.
Su ergonomía, facilidad de aplicación, seguridad y alto nivel de higiene lo convierten en la opción más adecuada.


Para más información sobre el sistema, puedes ponerte en contacto con nuestros técnicos en el correo int@import-vet.com o en el teléfono +34 938 813 898.
El Sistema Multidosis consta de los siguientes componentes:
La pistola de aplicación multidosis es el dispositivo encargado de administrar la dosis seminal de forma controlada.
Su correcto funcionamiento depende del fuelle volumétrico, un componente esencial para garantizar una dosificación precisa. Este fuelle, fácil de instalar, incorpora una válvula que impide el retorno del semen.

Es fundamental realizar una purga durante el primer llenado para asegurar su completa carga y un rendimiento óptimo antes de la aplicación.
El sistema Multidosis permite a los operadores inseminar múltiples cerdas, tanto multíparas como nulíparas, de forma rápida y con las manos libres, lo que se traduce en una menor carga de trabajo frente a los procedimientos de inseminación estándar.
Este sistema ofrece una solución completa y rentable que no requiere grandes inversiones.
El producto está certificado con estándares de alta calidad y se fabrica en Europa, cumpliendo con la certificación ISO 9001.
Su adopción permite a laboratorios y granjas optimizar los procesos de inseminación al tiempo que contribuyen a los ambiciosos objetivos europeos de prevención y reducción de envases, disminuyendo la dependencia del embalaje individual de un solo uso.





Descarga el PDF
a condición corporal al destete marca el punto de partida del siguiente ciclo reproductivo. Cuando las cerdas llegan a este momento con un balance energético negativo, el riesgo de trastornos como el Síndrome del Segundo Parto se dispara, comprometiendo la fertilidad, la prolificidad y la uniformidad de las camadas. Comprender y corregir esta pérdida de condición es esencial para mantener la eficiencia productiva y garantizar la continuidad del rendimiento en la granja.
Rafael Pallás Alonso Director técnico de KUBUS –

En cualquier granja con una tasa de renovación anual correcta del 40–50 %, el porcentaje de hembras primerizas, hembras que han parido una vez y van a hacer el segundo parto, oscila entre el 17 % y el 20 %.
Por tanto, es imprescindible tener buenos resultados productivos con las primerizas para que el global de la granja obtenga óptimos resultados técnicos y económicos.
En las granjas actuales es muy habitual que, en su primer parto, la cerda logre un excelente desempeño reproductivo (fertilidad a parto y no de lechones nacidos).
Sin embargo, también es muy habitual que estos excelentes resultados del primer parto se vengan abajo en el segundo por la aparición del Síndrome del Segundo Parto.
Este trastorno reproductivo se manifiesta por los siguientes signos:
Anoestro postdestete: prolongación del intervalo destete-celo (>7 días).
Infertilidad: tasa de partos inferior al 85 % (en muchas ocasiones no llegan ni al 80 %).
Disminución del número total de lechones nacidos (<11 lechones).
La prolongación del intervalo destete – salida a celo (IDC) es una de las principales consecuencias de la deficiente condición corporal al destete, teniendo mayor incidencia en las cerdas más jóvenes, apareciendo como uno de los signos principales del Síndrome del Segundo Parto.
En el origen de este cuadro se encuentra la notable pérdida de peso que se produce durante la primera lactación, llegando las cerdas al destete con una pobre condición corporal.
Una cerda de primer parto debe comer para mantenerse, crecer y producir leche para la camada, pero el problema es que el consumo de pienso durante la lactación a menudo no es suficiente para cubrir todas estas necesidades.
Una cerda primeriza en lactación debería comer 7,5 – 8 kg/día. Sin embargo, el consumo de pienso medio de una primeriza rara vez supera los 6 – 7 kg/día y en ocasiones no llega ni a los 6 kg/día.
Este déficit energético perturba el funcionamiento hormonal, generando al destete un pico de LH retardado e inferior, lo que lleva a:
Un retorno a celo tardío.
Una ovulación retrasada.
Una tasa de progesterona inferior a la normal.
Infertilidad.
Además, la tasa de ovulación de estas cerdas es inferior y, lo que es más importante, los ovocitos liberados son de menor calidad, lo que lleva a:
Embriones con viabilidad reducida.
Aumento de la mortalidad embrionaria.
Camadas cortas.
Lechones más heterogéneos al nacimiento.
Uno de los puntos actuales de trabajo para mejorar el tamaño de los lechones al nacimiento es mejorar la condición corporal de las cerdas destetadas en el ciclo anterior con el fin de que los ovocitos liberados sean todos de buena calidad y tengan un ritmo de crecimiento parejo, ganando así uniformidad en la camada siguiente.
El uso de Altrenogest que se describe a continuación es válido tanto para las cerdas que acaban de terminar su primera lactación como para todas aquellas que al destete presenten una baja condición corporal, independientemente de su paridad.
El uso de Altrenogest al destete permite:
Retrasar la salida a celo unos días para permitir la recuperación de la cerda.
Cambiar el estado fisiológico de la cerda, de catabólico a anabólico.
Completar correctamente la involución uterina.
Disminuir el porcentaje de anoestros.
Mejorar los parámetros productivos del ciclo siguiente.
PROTOCOLO DE APLICACIÓN DE ALTRENOGEST AL DESTETE
El uso de Altrenogest en cerdas con baja condición corporal permite retrasar la salida a celo tras el destete, favoreciendo su recuperación física y mejorando los resultados reproductivos del siguiente ciclo.
El protocolo consiste en identificar a las cerdas candidatas dos días antes del destete, iniciar la aplicación del producto el día previo y mantenerla durante seis días más tras el destete, completando un total de ocho días de tratamiento.
Este procedimiento, representado en la Figura 1, permite sincronizar los celos sin alterar el flujo de producción de la granja.







Dos días antes del destete se procede a la identificación de las cerdas que van al segundo parto y de todas aquellas que presenten una pobre condición corporal, independientemente del número de partos que tengan.
El día del destete se aplica el producto y el grupo de cerdas es destetado de la misma forma que sus compañeras de banda, acompañándolas a la zona de destete-cubrición de la granja donde recibirán el mismo manejo nutricional que sus compañeras, flushing, alimentación con pienso de lactación, etc.
¡DESTETE!





Al día siguiente, es decir, el día antes del destete, se inicia la aplicación de Altrenogest.


La aplicación de Altrenogest se prolonga durante 6 días más tras el destete, de forma que el número total de días de aplicación del producto es de 8 (1 previo al destete, el día del destete y 6 más).
FIGURA 1
Protocolo de aplicación de Altrenogest en cerdas con baja condición corporal al destete para favorecer su recuperación y sincronizar el celo sin afectar el ritmo de producción de la granja.
Con esta práctica, el último día de aplicación del producto es el anterior al día del siguiente destete de las cerdas que han seguido el flujo normal de la granja.
Como las cerdas que han tomado Altrenogest vuelven a ciclar espontáneamente a los 4 o 5 días tras el cese de la aplicación del producto, salen a celo junto con las del destete de la semana siguiente, pasando a formar parte de la siguiente banda de producción.
Si esta forma de trabajo se realiza de forma continua, excepto la primera vez, no hay disminución en la cuota de monta semanal, ya que cada banda de producción pasa a la semana siguiente un grupo de cerdas, pero recibe otro de la banda anterior, con lo que el número de cubriciones semanales se mantiene prácticamente constante y el flujo de producción no se resiente.
La prolongación del IDC es uno de los factores que más influyen en los resultados productivos de las granjas, de forma que las cerdas que ciclan entre los 3 y 6 días tras el destete siempre tienen los mejores resultados productivos, tanto en fertilidad a parto como en prolificidad. En cambio, las cerdas que extienden este intervalo a los 7 – 10 días normalmente tienen los peores resultados de toda la granja.
Una alimentación deficiente en lactación origina una pérdida de condición corporal y, por tanto, la movilización de reservas. Así, cuanto mayor sea la pérdida de condición corporal, mayor será el IDC.
Por ello, el control del estado de carnes al momento del destete es una de las principales tareas del personal del área de lactación, de forma que pérdidas de peso superiores al 10 % entre parto y destete ya son problemáticas y críticas por encima del 15 %.
UN ESPESOR DE GRASA DORSAL ENTRE 16 Y 20 mm EN P2
La pérdida de grasa en el punto P2 entre el parto y el destete no debería ser superior a 4 mm, ya que las pérdidas superiores indican exceso de pérdida de condición corporal.


Las cerdas que al destete se encuentran en un estado fisiológico con predominio catabólico tienden a:
Prolongar el IDC.
Aumentar el porcentaje de anoestros y repeticiones de ciclo.
Tener un menor número de lechones en el siguiente parto.
Para acortar el IDC no hay mejor estrategia que el trabajo intenso con varios machos a la vez desde el mismo día del destete.
Para evitar el deterioro de la condición corporal debemos implementar estrategias para incrementar el consumo durante la lactación:
Levantar a las cerdas varias veces al día.
Limpieza diaria de los comederos.
Suministrar pienso fresco varias veces al día: usar dietas concentradas.
Vigilar fermentaciones del pienso: las altas temperaturas de las salas de partos hacen que la fermentación aparezca rápidamente.
Suministro de agua ad libitum.
Caudal de agua mínimo: 3-3,5 L/minuto.
Suplementar agua.
Refrigerar las salas de partos.
La gestión adecuada de la condición corporal al destete y la aplicación estratégica de Altrenogest constituyen herramientas eficaces para reducir los trastornos reproductivos asociados al Síndrome del Segundo Parto.
Al favorecer la recuperación fisiológica de las cerdas y sincronizar su retorno al celo sin alterar el ritmo productivo, se mejora la fertilidad, la prolificidad y la uniformidad de las camadas, consolidando así la eficiencia y la sostenibilidad de la explotación.

Cada reto es una oportunidad de éxito
Evita las soluciones a corto plazo y mejora tu productividad.
Con más de 30 años de experiencia en el sector porcino hemos desarrollado vacunas, servicios y herramientas tecnológicas eficientes que harán tu negocio sostenible en el tiempo.
a sanidad es uno de los pilares fundamentales en la producción porcina, siendo la prevención mediante la vacunación la clave para conseguir el mejor estado sanitario. Tradicionalmente, este proceso se ha realizado por vía intramuscular mediante el uso de agujas. Aunque este método está ampliamente extendido, se ha demostrado que puede generar estrés y daño tisular.
Por suerte, existen alternativas a la vía intramuscular con aguja para la administración de determinadas vacunas, como es el dispositivo IDAL® de MSD Animal Health, un sistema de vacunación intradérmica y sin aguja que asegura un nivel máximo de bienestar, tanto en cerdas como en lechones, durante el proceso de aplicación de las vacunas. Descarga el PDF

César Llorente Carnicer, María Luisa Pérez-Breña Martín, Marcial Marcos Cienfuegos, Rut Menjón Ruiz y Marta Jiménez Salvador
Departamento técnico de MSD Animal Health
VEl hecho de vacunar sin aguja no solo repercute positivamente en el bienestar y la salud de los animales, sino que evita la transmisión iatrogénica de algunos patógenos1, como el virus del PRRS, que de otro modo se diseminarían con facilidad.
Para conseguir una adecuada inmunización de los animales frente a los diferentes patógenos que les desafían, es necesario utilizar eficaces a través de un proceso de vacunación de calidad.
El proceso de vacunación puede ser un trabajo tedioso un esfuerzo físico importante. Por ello, es de vital importancia mejorar tanto las condiciones de vacunación como la motivación de los operarios que aplican las vacunas.
Los dispositivos IDAL® son ampliamente conocidos, ya que llevan más de 20 años en el mercado y se han consolidado como una clave en la vacunación de cerdas y lechones.
Una prueba de ello son los 86 millones de dosis que se aplicaron en nuestro país entre 2021 y 2024 (ambos incluidos).
A lo largo de este tiempo, han demostrado ser una segura y respetuosa con el bienestar animal, en comparación con los métodos de vacunación con aguja.
Las ventajas que el dispositivo IDAL® nos ofrece son numerosas:
BIENESTAR
Al no utilizar agujas en el proceso de vacunación, evitamos lesiones y daño tisular a nivel muscular, ya que la vacuna se aplica por vía intradérmica.
Con ello, también reducimos el riesgo de generar abscesos
Con IDAL® administramos 0,2ml por dosis, lo que suele ser un volumen 10 veces menor que el de otras vacunas intramusculares, mejorando considerablemente la inocuidad del proceso.


REDUCCIÓN DE LA TRANSMISIÓN IATROGÉNICA DE PATÓGENOS
probabilidad de transmitir cualquier enfermedad de un animal a otro durante el proceso de vacunación disminuye considerablemente al no utilizar agujas.
SEGURIDAD
Con el dispositivo IDAL® los operarios no corren el riesgo de tener accidentes con agujas mientras vacunan. Además, evitamos la posible aparición de restos de agujas en la canal, lo que contribuye a una mayor seguridad y calidad alimentaria.
RESPUESTA INMUNITARIA
Al ser la piel un tejido muy especializado en el desarrollo de la respuesta inmunitaria, la inmunidad que se genera tras la administración intradérmica parece ser más rápida y eficaz que la obtenida por vía intramuscular3,4,5 y, en el caso de los lechones, se ha visto que puede educir la interferencia con la inmunidad maternal6, lo que favorece una mejor respuesta a la vacunación.
SOSTENIBILIDAD
Con IDAL® reducimos los residuos generados al no usar agujas durante el proceso de vacunación y, dado que el volumen de cada dosis es mucho menor que con la vacunación intramuscular, se reduce el volumen de envases y embalajes para vacunar el mismo número de animales que con la vía intramuscular. Además, se optimiza el transporte y conservación de las vacunas y se reduce el coste en la eliminación de dichos residuos.
VACUNACIÓN DE PRECISIÓN
Los dispositivos IDAL® están calibrados para administrar de manera continua cada dosis con unos valores muy concretos de presión y volumen. Además, incluye un software que nos permite contabilizar el total de dosis aplicadas por sesión de vacunación, así como las dosis administradas por vial.
Esta información podemos sincronizarla con una aplicación y almacenarla en una base de datos para consultarla y tener una adecuada trazabilidad de los procesos de vacunación.
TODAS ESTAS VENTAJAS CONVIERTEN A IDAL® EN UNA GRAN ALTERNATIVA FRENTE A LA CLÁSICA
VACUNACIÓN INTRAMUSCULAR CON AGUJA
A pesar de que actualmente existe mucha información sobre las ventajas del uso de los sistemas de vacunación intradérmica en cerdas y lechones, hasta ahora apenas teníamos datos sobre la opinión de los usuarios de los dispositivos.
Para ello, a lo largo de los últimos tres años, desde MSD Animal Health se han realizado encuestas de satisfacción a diferentes personas que vacunan utilizando estos dispositivos en granjas de ganado porcino distribuidas por toda la geografía española.
Este artículo presenta un análisis detallado de los resultados de dicha encuesta, que destaca:
Las virtudes del dispositivo.
La opinión favorable de los usuarios en cuanto a su funcionalidad, seguridad y eficacia.
La opinión sobre los servicios de formación y revisión de la vacunación ofrecidos por el departamento técnico de MSD Animal Health.
Desde principios de 2022 hasta mediados de 2025 se realizaron 100 encuestas a usuarios de IDAL® (operarios y encargados de granja).
Este importante número de encuestas nos permite obtener una idea bastante fiable sobre lo que piensan las personas que se encargan de vacunar a los animales en la granja.
A continuación, desglosamos los resultados obtenidos en las preguntas más relevantes que componen dicha encuesta (siendo 10 la máxima puntuación en cada pregunta):
1. ¿QUÉ GRADO DE SATISFACCIÓN TIENES CON LOS DISPOSITIVOS IDAL®?
Resultado medio: 9
Con una puntuación media de 9, la satisfacción general con el dispositivo IDAL® es muy alta.
Los usuarios destacan la facilidad de uso, la fiabilidad y la precisión como factores clave para su alta valoración.


2. SEGURIDAD DURANTE LA VACUNACIÓN CON IDAL® FRENTE A JERINGAS CONVENCIONALES
Resultado medio: 9,4
La puntuación obtenida en esta pregunta deja claro el gran valor que los operarios dan a no utilizar agujas durante el proceso de vacunación, reduciendo en gran medida el riesgo de accidentes con agujas, así como de auto inyecciones accidentales gracias al doble sistema de seguridad de estos dispositivos.
3. MANEJO DEL DISPOSITIVO IDAL® DURANTE LA VACUNACIÓN FRENTE A JERINGAS CONVENCIONALES
Resultado medio: 9,2
Además de la seguridad, los usuarios también valoran positivamente la facilidad de manejo del dispositivo.
Con una puntuación de 9,2, la mayoría de los encuestados consideran que la vacunación con IDAL® es más cómoda y sencilla que utilizando jeringas tradicionales.
4. EN TU OPINIÓN, ¿LA VACUNACIÓN CON IDAL® REDUCE EL ESTRÉS Y EL DOLOR EN LOS ANIMALES?
Resultado medio: 8,9
La percepción de los usuarios sobre el impacto de IDAL® en la reducción del estrés y el dolor en los animales es muy positiva.
Con una puntuación media de 8,9 los operarios reconocen que el dispositivo contribuye a un proceso de vacunación menos doloroso y más respetuoso con el bienestar animal.
Resultado medio: 9,2
Las revisiones de la vacunación con el dispositivo IDAL® que realiza el departamento técnico de MSD Animal Health periódicamente ayudan a mejorar la vacunación de los animales. Este punto es muy apreciado por todos los usuarios.
Resultado medio: 9,4
La mayoría de los usuarios ha valorado de forma muy positiva la contribución de estas visitas a la mejora en la calidad de la vacunación. Estas revisiones son clave para optimizar los procesos de vacunación y asegurar que se realicen de forma adecuada, lo que repercute directamente en la salud y el bienestar de los animales.
En la encuesta, el personal que utiliza IDAL® en las granjas también destacó que le gustaría recibir estas revisiones de manejo del dispositivo y del proceso de vacunación cada 6 meses, para asegurarse de que todo el proceso se está realizando correctamente y mejorar en aquellos aspectos que sean necesarios.
Esto demuestra la importancia de realizar un seguimiento periódico para mantener los estándares de calidad en la vacunación y asegurar que el proceso continúa siendo el adecuado a lo largo del tiempo, sobre todo en un sector en el que la rotación del personal es tan alta.
GRÁFICA 1
Resultados de la encuesta de satisfacción del uso de los dispositivos IDAL®.


Los resultados de las encuestas demuestran que los dispositivos IDAL® son altamente valorados por los usuarios, tanto en comodidad y seguridad, como en el impacto positivo que tiene sobre el bienestar de los animales.
Es importante que las personas que se encargan de vacunar los animales estén motivadas en el proceso y dotados de las herramientas adecuadas para mejorar la calidad de la vacunación y conseguir su máximo beneficio.
Las formaciones y revisiones de la vacunación y el seguimiento continuo proporcionado por el departamento técnico de MSD Animal Health son aspectos clave para los operarios y veterinarios, quienes consideran que estas prácticas mejoran la calidad de la vacunación y reducen el riesgo de errores.
La información obtenida a través de estas encuestas nos permite seguir evolucionando en el desarrollo de soluciones tecnológicas innovadoras que satisfagan las necesidades específicas, tanto de los animales como de los trabajadores, consolidando al dispositivo IDAL® como una herramienta indispensable en la gestión de la salud animal en las granjas del sector porcino.
BIBLIOGRAFÍA
1. Madapong A, Saeng-Chuto K, Tantituvanont A, Nilubol D (2019). Safety of PRRSV-2 MLV vaccines administrated via the intramuscular or intradermal route and evaluation of PRRSV transmission upon needle-free and needle delivery.
2. Temple D, Escribano D, Jiménez M, Mainau E, Cerón JJ, Manteca X (2017). Effect of the needle-free “intra demal application of liquids” vaccination on the welfare of pregnant sows.
3. Teunissen MBM, Haniffa M, Collin MP (2011). Insight into the Immunobiology of Human Skin and Functional Specialization of Skin Dendritic Cell Subsets to Innovate Intradermal Vaccination.
4. Renson P, Mahé S, Andraud M, Le Dimna M, Paboeuf F, Rose N, Bourry O (2024). Effect of vaccination route (intradermal vs. intramuscular) against porcine reproductive and respiratory syndrome using a modified live vaccine on systemic and mucosal immune response and virus transmission in pigs.
5. Martelli P, Saleri R, Cavalli V, De Angelis E, Ferrari L, Benetti M (2013). Systemic and local immune response in pigs intradermally and intramuscularly injected with inactivated Mycoplasma hyopneumoniae vaccines.
6. Martin-Valls GE, Cortey M, Swam H, Jiménez M, Mateu E (2023). High levels of maternally derived antibodies do not significantly interfere with the development of humoral and cell-mediated responses to Porcine circovirus 2 after intradermal vaccination.
Nueva vacuna bivalente intradérmica sin aguja frente a Circovirus porcino tipo 2 y M. hyopneumoniae.
Controla hasta patologías con 4 dispositivo IDAL® 1
Posibilidad de mezclar con Porcilis® Lawsonia ID y/o aplicarse de forma simultánea con Porcilis® PRRS.




el PDF
l Síndrome Reproductivo y Respiratorio Porcino (PRRS) sigue siendo uno de los principales retos sanitarios de la producción porcina, no solo por su capacidad de comprometer al sistema inmunitario, sino también por su impacto en la reproducción. Aunque el virus (PRRSV) presenta un tropismo restringido hacia los macrófagos, estudios recientes han demostrado que en verracos sexualmente activos también puede infectar células del epitelio genital, favoreciendo su diseminación a través del semen. La posibilidad de que este fenómeno ocurra en animales prepúberes y su relación con las células madre espermatogoniales (SSCs) abre nuevas líneas de investigación para comprender mejor la patogénesis del virus y su papel en la propagación de la enfermedad.
Kassandra DurazoMartínez1,2 , Fernando A. Osorio1,3, Gustavo Delhon3, Jesús Hernández4 e Hiep L. X. Vu1,2
1Centro de Virología de Nebraska, Universidad de Nebraska-Lincoln, EE. UU.
2Departamento de Ciencia Animal, Universidad de Nebraska-Lincoln, EE. UU.
3Facultad de Medicina Veterinaria y Ciencias Biomédicas, Universidad de Nebraska-Lincoln, EE. UU.
4Laboratorio de Inmunología, Centro de Investigación en Alimentación y Desarrollo A.C. (CIAD, A.C.), México

El PRRSV es un virus de ARN monocatenario de sentido positivo, clasificado dentro del orden Nidovirales, familia Arteriviridae y género Betaarterivirus.
Reportado por primera vez en Estados Unidos en 1987 y posteriormente en Europa en 19901,2, el virus se ha propagado a nivel mundial, convirtiéndose en una de las enfermedades infecciosas más devastadoras económicamente en la producción porcina.
En cerdas gestantes suele provocar problemas reproductivos, incluyendo un aumento de abortos y mortinatos3, mientras que en verracos ocasiona una disminución de la fertilidad y de la calidad seminal4.
El virus se caracteriza por una especificidad de hospedador restringida, infectando principalmente macrófagos porcinos.
Una excepción a este tropismo restringido se ha observado en verracos sexualmente activos, donde el virus infecta e induce apoptosis en el epitelio genital7-10, persistiendo en la fracción celular de los eyaculados de animales infectados durante periodos prolongados5
En verracos sexualmente maduros infectados con PRRSV, el virus es transportado a los testículos por macrófagos infectados, lo que conduce a la infección de macrófagos testiculares y células del epitelio germinal.
La infección del tejido testicular por PRRSV provoca6,7:
La formación de células gigantes multinucleadas.
Una marcada depleción de células germinales.
Muerte celular por apoptosis.
Reducción de la calidad del semen.
En el semen de verracos infectados, el genoma de PRRSV se detecta de manera constante en la fracción celular, más que en el plasma seminal, específicamente en células identificadas como macrófagos y células germinales inmaduras7,10


El tropismo testicular del PRRSV se ha observado en múltiples estudios7–9, no obstante, la identificación precisa de las células susceptibles dentro del tejido testicular aún se desconoce. No está claro si el virus utiliza CD163 u otros receptores alternativos para infectar estas células y aún no se ha determinado si puede infectar células testiculares en cerdos jóvenes.
En este estudio, se cultivaron células madre espermatogoniales (SSCs) aisladas de lechones y se demostró su susceptibilidad a la infección por PRRSV. Además, se infectaron machos prepúberes con una cepa virulenta de PRRSV, examinando la distribución de células infectadas en los tejidos testiculares recolectados en varios momentos posteriores a la infección.
En los cerdos prepúberes, las células infectadas por PRRSV se encontraron principalmente en el intersticio y periferia de los túbulos seminíferos, pero no en el centro germinal donde residen las SSCs.
LOS RESULTADOS DE ESTE ESTUDIO APORTAN NUEVOS CONOCIMIENTOS SOBRE EL TROPISMO TESTICULAR DEL PRRSV
Para este estudio se utilizaron células MARC-145, macrófagos alveolares porcinos (PAMs) y células madre espermatogoniales (SSCs) aisladas de lechones recién nacidos.
Las SSCs se obtuvieron a partir de testículos de 1–2 días mediante digestión enzimática y filtración, y posteriormente se enriquecieron en cultivos recubiertos con gelatina y en co-cultivo con células de Sertoli, que actuaron como capa alimentadora.
Su caracterización se realizó mediante la detección de actividad de fosfatasa alcalina y del marcador PGP9.5 utilizando inmunofluorescencia y citometría de flujo.
Las células fueron infectadas con la cepa PRRSV FL1218 a diferentes multiplicidades de infección (MOI 0.1 y 10), evaluándose la replicación viral mediante hibridación in situ (ISH), inmunofluorescencia (IFA) y citometría de flujo, y estableciendo una curva de crecimiento viral de múltiples pasos para comparar la cinética del virus en SSCs, PAMs y MARC-145.
Además, se llevaron a cabo experimentos in vivo en lechones prepúberes de 21 días de edad, libres de PRRSV, que fueron inoculados con la misma cepa viral.
En distintos días postinfección se recogieron testículos para su análisis histológico, detección de ARN viral por ISH e inmunohistoquímica con diferentes marcadores celulares.
SUSCEPTIBILIDAD DE LAS SSCS A LA INFECCIÓN POR PRRSV
Las SSCs fueron recolectadas aproximadamente 14 días después del co-cultivo con células de Sertoli y posteriormente infectadas con la cepa FL12 de PRRSV a una MOI de 0.1 y 10. A las 12 hpi (12 horas post-infección), se detectaron células infectadas por el virus.
Se observaron numerosas células positivas tanto en ISH como en IFA, con un mayor número de células positivas en los cultivos inoculados con una MOI de 10 en comparación con 0.1 MOI (Figuras 1A y 1B).
Para cuantificar la frecuencia de células infectadas por el virus, se tiñeron simultáneamente las células con anticuerpos específicos para la proteína viral N y para el marcador PGP9.5.
A una MOI de 0.1, aproximadamente el 20 % de las células fueron doble-positivas para ambos marcadores, y este patrón aumentó a más del 40 % con una MOI de 10 (Figuras 1C y 1D).
ESTOS HALLAZGOS DEMUESTRAN QUE LAS
SSCS CULTIVADAS EX VIVO SON ALTAMENTE
SUSCEPTIBLES AL PRRSV

GRÁFICA 1
Susceptibilidad de las SSCs a la infección por PRRSV. Las SSCs se cultivaron en suspensión y se inocularon con la cepa FL12 de PRRSV a una MOI de 0,1 o 10. A las 12 hpi, las células se recolectaron y procesaron para ISH con el fin de detectar ARNm viral o para IFA con el fin de detectar la proteína N viral. Las células también se analizaron por citometría de flujo para cuantificar la frecuencia de células infectadas por el virus. (A) Imágenes representativas del ensayo ISH detectando ARNm de PRRSV. El ARNm viral se muestra en marrón y los núcleos celulares se contrastaron con hematoxilina (azul). (B) Imágenes representativas de la IFA detectando la proteína N viral. La proteína N viral se muestra en verde, mientras que los núcleos están teñidos con DAPI (azul). (C) Gráficas representativas de citometría de flujo de SSCs infectadas teñidas con anticuerpos contra la proteína N del PRRSV y el marcador PGP9.5. (D) Frecuencia de células doble positivas para la proteína N del PRRSV y el marcador PGP9.5. Los datos se expresan como la media ± desviación estándar de tres experimentos independientes. Barra de escala: 50 μm. MOI (multiplicidad de infección): relación entre el número de partículas virales y el número de células; ISH (hibridación in situ): técnica para detectar ARNm viral; IFA (ensayo de inmunofluorescencia): técnica para detectar proteínas virales; DAPI: tinción que marca núcleos celulares (azul); PGP9.5: marcador celular utilizado para identificar el tipo de células que están infectadas.


CINÉTICA DE REPLICACIÓN DEL PRRSV EN SSCS
A continuación, se evaluó la cinética de replicación del PRRSV en SSCs y se comparó con la replicación viral en PAMs, la principal célula diana del virus, y en células MARC-145, una línea celular de mono permisiva al virus (Figura 2).
En SSCs, el virus se detectó por primera vez a las 6 hpi, aumentando rápidamente después de las 12 hpi, alcanzando su punto máximo a las 24 hpi y luego disminuyendo gradualmente.
En PAMs, la producción viral alcanzó su máximo a las 12 hpi y comenzó a descender posteriormente.
En las células MARC-145, los títulos virales más altos se observaron a las 48 hpi, seguidos de un ligero descenso a las 72 hpi.
A las 24 hpi, los títulos virales en SSCs y en células MARC-145 fueron similares, mientras que en PAMs fueron más bajos.
A las 36 y 48 hpi, los títulos virales en PAMs fueron significativamente inferiores a los de las células MARC-145.
Aunque los títulos virales en SSCs fueron más altos que en PAMs a las 24, 36 y 48 hpi, estas diferencias no fueron estadísticamente significativas.
SOSTUVIERON LA REPLICACIÓN DEL PRRSV CON UNA CINÉTICA SIMILAR A LA OBSERVADA EN LAS PAMs

FIGURA 2
Curva de crecimiento viral de múltiples pasos. Los datos se expresan como la media ± desviación estándar de tres experimentos independientes. El asterisco (*) indica una diferencia estadísticamente significativa en comparación con los títulos virales en células MARC-145. *P < 0,05.
SSCs
Log(TCID 50 /ml) PAM MARC-145

Horas postinfección
SSCs: células madre espermatogoniales; PAMs: macrófagos alveolares porcinos; MARC-145: línea celular de mono verde africano permisiva a PRRSV; Log(TCID50/mL): logaritmo de la dosis infectiva tisular al 50 % por mililitro.
TROPISMO TESTICULAR DEL PRRSV EN CERDOS PREPÚBERES
Para investigar el tropismo testicular del PRRSV en animales sexualmente inmaduros, se inocularon 12 lechones no castrados de 28 días de edad con la cepa FL12 del PRRSV.
Se detectó ARN genómico viral en sangre en todos los lechones infectados desde el día 1 hasta el día 15 postinfección, lo que confirmó la infección y el éxito de la inoculación.
En diferentes puntos temporales, grupos de tres lechones infectados seleccionados al azar fueron sacrificados, y se recolectaron sus tejidos pulmonares y testiculares para detectar células infectadas mediante ISH.
En cortes de pulmón de los lechones infectados se observaron numerosas células infectadas (Figura 3), lo que confirmó tanto la infección como la especificidad del ensayo ISH.
En los testículos, las células infectadas se encontraron de manera constante en el intersticio desde el día 1 hasta el día 15, aunque la señal disminuyó hacia el final del experimento, en correspondencia con la reducción de la viremia (Figura 3).
Se observaron células infectadas en la periferia de los túbulos seminíferos desde 1 dpi hasta 8 dpi, pero fueron raramente detectadas a los 15 dpi.
Testículos

NO SE DETECTARON CÉLULAS INFECTADAS DENTRO DEL EPITELIO GERMINAL EN NINGÚN MOMENTO, LO QUE INDICA QUE EL VIRUS NO INFECTA AL EPITELIO GERMINAL DE LOS CERDOS PREPÚBERES
FIGURA 3
Localización de células infectadas por PRRSV en pulmón y tejido testicular de cerdos prepúberes. Los cerdos no castrados fueron inoculados por vía intramuscular con la cepa FL12 de PRRSV a una dosis de 1 × 10⁵ TCID₅₀. En los días indicados postinfección (dpi), se recolectaron pulmones y testículos y se procesaron mediante ISH para detectar transcritos de ARNm viral utilizando una sonda específica para ORF7. La tinción marrón indica células infectadas por el virus (flechas), con hematoxilina (azul) utilizada como contratinción. Barra de escala: 50 μm.

Dada la detección de células infectadas por el virus en los testículos, se examinaron los cambios histológicos en el tejido, observándose cambios histológicos leves en los testículos recolectados a los 15 dpi.
En los tres cerdos necropsiados a los 15 dpi, se detectó edema intersticial en todos ellos (Figura 4A), infiltración inflamatoria intersticial focal de células mononucleares en dos cerdos (Figura 4B), y una infiltración intersticial focal de neutrófilos en un cerdo (Figura 4C).
No se detectaron cambios histológicos significativos en las secciones de tejido testicular recolectadas en momentos anteriores, a pesar de la presencia de células infectadas por el virus en dichos tejidos.

FIGURA 4
Tinción H&E de testículos de cerdos prepúberes. (A) Imagen representativa que muestra una sección de testículo normal, no infectado. (B–D) Imágenes que muestran cambios histológicos en los testículos a los 15 días después de la infección con la cepa FL12 de PRRSV. (B) Área con edema intersticial, marcado con un asterisco. (C) Área con infiltración inflamatoria intersticial focal. (D) Área con infiltración intersticial focal de neutrófilos, indicada con flechas. Nótese que no todos los neutrófilos están señalados. Barra de escala: 50 μm.
Para identificar los posibles tipos celulares infectados por PRRSV en los testículos de cerdos prepúberes, se realizó ISH para detectar ARN viral junto con IHC para detectar marcadores celulares específicos.
Se utilizaron los siguientes marcadores para identificar diferentes tipos celulares (Figura 5A):
MIS para células de Sertoli.
Las células positivas para MIS se localizaron dentro de los túbulos seminíferos (Figura 5C), sin co-localizarse con las señales de ARN viral.
ASMA para células mioides.
PGP9.5 para SSCs. CD172a y CD163 para macrófagos.
Célula de Sertoli Sustancia inhibidora de Müller (MIS)
Actina alfa de músculo liso (ASMA)
Célula madre espermatogonial (SSC)
Producto génico proteico(PGP9.5)9.5 Célula mioide
Las señales de ASMA co-localizaron con las señales de ARN viral, lo que indica que las células mioides que rodean los túbulos seminíferos estaban infectadas con PRRSV. Las células positivas para ASMA se detectaron rodeando la membrana basal de los túbulos seminíferos (Figura 5D).
Las células positivas para PGP9.5 se observaron principalmente en el centro de los túbulos seminíferos, separadas de las células infectadas por el virus (Figura 5B).
Las células teñidas positivamente para CD172a y CD163 se encontraron principalmente en el intersticio, algunas de las cuales co-localizaron con las señales de ARN viral (Figuras 5E y 5F).

FIGURA 5
Co-localización de ARNm de PRRSV y marcadores celulares en tejidos testiculares de cerdos prepúberes infectados con PRRSV. (A) Representación esquemática de tejido testicular sexualmente maduro que ilustra la localización celular y los marcadores específicos utilizados para identificarlas. (B–F) Secciones de tejido testicular fueron procesadas inicialmente mediante ISH para detectar transcritos de ARNm viral con una sonda específica para ORF7. Posteriormente, las secciones se tiñeron mediante IHC con anticuerpos específicos para diversos marcadores celulares: PGP9.5 (B), MIS (C), ASMA (D), CD172a (E) y CD163 (F). Las señales de ARNm viral se muestran en marrón, mientras que las señales de los marcadores celulares se muestran en rojo. Las flechas indican células infectadas por el virus. Barra de escala: 50 μm.

Se ha señalado previamente que el PRRSV se replica en el tejido reproductivo de verracos sexualmente activos7-9, lo que conduce disrupción de la espermatogénesis, la depleción de células germinales, la hipospermatogénesis y la formación de células gigantes multinucleadas6,7.
En esos casos, la identificación de células germinales infectadas con PRRSV se basó en la detección de ARN viral dentro de los túbulos seminíferos del tejido testicular7–9
En este estudio, se aislaron y cultivaron SSCs de lechones recién nacidos y se demostró que estas células son susceptibles a la infección por PRRSV. Estos resultados, junto con estudios previos7–9, demuestran claramente la capacidad del PRRSV de infectar células distintas de los macrófagos.
Las SSCs aisladas de lechones recién nacidos y cultivadas ex vivo mostraron una alta susceptibilidad a la infección por PRRSV.
La cinética de replicación viral en SSCs fue similar a la observada en PAMs, su célula diana. Sin embargo, se detectó una diferencia notable en la replicación viral entre SSCs y células MARC-145. Mientras que la replicación del PRRSV en SSCs disminuyó después de las 48 hpi, en las células MARC-145 se mantuvo robusta durante las 72 hpi analizadas.
Esta diferencia podría atribuirse a la naturaleza de los tipos celulares:
MARC-145 es una línea celular establecida que se replica de manera continua.
Las PAMs son células primarias que no se replican in vitro.
Las SSCs son células primarias que requieren células nodrizas para crecer13, las cuales no se incluyeron en los cultivos destinados al análisis de crecimiento viral.
Como resultado, el virus dispone de un mayor número de células susceptibles en las células MARC-145 que en SSCs y PAMs.
POSIBLES RECEPTORES IMPLICADOS EN LA INFECCIÓN
CD163, el principal receptor celular de PRRSV12, se expresa exclusivamente en monocitos/macrófagos14,15.
En el análisis mediante IHC, no se detectaron señales de CD163 en SSCs dentro de los túbulos seminíferos de cerdos prepúberes.
POR PRRSV
Se ha reportado que otras moléculas, como vimentina, CD151, sulfato de heparán, sialoadhesina y DC-SIGN, pueden facilitar la infección por PRRSV11. Sin embargo, si estas moléculas se expresan en SSCs y contribuyen a su susceptibilidad al PRRSV sigue siendo desconocido y representa un área lógica para estudios futuros.
PREPÚBERES VS. ADULTOS: UN CONTRASTE CLAVE
En estudios previos, se ha señalado que la infección de SSCs por PRRSV puede detectarse tan pronto como a los 7 dpi en verracos sexualmente maduros7

En este estudio, no se detectaron células germinales infectadas por PRRSV en los túbulos seminíferos de cerdos prepúberes durante los 15 días de observación.
En su lugar, las células infectadas por el virus se localizaron en el tejido intersticial, probablemente correspondiendo principalmente a macrófagos que transportan PRRSV hacia esta región. Además, se detectaron células mioides infectadas por PRRSV en la periferia de los túbulos seminíferos.
En virus con tropismo testicular, la infección de las células mioides a menudo actúa como una vía para alcanzar otras células dentro de los túbulos seminíferos.

En lechones jóvenes, las SSCs se localizan en el centro de los túbulos seminíferos y están rodeadas por células de Sertoli16 y, a medida que los cerdos alcanzan la madurez sexual, estas células migran hacia la base de los túbulos seminíferos, donde interactúan con células mioides16.
En este estudio se observó que las células mioides en la base de los túbulos son susceptibles a la infección por PRRSV.



Hernández J, Vu HLX. 2025. New insights into the testicular tropism of porcine reproductive and respiratory syndrome virus. Microbiol Spectr 13:e02964-24. https://doi.org/10.1128/ spectrum.02964-24
Durazo-Martínez K, Osorio FA, Delhon G, Hernández J, Vu HLX. 2025. New insights into the testicular tropism of porcine reproductive and respiratory syndrome virus. Microbiol Spectr 13:e02964-24
BIBLIOGRAFÍA
1. Keffaber K. 1989. Reproductive failure of unknown etiology. Am Assoc Swine Pract Newsl 1:1–9. 2.Lindhaus W, Lindhaus B. 1991. Mystery swine disease.
3.Rossow KD. 1998. Porcine reproductive and respiratory syndrome. Vet Pathol 35:1–20. https://doi. org/10.1177/030098589803500101
4.Prieto C, Suárez P, Bautista JM, Sánchez R, Rillo SM, Simarro I, Solana A, Castro JM. 1996. Semen changes in boars after experimental infection with porcine reproductive and respiratory syndrome (PRRS) virus. Theriogenology 45:383–395. https://doi.org/10.1016/0093-691x(95)00375-i
5.Christopher-Hennings J, Nelson EA, Hines RJ, Nelson JK, Swenson SL, Zimmerman JJ, Chase CL, Yaeger MJ, Benfield DA. 1995. Persistence of porcine reproductive and respiratory syndrome virus in serum and semen of adult boars. J Vet Diagn Invest 7:456–464. https://doi. org/10.1177/104063879500700406
6. Prieto C, Castro JM. 2005. Porcine reproductive and respiratory syndrome virus infection in the boar: a review. Theriogenology 63:1–16. https://doi.org/10.1016/j.theriogenology.2004.03.018
7.Sur JH, Doster AR, Christian JS, Galeota JA, Wills RW, Zimmerman JJ, Osorio FA. 1997. Porcine reproductive and respiratory syndrome virus replicates in testicular germ cells, alters spermatogenesis, and induces germ cell death by apoptosis. J Virol 71:9170–9179. https://doi. org/10.1128/JVI.71.12.9170-9179.1997
células de Sertoli cultivadas ex vivo no son susceptibles a la infección por PRRSV, lo que sugiere que podrían actuar como una barrera que previene la exposición de las SSCs al virus:
verracos sexualmente maduros, las SSCs están en contacto directo con células mioides o macrófagos peritubulares, lo que facilita la transmisión del PRRSV a través del contacto célula a célula.
cerdos jóvenes, las SSCs están rodeadas por células de Sertoli no permisivas, lo que las protege de la exposición al PRRSV.
CAMBIO ANATÓMICO
POR QUÉ LAS SSCS EN VERRACOS SEXUALMENTE
MADUROS SE INFECTAN CON PRRSV, MIENTRAS QUE EN CERDOS JÓVENES NO OCURRE
En resumen, se demostró que las SSCs son altamente susceptibles a la infección por PRRSV y se aportó evidencia directa de que células no macrófagos de los cerdos pueden infectarse con PRRSV.
Los cultivos de SSCs pueden servir como modelo para investigar receptores virales alternativos para PRRSV y ofrecer una excelente plataforma para desarrollar un modelo in vitro de alteraciones en la espermatogénesis masculina inducidas por virus.
Este modelo es especialmente adecuado para su integración con los avances en organoides testiculares porcinos17.
8.Han K, Seo HW, Park C, Oh Y, Kang I, Chae C. 2013. Comparative pathogenesis of type 1 (European genotype) and type 2 (North American genotype) porcine reproductive and respiratory syndrome virus in infected boar. Virol J 10:156. https://doi. org/10.1186/1743-422X-10-156
9.Han K, Seo HW, Oh Y, Kang I, Park C, Han JH, Kim SH, Chae C. 2013. Pathogenesis of type 1 (European genotype) porcine reproductive and respiratory syndrome virus in male gonads of infected boar. Vet Res Commun 37:155–162. https://doi.org/10.1007/s11259-013-9558-x
10.Christopher-Hennings J, Nelson EA, Nelson JK, Rossow KD, Shivers JL, Yaeger MJ, Chase CC, Garduno RA, Collins JE, Benfield DA. 1998. Identification of porcine reproductive and respiratory syndrome virus in semen and tissues from vasectomized and nonvasectomized boars. Vet Pathol 35:260–267. https://doi. org/10.1177/030098589803500404
11.Zhang Q, Yoo D. 2015. PRRS virus receptors and their role for pathogenesis. Vet Microbiol 177:229–241. https://doi.org/10.1016/j.vetmic.2015.04.002
12. Calvert JG, Slade DE, Shields SL, Jolie R, Mannan RM, Ankenbauer RG, Welch S-KW. 2007. CD163 expression confers susceptibility to porcine reproductive and respiratory syndrome viruses. J Virol 81:7371–7379. https://doi.org/10.1128/JVI.00513-07
13.Brinster RL, Avarbock MR. 1994. Germline transmission of donor haplotype following spermatogonial transplantation. Proc Natl Acad Sci USA 91:11303–11307. https://doi.org/10.1073/pnas.91.24.11303
14.Pulford K, Micklem K, McCarthy S, Cordell J, Jones M, Mason DY. 1992. A monocyte/macrophage antigen recognized by the four antibodies GHI/61, Ber-MAC3, Ki-M8 and SM4. Immunology 75:588–595.
15.Kristiansen M, Graversen JH, Jacobsen C, Sonne O, Hoffman HJ, Law SK, Moestrup SK. 2001. Identification of the haemoglobin scavenger receptor. Nature 409:198–201. https://doi.org/10.1038/35051594
16. Zheng Y, Gao Q, Li T, Liu R, Cheng Z, Guo M, Xiao J, Wu D, Zeng W. 2022. Sertoli cell and spermatogonial development in pigs. J Anim Sci Biotechnol 13:45. https:// doi.org/10.1186/s40104-022-00687-2
17.Sakib S, Uchida A, Valenzuela-Leon P, Yu Y, Valli-Pulaski H, Orwig K, Ungrin M, Dobrinski I. 2019. Formation of organotypic testicular organoids in microwell culture†. Biol Reprod 100:1648–1660. https://doi.org/10.1093/ biolre/ioz053
18. Truong HM, Lu Z, Kutish GF, Galeota J, Osorio FA, Pattnaik AK. 2004. A highly pathogenic porcine reproductive and respiratory syndrome virus generated from an infectious cDNA clone retains the in vivo virulence and transmissibility properties of the parental virus. Virology 325:308-319



• La protección más temprana incluso antes del período de riesgo en el destete
• Vacuna con línea celular única, autorizada para su uso en lechones desde el primer día de vida, animales de reposición y cerdas
• Protección de larga duración durante la fase de cebo

Descarga el PDF

Carlos Casanovas y David Espigares
Servicio Técnico Porcino, Ceva Salud Animal
Adaptado de Palmai et al., Non-Compromised Efficacy of the First Commercial Ready-to-Use
Genotype 2d Porcine Circovirus Type 2 and Mycoplasma hyopneumoniae Vaccine (2025)
M Mycoplasma hyopneumoniae (Mhyo) y circovirus porcino tipo 2 (PCV2) son dos de los principales agentes que participan en el complejo respiratorio porcino (CRP). La vacunación de lechones frente a ambos agentes está ampliamente extendida y el uso de vacunas monodosis combinadas está en aumento, puesto que simplifica mucho la aplicación.
VAun siendo un virus ADN, PCV2 ha evolucionado de forma importante desde su identificación en la década de los ’90:
Inicialmente el genotipo con mayor prevalencia era PCV2a hasta que, a mediados del 2000, empezó a ser reemplazado por PCV2b.
Hoy en día, el genotipo predominante y clínicamente más relevante es el PCV2d, aunque siguen circulando PCV2a, PCV2b e incluso PCV2d en algunas regiones1.
Con el objetivo de elaborar una vacuna combinada cuya fracción frente a PCV2 esté basada en el genotipo que en la actualidad presenta mayor prevalencia, ha llegado al mercado
CIRBLOC® M Hyo, una vacuna que por primera vez engloba las siguientes características simultáneamente:
1
2
Combinada y ready-to-use.
De subunidades, con la proteína de la cápside de un genotipo PCV2d.
El objetivo del siguiente estudio fue valorar la respuesta de esta nueva vacuna frente a la infección por PCV2d y 2 cepas distintas de Mhyo, realizando además un estudio comparativo con otras vacunas combinadas (RTU) o combinables (RTM) existentes en el mercado.
Las pruebas se realizaron en instalaciones de ensayo con lechones SPF de 18 días de vida, que fueron distribuidos homogéneamente en 7 grupos de 20 lechones.
Vacuna A: Cirbloc® Mhyo
Vacuna B: Hyogen® (solo para el estudio de Mhyo)
Vacuna C: Vacuna RTM
Vacuna D: Vacuna RTU A
Vacuna E: Vacuna RTU B
Vacuna F: Vacuna RTU C
Tratamiento G7: Control desafiado (10 lechones)
Tratamiento G8: Control sin desafío (10 lechones)
Los lechones se vacunaron a las 3 semanas de vida siguiendo las instrucciones de cada producto y se desafiaron a las 8 semanas de edad frente a PCV2d y Mhyo.
Se tomaron muestras periódicamente de suero, swabs rectales y fluidos orales y se realizaron necropsias a las 12 semanas de edad, tomando muestras de linfonodos y pulmón. En los pulmones se realizó una evaluación del nivel de lesiones compatibles con Mhyo.
SEROVONVERSIÓN
El nivel de anticuerpos frente a Mhyo se evaluó en distintas semanas durante el estudio mediante el kit IDVet ID Screen® Mycoplasma hyopneumoniae Competition ELISA.
Las vacunas A, B, D y F mostraron seropositividad 3 semanas postvacunación, indicando una respuesta humoral temprana, siendo las únicas en tener títulos medios por encima del umbral de positividad en el momento del desafío (5 semanas después de la vacunación).
Después del desafío se observó un incremento muy parecido en todos los grupos vacunales. La vacuna E obtuvo los títulos medios más bajos durante todo el estudio, cercano al grupo control no vacunado desafiado.
GRÁFICA 1
Respuesta inmune humoral a la vacunación
Respuesta inmune humoral al desafío
Desafío con Mhyo
(1 postdesafío)semana
Cocientes muestra/positivo (S/P) en el suero de cerdos a lo largo del tiempo utilizando el ELISA de competencia IDVet ID Screen® para M. hyopneumoniae (por debajo de 50 S/P se considera positivo; Estudio A).
En cuanto a sintomatología clínica a nivel respiratorio, no se observó tos a los 42 y 63 días post desafío en ninguno de los grupos vacunados. Tan solo se detectó a los 53 días en los grupos no vacunados.
Todos los animales del grupo control presentaron lesiones pulmonares compatibles con Mhyo en el momento del sacrificio, a las 12 semanas de vida.
Todas las vacunas, excepto la vacuna C, redujeron significativamente estas lesiones. Una mayor seroconversión post vacunación frente a Mhyo no está necesariamente asociada con una eficacia vacunal más elevada. Sin embargo, cuando esta se produce es indicativa de que la vacunación se ha producido y, más importante, de que el sistema inmune está reaccionando frente a la vacuna5
Puntuaciones medias ponderadas de lesiones pulmonares

GRÁFICA 2
Puntuaciones medias ponderadas de lesiones pulmonares. Puntuaciones medias ponderadas de las lesiones pulmonares (PMPL) tras la provocación con Mhyo, tasa de positividad y diagrama de Box y Whisker de las puntuaciones individuales ponderadas de las lesiones pulmonares. (Letras mayúsculas diferentes indican diferencias estadísticamente significativas. *: MWLLS= Puntuación media ponderada de lesión pulmonar por cada grupo, tal como se describe en la Sección 2.5. Mhyo lung lesion scoring).
Con el kit ELISA Ingezim Circo IgG se observó en los animales vacunados con las vacunas A y D una seroconversión más temprana y robusta, a los 21 y 34 días postvacunación.
Usando el Kit ELISA PCV2 BioChek (SK105), los animales vacunados con la vacuna A fueron los más rápidos en seroconvertir, siendo los únicos animales positivos a 21, 34 y 42 días postvacunación, antes del desafío, demostrando así la vacuna A una alta capacidad inmunogénica.
Con el resto de las vacunas solo se detectaron animales positivos después del desafío.
Título mediante ELISA (SK105) del kit de anticuerpos contra Circovirus Porcino Tipo 2 de BioChek
Vacuna A Vacuna C Vacuna D Vacuna E Vacuna F Control positivo Control negativo
Respuesta inmune humoral a la vacunación Respuesta inmune humoral al desafío
Desafío con PCV2d
En el caso del PCV2 hay una asociación más clara entre seroconversión postvacunal y la eficacia vacunal6,7 que en el caso de Mhyo. Sin embargo, hay que tener en cuenta que la seroconversión no es el único indicador de una buena protección frente a PCV2.
Título mediante ELISA Ingezim Circo IgG (11.PCV.K.1)
límite de positividad
antes de la vacunación
Fecha de muestreo
GRÁFICA 3
Títulos séricos de PCV2 en cerdos a lo largo del tiempo utilizando BioChek Porcine Circovirus Type 2 Antibody test kit ELISA (SK105) (un título superior a 1071 se considera positivo; Estudio B).
de la vacunación
Vacuna A Vacuna C Vacuna D Vacuna E Vacuna F Control negativo 21dpi
Desafío con PCV2d Control positivo
Respuesta inmune humoral a la vacunación Respuesta inmune humoral al desafío
dpi (antes del desafío)
Fecha de muestreo
GRÁFICA 4
Títulos séricos de PCV2 en cerdos a lo largo del tiempo utilizando Ingezim Circo IgG (11.PCV.K.1) ELISA (Estudio B).
La reducción de la viremia de PCV2 se considera un parámetro muy relevante para determinar la eficacia vacunal8
Para los distintos tipos de muestra se detectó un pico de carga vírica en torno a las 2-3 semanas post desafío en el grupo control y en algunos grupos vacunales.
Todas las vacunas redujeron la carga de PCV2 en suero, siendo la vacuna A y la vacuna D las únicas en controlar completamente la viremia, tal como muestra el gráfico de área bajo la curva (AUC) de PCV2d (Gráfica 6)
Se tomaron muestras mediante escobillones rectales para evaluar la excreción del virus a través de las heces.
En el grupo control, las cargas de PCV2 fueron incluso más altas en que en sangre, algo que ya ha sido observado en estudios previos9
En general, las vacunas demostraron ser más eficientes en la reducción de viremia que en la reducción de la excreción.
LA VACUNA A LOGRÓ CONTROLAR TANTO LA VIREMIA COMO LA EXCRECIÓN DE FORMA MUY EFECTIVA

antes de la vacunación
21dpi 34 dpi (antes del desafío)
42 dpi (1 semana postdesafío)
49 dpi (2 semanas postdesafío)
63 dpi (4 semanas postdesafío)
Fecha de muestreo
GRÁFICA 5
Carga viral en suero tras el desafío con PCV2 (log10 copias/µL).
GRÁFICA 6
Diagrama de cajas y bigotes de la viremia entre grupos por área bajo la curva (AUC) utilizando un modelo mixto (letras mayúsculas diferentes indican diferencias estadísticamente significativas).
Control positivo Control negativo 34 dpi (antes del desafío)
42 dpi (1 semana postdesafío) 49 dpi (2 semanas postdesafío)
Fecha de muestreo
63 dpi (4 semanas postdesafío) 56 dpi (3 semanas postdesafío)
GRÁFICA 7
Excreción rectal de PCV2 mediante qPCR (log10 copias/µL).
GRÁFICA 8
Diagrama de cajas y bigotes de la excreción rectal entre grupos por área bajo la curva (AUC) utilizando un modelo mixto (letras mayúsculas diferentes indican diferencias estadísticamente significativas).
1spch (1 semana postdesafío)
GRÁFICA 9
Carga viral en muestras de fluido oral recogidas semanalmente tras el desafío con PCV2d (log10 copias/µL) (1 wpc = 1 semana tras la provocación).
En fluidos orales, todas las vacunas redujeron la carga de PCV2d en relación con el control, pero la vacuna A redujo la carga de forma más significativa.
Este resultado, junto al de reducción de carga en heces, demuestra que la vacuna A puede generar una menor presión de infección a nivel ambiental.
Casi todas las vacunas lograron reducir significativamente la carga de PCV2d en tejidos en relación con el grupo control, pero la vacuna A mostró las cargas más bajas.
En nódulos linfáticos mediastínicos la vacuna A obtuvo unos resultados significativamente mejores que con el resto de las vacunas y en nódulos linfáticos mesentéricos e inguinales, superiores a la mayoría de ellas.
En el caso del pulmón, se observó una diferencia numérica entre vacunas, sin llegar a ser estadísticamente significativa.
GRÁFICA 10
Diferencias de excreción entre los grupos por área bajo la curva (AUC) utilizando un modelo mixto en muestras de fluido oral (letras mayúsculas diferentes indican diferencias estadísticamente significativas).


Grupo:
Muestra = Nódulo linfático mediastínico
Muestra = Nódulo linfático mesentérico
Muestra = Nódulo linfático inguinal
Muestra = Pulmón
GRÁFICA 11
Número de copias/µl de PCV2 log10 en las muestras de órganos (nódulos linfáticos mediastínicos, mesentéricos e inguinales y pulmones) recogidas 4 semanas después del desafío (letras mayúsculas diferentes indican diferencias estadísticamente significativas).

En esta prueba, la nueva vacuna combinada ready-to-use frente a PCV2 y Mhyo ha demostrado:
Reducir significativamente los signos clínicos y lesiones de Mhyo.
Lograr una seroconversión temprana frente a ambos antígenos.
Reducir la viremia, excreción oral y fecal de PCV2 por debajo del límite de detección.
Reducir la carga de PCV2 en órganos internos de animales desafiados de forma experimental.
En general, los resultados indican que la vacuna A (Cirbloc® M Hyo) es muy eficaz en el control de ambos agentes, lo que contribuye a combatir el complejo respiratorio porcino, las enfermedades asociadas a Circovirus Porcino tipo 2 y, por tanto, a lograr una mejor salud y productividad de las granjas porcinas.
1. Puig, A.; Bernal, I.; Sabate, D.; Ballara, I.; Montane, J.; Nodar, L.; Angelats, D.; Jorda, R. Comparison of effects of a single dose of MHYOSPHERE(R) PCV ID with three commercial porcine vaccine associations against Mycoplasma hyopneumoniae (Mhyo) and porcine circovirus type 2 (PCV2) on piglet growth during the nursery period under field conditions. Vet. Res. Commun. 2022, 46.
2. Michiels, A.; Arsenakis, I.; Boyen, F.; Krejci, R.; Haesebrouck, F.; Maes, D. Efficacy of one dose vaccination against experimental infection with two Mycoplasma hyopneumoniae strains. BMC Vet. Res. 2017, 13, 274.
3. Cvjetkovic, V.; Sipos, S.; Szabo, I.; Sipos, W. Clinical efficacy of two vaccination strategies against Mycoplasma hyopneumoniae in a pig herd suffering from respiratory disease. Porc. Health Manag. 2018, 4, 19.
4. Krejci, R.; Kalina, J.; Kuncova, M. A Meta-Analysis of the Relationship Between Lung Lesion Scores in Slaughter Pigs and their Daily Weight Gain. Int. Anim. Health J. 2022, 9, 24–28.
5. Sibila, M.; Guevara, G.; Cuadrado, R.; Pleguezuelos, P.; Perez, D.; Perez de Rozas, A.; Huerta, E.; Llorens, A.; Valero, O.; Perez, M.;et al. Comparison of Mycoplasma hyopneumoniae and porcine circovirus 2 commercial vaccines efficacy when applied separate or combined under experimental conditions. Porc. Health Manag. 2020, 6, 11.
6. Fort, M.; Fernandes, L.T.; Nofrarias, M.; Diaz, I.; Sibila, M.; Pujols, J.; Mateu, E.; Segales, J. Development of cell-mediated immunity to porcine circovirus type 2 (PCV2) in caesarean-derived, colostrum-deprived piglets. Vet. Immunol. Immunopathol. 2009, 129, 101–107.
7. Opriessnig, T.; Xiao, C.T.; Halbur, P.G.; Gerber, P.F.; Matzinger, S.R.; Meng, X.J. A commercial porcine circovirus (PCV) type 2a-based vaccine reduces PCV2d viremia and shedding and prevents PCV2d transmission to naive pigs under experimental conditions. Vaccine 2017, 35, 248–254.
8. Olvera, A.; Sibila, M.; Calsamiglia, M.; Segales, J.; Domingo, M. Comparison of porcine circovirus type 2 load in serum quantified by a real time PCR in postweaning multisystemic wasting syndrome and porcine dermatitis and nephropathy syndrome naturally affected pigs. J. Virol. Methods 2004, 117, 75–80.
9. Kiss, I.; Szigeti, K.; Homonnay, Z.G.; Tamas, V.; Smits, H.; Krejci, R. Maternally Derived Antibody Levels Influence on Vaccine Protection against PCV2d Challenge. Animals 2021.






























































Descarga el PDF

LA. Quiles
PHD Universidad de Murcia
estas toxinas pueden alterar la función hormonal, reducir la fertilidad, provocar abortos y comprometer la viabilidad embrionaria. Su presencia, incluso en niveles bajos, afecta la productividad y la eficiencia reproductiva del hato, generando pérdidas económicas significativas y retos de manejo que exigen una vigilancia constante de la calidad del alimento.

Las micotoxinas son metabolitos secundarios tóxicos producidos por determinados hongos, como Aspergillus, Fusarium y Claviceps
Se trata de sustancias policetónicas que se producen cuando se interrumpe la reducción de los grupos cetónicos en la biosíntesis de los ácidos grasos por parte de los hongos al utilizarlos como fuente de energía.
Las afecciones resultantes de la ingestión de estos metabolitos son las denominadas micotoxicosis y los daños derivados de ellas dependen, en gran parte, de:
Las cantidades ingeridas.
La toxicidad de cada molécula.
Los hongos requieren un sustrato (generalmente los cereales) para crecer, multiplicarse y producir toxinas y ciertas condiciones de temperatura y humedad:
Humedad del grano > 13 %.
Humedad relativa del aire > 70 %.
Temperatura > 20 °C.
pH 6-7.
Concentración de oxígeno > 20 %.
MICOTOXICOSIS AGUDA
La presencia de micotoxinas en el alimento puede dar lugar a signos de carácter agudo como:
Anemias.
Coagulación disminuida.
Fragilidad capilar.
Ascitis.
Ictericia.
Diarreas hemorrágicas.
Los hongos pueden crecer en el campo, en los silos de almacenaje e incluso en los propios circuitos de alimentación de las granjas cuando las condiciones de humedad o estancamiento lo facilitan.
MICOTOXICOSIS SUBAGUDA O CRÓNICA
El consumo de cantidades inferiores puede conducir a signos más leves (subagudos o crónicos) que pueden pasar más desapercibidos como:
Menor velocidad de crecimiento.
Peor índice de conversión.
Menor consumo de alimento. Disminución de la eficiencia reproductiva.
EN EL SECTOR PORCINO
Los efectos de las micotoxinas dependen de:
El tipo de micotoxina.
El tiempo de exposición.
La dosis.
La edad del animal.
El sexo o categoría.
El nivel nutricional.
El estado de salud.
Las condiciones ambientales de la granja.
Hay que tener en cuenta que la mera presencia de hongos productores de toxinas en alimentos o materias primas no implica automáticamente toxicidad.
Por otro lado, las materias primas pueden estar infectadas por más de un hongo y cada uno puede producir varias micotoxinas, pudiendo esta combinación causar efectos más adversos que una sola micotoxina debido al valor aditivo o interacción sinérgica de las micotoxinas.
Hasta el momento se han identificado más de 300 micotoxinas. Sin embargo, las micotoxinas que cobran una mayor relevancia en la alimentación porcina y que guardan relación con la reproducción son (Tabla 1):
Zearalenona (ZEN).
Ergotamina.
Tricotecenos (deoxinivalenol -DON- y toxinaT-2).
Aflatoxinas.
Aflatoxinas Lechones
Toxina T-2
Cerdas. Cerdos de cebo
Deoxinivalenol (DON) Cerdas
Ergotamina
Zearalenona (ZEN)
Cerdas. Lechones lactantes
Disminución del crecimiento. Alteración del sistema inmunitario.
Rechazo del alimento. Diarrea. Leucopenia. Úlceras orales. Inmunosupresión.
Rechazo del alimento. Reducción del crecimiento.
Agalaxia. Debilidad de lechones. Mortalidad neonatal.
Necrosis hepática. Hiperplasia del conducto biliar.
Nulíparas. Multíparas. Verracos jóvenes
Aflatoxinas en el pienso y metabolitos (B₁ y M₁) en leche y tejidos.
Úlceras gástricas y orales. Disminución del timo y tejido linfoide. Lesiones histológicas de ulceración. Linfopenia y leucopenia. Análisis del pienso.
Vitamina E y selenio. Aluminosilicatos.
Presencia en hígado y leche (no más de 3 semanas).
Cambio de pienso. Tratamiento para la diarrea y úlceras. Poco probable.
Pérdida de peso. DON ≥ 1 ppm. Cambio de pienso. No.
Inanición en lechones. Necrosis en cola, orejas y pezuñas.
Hiperestrogenismo en nulíparas. Pseudogestación. Anestros. Mortalidad embrionaria. Reducción de la libido. Vulvovaginitis. Hipertrofia del útero. Aumento de la progesterona sérica. Queratinización de la vagina.
Ergoalcaloides en pienso u orina. Lesiones perivasculares.
Evitar el cornezuelo del centeno.
Pequeñas cantidades (poco significativas).
Aumento de la progesterona sérica. Zearalenol (ZON) en pienso. Cambio de pienso. Tratamiento para el prolapso. Administrar 100 mg de PGF₂α a las cerdas con pseudogestación. Se eliminan rápidamente por la orina. Baja probabilidad de residuos.
TABLA 1
Características de las principales micotoxinas que afectan a la reproducción porcina (Osweiler, 2006).
Entre las numerosas micotoxinas identificadas, algunas destacan por su especial relevancia en la reproducción porcina debido a su frecuencia de aparición y a los efectos que provocan sobre la fertilidad, la gestación y la viabilidad de las camadas.
A continuación, se describen las más importantes —zearalenona, ergotamina, tricotecenos y aflatoxinas—, junto con sus mecanismos de acción y las alteraciones clínicas que producen en los distintos grupos de animales.
La zearalenona (ZEN) es una micotoxina producida por Fusarium spp., principalmente F. graminearum, F. culmorum y F. poae. Contamina fundamentalmente los cereales y sus subproductos.
Cuando el nivel de contaminación en el alimento es elevado presenta un aspecto y sabor desagradable que hace reducir bruscamente su consumo, hasta tal punto que el rechazo sirve como factor de alerta.
En cambio, si su presencia en el alimento es baja puede afectar a los parámetros reproductivos, provocando importantes pérdidas económicas al incidir negativamente en el calendario de cubriciones, partos y destetes, lo que disminuye sigilosamente la productividad de la granja.
(Andretta et al., 2008)
El consumo de ZEN tiene un efecto hiperestrogénico en el tracto reproductivo de las cerdas (vulvovaginitis e hipertrofia del útero) (Imagen 1).
La vulvovaginitis, que incluye tumefacción de la vulva, va acompañada de:
Mastitis con alargamiento de los pezones.
Crecimiento desmesurado del útero con ingurgitación de la mucosa genital.
Cérvix abierto.
Metrorragias copiosas.


Otros signos asociados al consumo de ZEN son:
Anestro.
Infertilidad.
Abortos.
Prolapso vaginal y rectal.
Aumento de las reabsorciones embrionarias y muerte fetal.
Fracaso en los programas de inducción de partos con PGF2α.
Mayor incidencia de mortinatos y de lechones con síndrome splay-leg (Imagen 2).

IMAGEN 2
La intoxicación por zearalenona aumenta la incidencia de lechones con síndrome splay-leg.
LAS CERDAS JÓVENES SON MÁS SENSIBLES QUE LAS CERDAS MADURAS (Döll, 2004)
EFECTOS DE LA ZEN
EFECTOS DE LA ZEN
SOBRE EL CICLO ESTRAL
SOBRE EL CICLO ESTRAL
En cerdas nulíparas el consumo de alimentos contaminados con ZEN en dosis relativamente bajas (1,5 a 2 ppm) provoca inflamación de la pared vaginal y vulvar, aumento del útero, atrofia de los ovarios, etc. (Obremski et al., 2003; Kauffold et al., 2005).
Los signos clínicos aparecen a los 3-7 días tras el consumo de la micotoxina y desaparecen a los 14 días tras la retirada de la fuente contaminada (Kordic et al., 1992).
La ZEN puede inducir la aparición de pubertad precoz en torno a los 70 días de edad (Rainy et al., 1990).
En el caso de las cerdas multíparas, la contaminación por ZEN a niveles de 5-10 ppm después del destete provoca una prolongación del intervalo destete-celo, cuya duración es directamente proporcional a la concentración de la micotoxina (Meyer et al.,2000).
Son frecuentes anestros de 50 días o más por la permanencia de cuerpos lúteos en los ovarios (Edwards et al., 1987).
EFECTOS DURANTE LA GESTACIÓN
EFECTOS DURANTE LA GESTACIÓN
Los principales signos asociados a la exposición a ZEN durante la gestación son:
Pseudogestaciones.
Aumento de la mortalidad embrionaria (menor tamaño de camada).
Disminución de la prolificidad y del tamaño de los lechones.
Las cerdas primíparas que reciben alimento contaminado (>2,83,0 ppm ZEN) al principio de la gestación presentan camadas más pequeñas, con aumento de momificaciones.
EFECTOS SOBRE LOS LECHONES
EFECTOS SOBRE LOS LECHONES
Se ha observado un incremento de la mortalidad durante las dos primeras semanas de vida de los lechones procedentes de cerdas que recibieron niveles de 4,8 ppm de ZEN durante la gestación y la lactancia.

Se cree que la ZEN o sus metabolitos (α- y β-zearalenona) afectan a los lechones a través de la leche de cerda (Palyusik et al., 1980).
EFECTOS SOBRE LOS VERRACOS
EFECTOS SOBRE LOS VERRACOS
En el caso de los verracos, los signos más claros y evidentes de exposición a ZEN son:
Inflamación del prepucio.
Pezones alargados.
Prolapso rectal.
Atrofia testicular.
Disminución de la libido.
Pérdida de pelo.
Reducción de la producción y calidad del semen.
Signos de feminización.
También se observa la inhibición temporal de la espermatogénesis, aunque se puede revertir después de la retirada del alimento contaminado.
ERGOTAMINA
El ergotismo es una micotoxicosis causada por el consumo continuado de alimento contaminado por el hongo Claviceps purpurea (cornezuelo del centeno), presente habitualmente en diversas gramíneas (cebada, avena, trigo, centeno, triticale), aunque también pueden participar Claviceps paspalli y Claviceps fusiformis.

La intoxicación se manifiesta tras la ingestión continuada de alcaloides presentes en el hongo (ergotoxina, ergotamina y ergonovina, principalmente).

IMAGEN 3
Agalaxia en cerda lactante con camada reducida por efecto de la ergotamina.
Estos alcaloides provocan:
Agalaxia (Imagen 3).
Camadas pequeñas.
Partos prematuros.
Momificaciones.
Lechones débiles y con bajo peso.
Bajas tasas de crecimiento.
Altos porcentajes de mortalidad neonatal por inanición de leche y calostro.
Repetición de celos.
Metritis y mastitis.
(Barnikol et al., 1982)
Así, con niveles ≥ 0,53 %:
La duración de la gestación se acorta.
La probabilidad de abortos y nacimiento de lechones débiles aumenta.
Se observan marcados signos de agalaxia en cerdas lactantes.
Este efecto sobre la producción de leche es causado por la inhibición de prolactina.
Durante el postparto es frecuente observar endometritis con flujo vaginal y celos irregulares, generalmente infértiles.
A parte de los trastornos reproductivos, la intoxicación por ergotamina puede causar vasoconstricción y daño endotelial que conduce a isquemia y gangrena seca, especialmente en la cola, orejas y pezuñas de los lechones (Imagen 4).

IMAGEN 4
Ergotismo gangrenoso en un lechón. En este caso, la simple retirada del alimento contaminado conduce a una rápida reducción de los signos clínicos.
La sintomatología varía en función de la concentración de alcaloides, duración de la intoxicación y tipo de animal.


IMAGEN 5
Maíz contaminado por Fusarium roseum.
Toxina T-2
La toxina T-2, producida por Fusarium tricinctum, es una de las micotoxinas más tóxicas y se encuentra en el trigo, centeno, maíz y soja.
La intoxicación se caracteriza por múltiples hemorragias en la serosa del hígado, estómago y esófago.
(Rafai et al., 1995)
A nivel reproductivo, la administración de alimentos contaminados (1-2 ppm) en cerdas durante el último tercio de gestación provoca un efecto inhibidor sobre los ovarios (Glavits et al., 1983).
Concentraciones más elevadas de toxina T-2 (12 ppm durante 220 días) ocasionan repetición de celos y camadas pequeñas con bajo peso al nacimiento (Weaver et al., 1978a, b), detectándose metabolitos de toxina T-2 en la leche de las cerdas y en el estómago de los lechones.
Deoxinivalenol
El deoxinivalenol (DON) o vomitoxina es producida principalmente por Fusarium roseum o Fusarium graminearum (Imagen 5).
Los alimentos contaminados con DON se asocian con anorexia y disminución en la absorción del alimento, además de inducir vómitos cuando se consumen niveles muy elevados (Diekman y Green, 1992).
La literatura científica pone de manifiesto que el ácido fusárico (FA) aumenta el efecto de DON (Smith et al., 1997), y conduce a una intoxicación más grave por esta toxina.
El FA generalmente está presente en los cereales, pero también puede proceder de otra fuente como la soja.
Por otra parte, la intoxicación con DON provoca alteraciones del sistema inmunitario (celular y humoral) y trastornos metabólicos en hígado y bazo, con repercusiones a nivel reproductivo debido a la disminución en el desarrollo de ovocitos y embriones (Tiemann y Danicke, 2007; Ranzenigo et al., 2008).
AFLATOXINAS
Las aflatoxinas son producidas principalmente por Aspergillus flavus y Aspergillus parasiticus y están presentes en muchas materias primas de uso frecuente (maíz, cacahuetes, algodón) (Thieu y col., 2008).
Se describen cuatro aflatoxinas, de acuerdo con su fluorescencia a cromatografía:
Azul: Aflatoxinas B₁ y B₂ (AFB₁ y AFB₂)
Verde: Aflatoxinas G₁ y G₂ (AFG₁ y AFG₂)
Un quinto metabolito, aflatoxina M₁ (AFM₁), se detecta en la leche de animales que han ingerido pienso contaminado con AFB₁.
Las intoxicaciones experimentales han demostrado daño en linfocitos y macrófagos en los lechones, provocando un debilitamiento del sistema inmunitario. Por otra parte, las aflatoxinas provocan rechazo del alimento y reducción del crecimiento.
Los signos clínicos de la aflatoxicosis aguda son:
Anorexia.
Signos nerviosos.
Muerte súbita.
(Hale y Wilson, 1979)
En conclusión, las micotoxinas representan una amenaza silenciosa pero constante para la reproducción porcina, ya que su presencia, incluso en concentraciones bajas o combinadas, puede alterar el equilibrio hormonal, reducir la fertilidad y comprometer la viabilidad embrionaria y neonatal, con un impacto directo en la productividad de la granja.
La prevención pasa necesariamente por un control riguroso de las materias primas, una correcta conservación de los piensos y la implementación de estrategias de monitoreo y mitigación que garanticen la seguridad alimentaria. Solo desde una gestión integral y preventiva es posible minimizar las pérdidas y proteger la eficiencia reproductiva del hato.

PM-ES-25-0456
Guillermo Ramis
Departamento de Producción Animal, Facultad de Veterinaria, Universidad de Murcia
l eje intestino-respiratorio revela que la salud digestiva y respiratoria están estrechamente conectadas. Comprender esta relación es clave para explicar fenómenos como el aumento de estreptococia tras la retirada de colistina y para optimizar estrategias preventivas, como la vacunación frente a E. coli, que contribuyen a mejorar la salud y reducir el uso de antibióticos.

EÚltimamente se habla mucho del eje intestino-respiratorio o del eje microbiota-intestino-sistema nervioso. Pero, ¿a qué nos referimos cuando hablamos de esto?
Hemos pasado de considerar los distintos sistemas del cuerpo del cerdo como entes independientes, a comprender definitivamente que están conectados por muy distintas vías.
Por mucho que el sistema digestivo nos parezca que está separado del respiratorio, es imposible olvidar que están conectados por las redes vascular y linfática que permiten el intercambio activo de células y diversas sustancias. Sin ir más lejos, el intercambio gaseoso o el movimiento de nutrientes son una conexión definitiva entre ambos sistemas.
Pero no solo eso…
Hoy sabemos que la microbiota intestinal y la respiratoria están intrínsecamente relacionadas, que algunos elementos de la microbiota respiratoria están presentes ya en el momento del nacimiento y que otros se adquieren posteriormente, incluso por traslocación de la microbiota intestinal, que finalmente alcanza el aparato respiratorio. De hecho, modificaciones en la dieta pueden alterar la microbiota respiratoria.
La relación, además, es bidireccional, como veremos más adelante al hablar de la interacción entre patología respiratoria y digestiva.
En este artículo exploraremos la relación entre la salud de ambos sistemas, que sin duda presentan numerosas conexiones.
IMPACTO DE LA PATOLOGÍA DIGESTIVA EN LA RESPIRATORIA
A Hipócrates de Cos, considerado padre de la medicina, se le atribuye desde hace más de 25 siglos la frase: “Todas las enfermedades comienzan en el intestino” (
), en referencia a que cualquier enfermedad empieza con alguna alteración del aparato digestivo. Esta idea nos sirve de base para comenzar a explicar dichas relaciones.
Tomemos un dato de interés. En 2017 se puso en marcha el programa voluntario REDUCE Colistina, con el objetivo de retirar la colistina de la producción porcina, dado que esta molécula se ha declarado fármaco de último recurso para los humanos. Se hizo de forma muy drástica y rápidamente, llegando a una reducción del 98,88 % del consumo de este antibiótico en 2020.

1
Modelo de traslocación propuesto por Ferrando et al. (2016).
Lo primero que podríamos haber esperado al retirar este fármaco preventivo para la colibacilosis sería una exacerbación de los problemas producidos por Escherichia coli. Sin embargo, no fue así.
El primer problema que detectamos fue un incremento muy notable de los problemas de estreptococia y en el gasto de antibióticos relacionados con esta enfermedad.
¿Qué sentido tiene esto? Tenemos dos enfoques distintos.
El primero se basa en el modelo de traslocación de Ferrando et al. (2016), que postula que la pérdida de integridad intestinal favorece de forma definitiva la traslocación de Streptococcus suis.
Entre los factores que mencionan los autores están:
La debilidad del intestino por el propio destete.
La interacción con otros patógenos entéricos.
Cambios ambientales y dietéticos que induzcan crecimiento bacteriano relacionado con traslocación.
Postulan que la traslocación de S. suis está limitada por:
La presencia de IgA secretoras.
El movimiento peristáltico.
Péptidos antimicrobianos producidos por enterocitos especializados.
Sin embargo, existen otros factores que facilitan la adhesión de S. suis a los enterocitos, como la presencia de α-glucanos presentes en la dieta, y favorecen el crecimiento del patógeno.
La traslocación se produce de forma activa y usando las dos vías posibles: paracelular y transcelular.

El resultado de la pérdida de integridad intestinal provocada por una infección por E. coli podría ser la aparición de estreptococia como efecto colateral, ya que el patógeno puede internalizarse mediante traslocación y alcanzar sus tejidos diana.
IMPACTO DE LA PATOLOGÍA RESPIRATORIA EN LA DIGESTIVA
Esta relación es bidireccional, existiendo evidencias de que ciertas patologías respiratorias influyen en la microbiota e integridad intestinal.
Los resultados de Zhang et al. (2022) sugieren que la inflamación pulmonar causada por la infección por Mycoplasma hyorhinis puede contribuir a la disbiosis de la microbiota y a la disfunción de la barrera intestinal, y la disbiosis de la microbiota intestinal se asocia con la inflamación sistémica y el estado inmunitario intestinal.
2. MODELO DE INMUNOSUPRESIÓN ASO-
2. MODELO DE INMUNOSUPRESIÓN
ASOCIADA A ENFERMEDAD ENTÉRICA
CIADA A ENFERMEDAD
ENTÉRICA
Como contrapeso al modelo de Ferrando, expertos mundiales como Marcelo Gottschalk postula que el hecho de que los animales estén sufriendo una enfermedad producida por E. coli es suficiente para que S. suis aproveche la situación para producir su enfermedad (comunicación personal).
Es decir, el mero hecho de que se produzca una enfermedad entérica es suficiente para que se produzca un cuadro asociado a S. suis por alteración del sistema inmunitario.
CUALQUIERA DE LOS
DOS SUPUESTOS REFUERZA LA RELACIÓN
QUE EXISTE ENTRE LA COLIBACILOSIS Y LA ESTREPTOCOCIA, SEA CUAL SEA LA HIPÓTESIS VERDADERA
Una de las preguntas que surgen es: si S. suis aprovecha la situación de debilidad intestinal para producir su acción patogénica y E. coli es uno de los principales contribuyentes a la enfermedad intestinal, ¿qué efecto tendrá la vacunación frente a E. coli sobre la estreptococia?
Hay varias experiencias al respecto.
EXPERIENCIA EN BÉLGICA: IMPACTO DE LA VACUNACIÓN EN PARÁMETROS PRODUCTIVOS Y USO DE ANTIBIÓTICOS
En un estudio realizado en Bélgica, vacunando por vía oral frente a E. coli en 10 lotes consecutivos, no solo se observó una mejoría en los parámetros productivos —con una ganancia media diaria (GMD) significativamente mayor en los animales vacunados (375 g ± 15 g frente a 336 g ± 6 g) y un índice de conversión del pienso (IC) significativamente menor (1,61 kg ± 0,02 kg vs. 1,67 kg ± 0,02 kg de pienso por kg repuesto)—, sino que también se registró una reducción significativa en el uso general de antibióticos.
El uso de antimicrobianos, expresado como el número de días de tratamiento por cada 100 días en transición, fue significativamente mayor en el grupo control (69,43 ± 9,44 días) en comparación con en el grupo tratado con la vacuna (0,13 ± 0,13 días), lo que supuso una reducción de casi el 98 %.
La prevalencia de signos clínicos relacionados con S. suis — principalmente signos nerviosos, evaluados por el veterinario— se redujo de forma muy significativa y, entre los antibióticos utilizados, la amoxicilina mostró una disminución del 91,5 % (Vangroenweghe y Boone, 2022).
EXPERIENCIAS EN ESPAÑA: REDUCCIÓN DE ANTIBIÓTICOS Y CONTROL DE ESTREPTOCOCIA
En España se dispone de la experiencia en dos granjas con 900 y 550 cerdas, en las que se observaba diarrea a los 7 días posdestete (Sevilla, 2018). Se decidió vacunar frente a E. coli con Coliprotec® F4/F18 con un doble objetivo:
Reducir la prevalencia de colibacilosis.
Reducir el uso de antibióticos.
La segunda experiencia se llevó a cabo tras los buenos resultados de la primera, con el fin de comprobar la repetibilidad del estudio.
En la primera granja no se observaron diferencias en la mortalidad, pero sí una reducción del 99,7 % en el uso de antibióticos frente a colibacilosis y, de forma colateral, una disminución del 51 % en los antibióticos destinados al control de S. suis.
La conclusión de ambas experiencias españolas es que, controlando la diarrea posdestete asociada a E. coli mediante vacunación, se obtiene una reducción colateral de otras enfermedades como la estreptococia.
QUE OCURRE EN EL RESTO DEL ORGANISMO 1 2
En la segunda granja, además de síntomas de colibacilosis, había clínica de estreptococia y se utilizaban antibióticos para el control de ambas enfermedades antes de la vacunación.
Nuevamente, no se registraron diferencias en la mortalidad, pero la reducción del uso de antibióticos fue del 99 % para los destinados al control de diarrea y del 50 % para los empleados en el control de estreptococia.
Empezamos a ser muy conscientes de la interrelación existente entre la salud intestinal y la salud respiratoria o sistémica.
Hablamos del eje intestinopulmón o el eje microbiotaintestino-cerebro sabiendo que no podemos seguir considerando los distintos sistemas como entidades aisladas porque esto no funciona así.
CADA VEZ SOMOS
CONSCIENTES DE QUE
LO QUE OCURRE EN EL INTESTINO INFLUYE
DEFINITIVAMENTE EN LO
Uno de los mejores ejemplos es la relación entre E. coli y S. suis, evidenciada por la exacerbación de las estreptococias cuando tenemos mala salud relacionada con E. coli.
Esto nos aporta, al menos, una oportunidad de prevenir los efectos de las estreptococias, sobre todo el uso de antibióticos para la prevención de esta enfermedad.
Mediante la vacunación frente a E. coli podemos estar previniendo dos patologías y ayudando a reducir de forma muy significativa el uso de antibióticos. No olvidemos que este es un objetivo de oro en el marco de One Health.

BIBLIOGRAFÍA
Ferrando ML, Schultsz C. A hypothetical model of host-pathogen interaction of Streptococcus suis in the gastro-intestinal tract. Gut Microbes. 2016;7(2):154-62. doi: 10.1080/19490976.2016.1144008. PMID: 26900998; PMCID: PMC4856463.
Vangroenweghe, F.A.C.J.; Boone, M. Vaccination with an Escherichia coli F4/F18 Vaccine Improves Piglet Performance Combined with a Reduction in Antimicrobial Use and Secondary Infections Due to Streptococcus suis. Animals 2022, 12, 2231. https:// doi.org/10.3390/ ani12172231
Zhang Y, Gan Y, Wang J, Feng Z, Zhong Z, Bao H, Xiong Q, Wang R. Dysbiosis of Gut Microbiota and Intestinal Barrier Dysfunction in Pigs with Pulmonary Inflammation Induced by Mycoplasma hyorhinis Infection. ASM Journals. 2022; 7(4). https://doi.org/10.1128/msystems.00282-22.

Protege a los cerdos de forma sostenible con Coliprotec®, la única vacuna viva oral contra el E.coli posdestete disponible en el mercado que ha demostrado reducir la mortalidad y el uso de antibióticos en los nuevos estándares productivos sin óxido de zinc
Para acompañarte en este importante reto y que transiciones de manera efectiva, Elanco dispone de servicios de diagnóstico y de apoyo a la vacunación para que estés seguro de que tus lechones son destetados con la protección que necesitan.
1.Vangroenweghe F. Improved piglet performance and reduced mortality and antimicrobial use following oral vaccination with a live non-pathogenic Escherichia coli against post-weaning diarrhoea. 2021. Austin Journal of Infectious Disease, 8(2): 1048-1051.

Para más información sobre Coliprotec® F4/F18 liofilizado para suspensión oral para porcino, ver ficha técnica
EN CASO DE DUDA, CONSULTA CON TU VETERINARIO
Descarga el PDF


LLMVZ/PhD Laura Batista Batista
& Asociados
a edición génica está revolucionando la producción porcina a nivel internacional, con aplicaciones que van desde la mejora de la resistencia a enfermedades hasta la optimización del crecimiento y el uso de los animales en investigación biomédica. Este artículo ofrece una visión de los avances más destacados y su potencial para transformar el futuro del sector.

En el pasado, los métodos tradicionales para la mejora productiva de los cerdos, como la valoración visual —que evalúa a los animales en función de su apariencia— y la selección genómica —que emplea marcadores genéticos para identificar genes relacionados con rasgos como el crecimiento, el tamaño de la camada y la eficiencia alimenticia—, han permitido el desarrollo de diversas razas de alto valor productivo con elevado rendimiento reproductivo y excelentes características de calidad de canal, a las que se suman actualmente líneas más tolerantes y/o resilientes frente a determinadas enfermedades, retos de manejo y factores medioambientales. Sin embargo, estos métodos son lentos y no siempre exitosos.
En este contexto, el rápido desarrollo de la biotecnología ha permitido importantes avances en diferentes ámbitos, entre ellos, la medicina y la producción agropecuaria.
Estas metodologías permiten modificar parte del genoma de un ser vivo ya sea una bacteria, un virus, una planta o un animal— con el fin de mejorar, inhibir o alterar algunas de sus características, dando lugar a un organismo transgénico o a uno editado genéticamente.
ORGANISMOS TRANSGÉNICOS VS ORGANISMOS EDITADOS
GENÉTICAMENTE: UNA DISTINCIÓN CLAVE
Antes de continuar, es importante aclarar la diferencia entre ambos conceptos, ya que no significan lo mismo:
Un organismo transgénico es aquel al que se le ha añadido un gen externo.
Un organismo editado genéticamente es aquel cuya secuencia genética ha sido modificada, ya sea eliminando un gen o alterándolo para inhibirlo, potenciar su función o cambiarla, pero sin incorporar genes externos. Es

El primer animal transgénico se obtuvo en 1980, cuando el Dr. Jon W. Gordon y sus colaboradores de la Universidad de Yale demostraron que un embrión de ratón en fase unicelular podía incorporar material genético exógeno en sus cromosomas.
Paralelamente, otro grupo de investigadores descubrió ciertas proteínas responsables de que el virus del Síndrome Reproductivo y Respiratorio Porcino (vPRRS) pudiera acceder e infectar los pulmones de los cerdos.
Fue entonces cuando el Dr. Rowland y sus colaboradores plantearon la hipótesis de que la entrada eficiente del virus depende de su interacción con receptores celulares, en este caso el CD163, un receptor eliminador rico en cisteína presente en los macrófagos alveolares porcinos (MAP).
NUMEROSOS ESTUDIOS HAN CONFIRMADO DESDE ENTONCES LA FUNCIÓN ESENCIAL DEL CD163 EN LA INFECCIÓN POR EL VPRRS
OBJETIVOS ACTUALES DE LA EDICIÓN GÉNICA EN PORCINO
Actualmente, las investigaciones de edición génica en la especie porcina tienen cuatro objetivos principales:
EJEMPLO CLAVE: RESISTENCIA AL PRRS
En el sector porcino, el PRRS representa una de las infecciones más costosas en todos los países donde está presente. Por ello, el desarrollo de cerdos resistentes al PRRS representa un avance de gran relevancia, pudiendo resumirse sus beneficios en:
Mayor bienestar animal.
Mayor productividad a un menor coste.
Suministro constante de proteína inocua y de alto contenido proteico a la cadena alimenticia mundial.


FIGURA 1
Visión general de la edición del genoma en el cerdo. Se ilustran dos formas de generar animales editados: la microinyección de nucleasas diseñadas (ZFN, TALEN, CRISPR) en embriones y la transferencia nuclear de células somáticas (SCNT) tras su edición en cultivo mediante las mismas nucleasas. En ambos casos, las nucleasas inducen una rotura de doble cadena (DSB) en el ADN en el sitio objetivo, cuya reparación puede seguir dos vías: NHEJ (Non-Homologous End Joining o unión de extremos no homólogos), que introduce inserciones o deleciones y permite generar un knock-out, o HDR (Homology-Directed Repair o reparación dirigida por homología), que utiliza una plantilla homóloga externa para insertar secuencias específicas y obtener un knock-in. Los embriones resultantes, ya sean inyectados o reconstruidos, se implantan en una cerda receptora, dando lugar al nacimiento de cerdos modificados genéticamente (Fuente: Yang H y Wu Z(2018)GenomeEditingofPigsfor Agriculture and Biomedicine. Front. Genet. 9:360. doi: 10.3389/fgene.2018.00360).
Esta tecnología comenzó a aplicarse en la especie porcina hace más de 20 años, a raíz de una investigación realizada en la Universidad de Missouri por el Dr. Bob Rowland y su equipo.
En aquel estudio publicaron un artículo sobre la eliminación de una proteína mediante edición génica en cerdos, con el objetivo de que sus órganos pudieran emplearse para trasplantes en humanos.
CRISPR-Cas9: Clustered Regularly Interspaced Short Palindromic Repeats –CRISPR associated protein 9 (Repeticiones Palindrómicas Cortas Agrupadas y Regularmente Interespaciadas –proteína asociada 9).
TALEN: Transcription ActivatorLike Effector Nucleases (Nucleasas con efectores similares a activadores de la transcripción).
Estas tecnologías permiten añadir, eliminar o modificar material genético en regiones específicas del genoma.

ZFN: Zinc Finger Nucleases (Nucleasas de dedos de zinc).
Nucleasas diseñadas
Transfección celular
Edición del genoma
ADN

Inserción/ Delección Formación de DSB
NHEJ HDR

Inyección del embrión






Corte por nucleasa diseñada




Plantilla homóloga
Lnock-out Knock-in
Cerda receptora



Cerdos modificados genéticamente
El sistema CRISPR-Cas9 ha despertado gran entusiasmo en la comunidad científica, ya que es más rápido, económico, preciso y eficiente métodos de edición del genoma.
Gracias a ello, ha tenido un impacto decisivo en la investigación porcina, al posibilitar la obtención de razas de cerdos resistentes a diferentes enfermedades.
La tecnología CRISPR-Cas9 se emplea en cerdos como herramienta en la investigación biomédica, tanto para modelar enfermedades humanas para avanzar en el desarrollo de órganos destinados a trasplantes.
La tecnología CRISPR-Cas9 se adaptó a partir de un de edición del genoma que las bacterias utilizan como mecanismo de defensa inmunitaria.
Cuando se infectan con un virus, estas capturan pequeños fragmentos de ADN del invasor y los incorporan a su propio genoma en un patrón específico, formando segmentos conocidos como arreglos CRISPR.
Los arreglos CRISPR permiten que las bacterias “recuerden” a los virus, a otros estrechamente relacionados y, si estos vuelven a atacar, producen segmentos de ARN a partir de dichos arreglos para reconocer y unirse a regiones específicas del ADN viral.

A continuación, utilizan la enzima Cas9 —u otra similar— para cortar ese ADN y desactivar al virus.
Los investigadores adaptaron este mecanismo de defensa inmunitaria para aplicarlo a la edición del ADN (Figura 2), creando una pequeña molécula de ARN con una secuencia “guía” corta que se une de forma específica a una secuencia objetivo del ADN de una célula, de manera similar a los segmentos de ARN que las bacterias producen a partir de los arreglos CRISPR.
Secuencia genómica coincidente
ADN
Eliminación de un gen
proceso natural observado en las bacterias. Aunque Cas9 es la enzima más utilizada, también pueden emplearse otras, como Cpf1.
Tras el corte del ADN, los investigadores aprovechan la propia maquinaria de reparación celular para añadir o eliminar fragmentos de material genético, o bien para sustituir un segmento existente por una secuencia personalizada.
ADN guía
Cas9
Inserción de un gen
El gen queda interrumpido El gen tiene una nueva secuencia
FIGURA 2
Representación esquemática del sistema CRISPR-Cas9. El ARN guía dirige a la enzima Cas9 hacia la secuencia específica de ADN donde se realiza el corte. A partir de ahí, es posible eliminar un gen, lo que interrumpe su función, o insertar un nuevo fragmento de ADN para modificar la secuencia original.


APLICACIONES ACTUALES DE LA TECNOLOGÍA CRISPR-CAS9 EN PORCINO
La tecnología CRISPR-Cas9 se ha utilizado y refinado en porcino para distintas aplicaciones, que van desde la resistencia a enfermedades hasta la mejora del crecimiento y la investigación biomédica:
Síndrome Reproductivo y Respiratorio Porcino (PRRS): la tecnología CRISPR-Cas9 se ha empleado para desactivar el receptor CD163 presente en las células de los cerdos, utilizado por ambos genotipos del virus del PRRS para penetrar en los macrófagos e iniciar la infección.
Peste Porcina Africana (PPA): los investigadores trabajan en el uso de la tecnología CRISPR-Cas9 para introducir una variación en el gen RELA con el objetivo de aumentar la resistencia de los cerdos frente a esta enfermedad.
Infecciones por Coronavirus: la tecnología CRISPR-Cas9 se ha utilizado para editar un receptor del virus de la gastroenteritis transmisible (TGEV), con el fin de limitar su capacidad de infectar a los cerdos.
Retrovirus Endógeno Porcino (PERV): la tecnología CRISPRCas9 se ha utilizado para inactivar el PERV presente en el genoma porcino, reduciendo así el riesgo de transmisión viral en caso de trasplantes de órganos a humanos.
Crecimiento muscular (miostatina porcina, MSTN): mediante CRISPR-Cas9 se ha logrado alterar el gen MSTN (gen de la miostatina) que regula el desarrollo muscular, con el objetivo de mejorar el crecimiento y aumentar la masa magra en los cerdos.
El desarrollo de la edición génica no está exento de limitaciones y plantea actualmente diversos retos científicos, técnicos y éticos.
1Métodos efectivos para transferir la tecnología: uno de los principales obstáculos es encontrar formas seguras y eficientes de administrar la maquinaria de edición de genes directamente en las células objetivo dentro del organismo. Aunque suelen emplearse vectores virales, estos pueden desencadenar respuestas indeseadas.
Respuesta inmunitaria: el sistema inmunitario puede reconocer los componentes de edición genética como elementos extraños y atacarlos, reduciendo la eficacia de la terapia.
Mezcla o mosaicismo: existe la posibilidad de que no todas las células de un tejido sean editadas con éxito, lo que genera una combinación de células modificadas y no modificadas que compromete el resultado final.
4 5 6
Consideraciones éticas: es necesario reflexionar sobre cómo debe o no utilizarse esta tecnología y quién debería tener acceso a ella.
Consecuencias imprevistas: aún no se conocen completamente todas las implicaciones de los cambios genéticos. Incluso
Mirando hacia el futuro, la edición genómica basada en nucleasas tiene el potencial de revolucionar al sector porcino a través de la producción de cerdos modificados genéticamente, ampliando sus aplicaciones en distintos ámbitos de investigación.
Al mismo tiempo, el proceso regulatorio se encuentra en plena transición a nivel mundial, tanto para los productos destinados al consumo local como para aquellos orientados a los mercados de exportación.
La mayoría de los consumidores no están familiarizados con la edición génica y, entre quienes sí lo están, persisten ciertas dudas o preocupaciones sobre su uso en productos porcinos.
No obstante, la aceptación por parte de los consumidores podría evolucionar a medida que aumente la educación y la comprensión de los beneficios que aporta su aplicación en los sistemas de producción, especialmente cuando los productos estén disponibles de forma comercial.
En el caso de los ingredientes elaborados mediante biotecnología, un estudio de McKinsey y col. (2024) señaló que la mayoría de los consumidores estaban dispuestos a probar alimentos y bebidas percibidos como más saludables, de mejor o igual sabor y más sostenibles que las opciones tradicionales.

El tiempo dirá…







Dale a tus lechones un gran inicio para un mejor futuro. Protégelos del rotavirus porcino. Y tú, ¿proteges su vida?
Única vacuna viva atenuada registrada en España para el control de Rotavirus porcino.