Atlas de Anatomia Aplicada à Cirurgia da Malformação
Ar teriovenosa Cerebral
Feres Chaddad Neto
Marcos Devanir Silva da Costa
Com Vídeos



Feres Chaddad Neto
Marcos Devanir Silva da Costa



Professor Associado Livre-Docente do Depar tamento de Neurologia e Neurocirurgia da Escola Paulista de Medicina da Univer sidade Federal de São Paulo (EPM-Unifesp)
Orientador do Programa de Pós- Graduação em Neurologia e Neurociência da Unifesp
Chefe do Setor de Neurocirurgia Vascular do Hospital São Paulo da Unifesp
Chefe do Setor de Neurocirurgia do Hospital Beneficência
Portuguesa de São Paulo
Coordenador do Programa de Especialização e Aper feiçoamento em Neurocirurgia Vascular da Unifesp
Coordenador do Programa de Especialização em Pesquisa em Neurocirurgia Vascular da Unifesp
Coordenador do Laboratório de Anatomia
Microneurocirúrgica da Unifesp
Editor Associado da revista Frontier s in Neurology–Seção
Neurocirurgia

Professor Afiliado do Depar tamento de Neurologia e Neurocirurgia da Univer sidade Federal de São Paulo (Unifesp)
Orientador do Programa de Pós- Graduação em Neurologia e Neurociência da Unifesp
Neurocirurgião Pediátrico do Instituto de Oncologia Pediátrica
(IOP- GR AACC-Unifesp)
Pesquisador do Instituto Nacional de Ciência e Tecnologia em Biologia do Câncer Infantil e Oncologia Pediátrica
(INCT BioOncoPed –Brasil)
Neurocirurgião do Serviço de Neurocirurgia Perinatal do Hospital e Maternidade Santa Joana Pró-Matre Paulista –Mestrado, Doutorado e Pós-Doutorado pela Escola Paulista de Medicina da Unifesp (EPM-Unifesp)
Feres Chaddad Neto
Marcos Devanir Silva da Cost
T hieme
Rio de Janeiro• St ut tgar t• New York •Delhi
Dados Internacionais de Catalogação na Publicação (CIP) (eDOC BRASIL, Belo Horizonte/MG)
C432a
Chaddad Neto, Feres. Atlas de anatomia aplicada à cirurgia da malformação arteriovenosa cerebral/Feres Chaddad Neto, Marcos Devanir Silva da Costa. –1. ed. – Rio de Janeiro, RJ: Thieme Revinter Publicações, 2026.
il. color. ; 23 x 31,4 cm.
Inclui bibliografia.
ISBN 978-65-5572-376-2
eISBN 978-65-5572-377-9
1. Neurocirurgia. 2. Neurologia. 3. Malformação arteriovenosa cerebral – Cirurgia. 4. Anatomia aplicada. I. Costa, Marcos Devanir Silva da. II. Título.
CDD 617.48
Elaborado por Maurício Amormino Júnior – CRB6/2422
Contato com o autor: Marcos Devanir Silva da Costa marcoscostaneuro@gmail.com
© 2026 Thieme. All rights reserved.
Thieme Revinter Publicações Ltda. Rua do Matoso, 170 Rio de Janeiro, RJ CEP 20270-135, Brasil http://www.thieme.com.br
Thieme USA http://www.thieme.com
Design de Capa: © Thieme Impresso no Brasil por Forma Certa Gráfica Digital Ltda. 5 4 3 2 1
ISBN 978-65-5572-376-2
Também disponível como eBook: eISBN 978-65-5572-377-9
Nota: O conhecimento médico está em constante evolução. À medida que a pesquisa e a experiência clínica ampliam o nosso saber, pode ser necessário alterar os métodos de tratamento e medicação. Os autores e editores deste material consultaram fontes tidas como confiáveis, a fim de fornecer informações completas e de acordo com os padrões aceitos no momento da publicação. No entanto, em vista da possibilidade de erro humano por parte dos autores, dos editores ou da casa editorial que traz à luz este trabalho, ou ainda de alterações no conhecimento médico, nem os autores, nem os editores, nem a casa editorial, nem qualquer outra parte que se tenha envolvido na elaboração deste material garantem que as informações aqui contidas sejam totalmente precisas ou completas; tampouco se responsabilizam por quaisquer erros ou omissões ou pelos resultados obtidos em consequência do uso de tais informações. É aconselhável que os leitores confirmem em outras fontes as informações aqui contidas. Sugere-se, por exemplo, que verifiquem a bula de cada medicamento que pretendam administrar, a fim de certificar-se de que as informações contidas nesta publicação são precisas e de que não houve mudanças na dose recomendada ou nas contraindicações. Esta recomendação é especialmente importante no caso de medicamentos novos ou pouco utilizados. Alguns dos nomes de produtos, patentes e design a que nos referimos neste livro são, na verdade, marcas registradas ou nomes protegidos pela legislação referente à propriedade intelectual, ainda que nem sempre o texto faça menção específica a esse fato. Portanto, a ocorrência de um nome sem a designação de sua propriedade não deve ser interpretada como uma indicação, por parte da editora, de que ele se encontra em domínio público.
Todos os direitos reservados. Nenhuma parte desta publicação poderá ser reproduzida ou transmitida por nenhum meio, impresso, eletrônico ou mecânico, incluindo fotocópia, gravação ou qualquer outro tipo de sistema de armazenamento e transmissão de informação, sem prévia autorização por escrito.
Dedico este atlas às famílias e aos pacientes que, com coragem e esperança, confiaram suas vidas — e as de seus filhos e filhas — em nossas mãos.
Vocês estão presentes não apenas nas páginas deste livro, mas em sua essência. São a razão e a inspiração para que sigamos buscando o equilíbrio entre o gesto preciso e o cuidado humano, entre a técnica refinada e o respeito absoluto à vida.
Aos que enxergam na Neurocirurgia uma das mais nobres formas de servir, aprender e amar.
Marcos Devanir Silva da Costa
Dedico este atlas aos jovens neurocirurgiões em formação, aqueles que carregam no olhar a inquietude do aprendizado e nas mãos o potencial de transformar vidas.
Às equipes que caminham conosco no centro cirúrgico, na pesquisa e no ensino, meu reconhecimento pelo compromisso diário com a excelência e a ética.
A Neurocirurgia é mais do que uma especialidade, é uma jornada de precisão, responsabilidade e humildade diante da complexidade humana.
Que este atlas contribua para o desenvolvimento de profissionais capazes de unir conhecimento técnico, respeito à ciência e paixão pela missão de cuidar.
Feres Chaddad Neto
ADeus, pela dádiva da vida e pela oportunidade de servir por meio do conhecimento.
À minha esposa, Vanessa, e aos meus filhos, Augusto, Julia e Vitor, por serem meu porto seguro, minha inspiração diária e razão constante de alegria.
Aos meus pais, Devanir (in memoriam) e Eponina, e a toda minha família, que sempre me incentivaram a buscar o melhor de mim, mesmo diante dos maiores desafios.
Aos mestres e mentores que marcaram minha formação, em especial aos Professores Sérgio Cavalheiro e Feres Chaddad-Neto, cuja dedicação à Neurocirurgia e generosidade intelectual sempre me serviram — e continuam servindo — como farol.
Aos alunos, residentes e fellows, que nos desafiam a romper os limites do conhecimento e renovam, a cada geração, o compromisso com a excelência.
A todos aqueles que reconhecem na Neurocirurgia uma das mais nobres formas de expressão da arte.
Marcos Devanir Silva da Costa
Agradeço, em primeiro lugar, a Deus por me conceder a inspiração, a firmeza das mãos e a clareza mental que tornam possível o exercício da Neurocirurgia. É Ele quem me permite unir técnica e empatia, ciência e intuição, em cada decisão e movimento dentro do centro cirúrgico.
À minha esposa, Patrícia, e à minha filha, Marina, pelo suporte contínuo e pela compreensão diante das exigências inerentes à vida acadêmica e à prática neurocirúrgica. Sua presença discreta e constante foi essencial para a realização deste trabalho.
Ao Prof. Dr. Evandro de Oliveira, referência incontornável da Neurocirurgia brasileira e internacional, manifesto minha profunda gratidão. Foi por meio de sua visão, de sua maestria técnica e de sua incansável dedicação ao ensino que compreendi que a neurocirurgia é muito mais do que um conjunto de procedimentos, é uma verdadeira obra de arte. Seu exemplo moldou, de maneira definitiva, minha formação e minha atuação profissional.
Aos colegas do Departamento de Neurologia e Neurocirurgia da Escola Paulista de Medicina – Unifesp, aos residentes, fellows e colaboradores que compartilham o compromisso com a qualidade na formação médica, na produção de conhecimento e no cuidado aos pacientes.
Este atlas é fruto de um esforço coletivo que valoriza o rigor técnico, a transmissão de conhecimento e o contínuo aperfeiçoamento da prática neurocirúrgica.
Feres Chaddad Neto
ANeurocirurgia moderna demanda mais do que habilidade técnica: exige uma compreensão profunda da anatomia tridimensional e a capacidade de transformar esse conhecimento em decisões cirúrgicas seguras e eficazes. Entre as afecções neurocirúrgicas, a malformação arteriovenosa (MAV) representa um dos maiores desafios, por sua complexidade hemodinâmica, imprevisibilidade clínica e risco operatório elevado.
Este Atlas de Anatomia Aplicada à Cirurgia da Malformação Arteriovenosa Cerebral nasce da convicção de que é possível — e necessário — unir a precisão da anatomia microneurocirúrgica ao raciocínio tático da prática operatória. Esta obra não se propõe apenas a ilustrar estruturas ou descrever abordagens, ela busca ensinar como pensar a MAV, como reconhecê-la em suas nuances anatômicas e como agir frente a ela com clareza cirúrgica.
A inovação deste livro reside exatamente nessa integração: anatomia, imagem e cirurgia encontram-se em um plano comum, orientado pela prática. A partir de dissecções anatômicas, fotografias operatórias, exames de imagem (ressonância, tomografia, angiografia digital, tractografia), vídeos de cirurgias reais, monitorização neurofisiológica e neuronavegação, o leitor é conduzido a uma jornada que transcende o saber estático e o transforma em conhecimento aplicável à realidade do centro cirúrgico.
Trata-se de um atlas para os que buscam ir além dos limites da descrição anatômica. É um guia para aqueles que desejam compreender, com profundidade, como a anatomia se converte em estratégia, e como a precisão se torna proteção ao cérebro, transformando a cirurgia numa obra de arte.
Esperamos que esta obra contribua para a formação de neurocirurgiões mais preparados, conscientes e tecnicamente refinados — não apenas na abordagem das MAVs, mas em toda a Neurocirurgia.
Marcos Devanir Silva da Costa Feres Chaddad Neto
ÁDRIA MARIA SIMÕES S. DE MENDONÇA
Médica Neurocirurgiã pelo Hospital Federal do Andaraí, RJ
Fellowship em Neurocirurgia Vascular pela Universidade Federal de São Paulo (Unifesp)
Fellowship em Neurocirurgia Oncológica pelo Instituto Nacional de Câncer (INCA)
Doutoranda em Neurociências na Unifesp
ALEJANDRO BENJAMIN ROMERO LEGUINA
Médico Neurocirurgião pelo Hospital Ángel Cruz Padilla – San Miguel de Tucumán, Argentina
Fellowship em Neurocirurgia Vascular pela Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp)
Fellowship em Pesquisa Clínica em Neurocirurgia Vascular pela EPMUnifesp
Doutorando em Neurologia e Neurociências pela EPM-Unifesp
ALVARO QUIÑONES
Médico Neurocirurgião pelo Hospital de Clínicas UniversitárioUniversidad Mayor de San Andrés (UMSA) – La Paz, Bolívia Fellowship em Neurocirurgia Vascular pela Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp) Neurocirurgião Vascular do Hospital de Clínicas Universitário – La Paz, Bolívia
ERICA ANTUNES EFFGEN
Médica Neurocirurgiã pela Faculdade de Medicina de São José do Rio Preto (FAMERP)
Fellowship em Neurocirurgia Vascular pela Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp)
Doutoranda em Neurologia e Neurociências pela EPM-Unifesp
ÉRICO SAMUEL GOMES GALVÃO DA TRINDADE
Médico Neurocirurgião pela Universidade Federal do Paraná (UFPR) Fellowship em Neurocirurgia Vascular pela Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp) Doutorado em Andamento pela EPM-Unifesp
FELIPE OLIVEIRA GUILHERME
Médico Neurocirurgião pelo Hospital Municipal Souza Aguiar – Rio de Janeiro - RJ
Fellowship em Neurocirurgia Vascular pela Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp)
FRANCISCO JOSÉ LUÍS DE SOUSA
Neurocirurgião pelo Hospital Municipal Dr. Mario Gatti – Campinas, SP Especialista em Microcirurgia Vascular pela Universidade Federal de São Paulo (Unifesp)
LUCERO LAGUNES PADILLA
Médico con Especialidad en Neurocirugía
Universidad Nacional Autónoma de México
En Centro Médico Nacional siglo XXI
Fellow en Microcirugía Vascular Universidad Federal de São Paulo
LUIS ÁNGEL CANACHE JIMÉNEZ
Neurocirurgião Vascular pela Universidade Federal de São Paulo (Unifesp) Fellowship em Pesquisa Clínica e Anatomia Microcirúrgica pela Unifesp Neurocirurgião do Hospital Dr. Luis Razetti / Universidade de Oriente (UDO) –Anzoátegui, Venezuela
MARIANO TEYSSANDIER
Médico Neurocirurgião pelo Hospital General de Agudos "Dr. Juan A. Fernández" – Universidad de Buenos Aires (UBA) – Ciudad Autónoma de Buenos Aires, Argentina
Fellowship em Neurocirurgia Vascular pela Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp)
Fellowship em Pesquisa Clínica em Neurocirurgia Vascular pela EPMUnifesp
Doutorando em Neurologia e Neurociências pela EPM-Unifesp
MATHEUS GOMES DA SILVA DA PAZ
Graduado em Medicina pela Universidade Federal da Bahia (UFBA) Neurocirurgia pelo Hospital Geral Roberto Santos, Salvador Aperfeiçoamento em Neurocirurgia Vascular pela Universidade Federal de São Paulo (Unifesp)
VIVIANE FERNANDES FEITOZA
Fellowship de Neurocirurgia Vascular pela Escola Paulista de Medicina da Universidade Federal de São Paulo (Unifesp) Neurocirurgiã pelo Hospital Geral de Cuiabá (HGU) da Universidade de Cuiabá (UNIC) – Cuiabá
Feres Chaddad Neto Marcos Devanir Silva da Costa Ádria Maria Simões Luis Ángel Canache Jiménez 2
Feres Chaddad Neto Marcos Devanir Silva da Costa Érico Samuel Gomes Galvão da Trindade
Feres Chaddad Neto Marcos Devanir Silva da Costa Matheus Gomes da Silva da Paz Viviane Fernandes Feitoza 4
Feres Chaddad Neto Marcos Devanir Silva da Costa Alejandro Benjamin Romero
Vídeo QR Code
Vídeo 3-1.
Tratamento microcirúrgico de uma MAV do giro frontal medial direito.
Vídeo 3-2.
Tratamento microcirúrgico de uma MAV dos giros orbitários do lado direito.
Vídeo 3-3.
Tratamento microcirúrgico de uma MAV do giro frontal inferior esquerdo.
Vídeo 3-4.
Tratamento microcirúrgico de uma MAV do giro frontal médio esquerdo.
Vídeo 3-5.
Tratamento microcirúrgico de uma MAV do giro frontal superior esquerdo.
Vídeo 4-1.
Tratamento microcirúrgico de MAV do sulco central esquerdo.
Vídeo 4-2.
Tratamento microcirúrgico de MAV do sulco pré-central direito.
Vídeo 4-3.
Tratamento microcirúrgico de MAV do lóbulo paracentral.
Vídeo 5-1.
Tratamento microcirúrgico de MAV parietal superior.
Vídeo
Vídeo 5-2.
Tratamento microcirúrgico de MAV do sulco intraparietal esquerdo.
Vídeo 5-3.
Tratamento microcirúrgico de MAV do giro supramarginal esquerdo.
Vídeo 5-4.
Tratamento microcirúrgico de MAV do giro angular direito.
Vídeo 5-5.
Tratamento microcirúrgico de MAV do giro do cíngulo e pré-cúneo.
Vídeo 6-1.
Tratamento microcirúrgico de MAV temporal esquerda.
Vídeo 6-2.
Tratamento microcirúrgico de MAV da fissura sylviana – Spetzler Martin grau II.
Vídeo 6-3.
Tratamento microcirúrgico de MAV do giro fusiforme esquerdo.
Vídeo 7-1.
Tratamento microcirúrgico de MAV do lobo occipital esquerdo – Spetzler Martin grau II.
Vídeo 7-2.
Tratamento microcirúrgico de MAV do lobo occipital esquerdo.
Vídeo QR Code
Vídeo 7-3.
Tratamento microcirúrgico de MAV do lobo occipital esquerdo.
Vídeo 8-1.
Estratégias para ressecção de MAV do esplênio do corpo caloso com extensão para o átrio esquerdo.
Vídeo 8-2.
Tratamento microcirúrgico de MAV rota do tálamo direito.
Vídeo 8-3.
Tratamento microcirúrgico de MAV do lobo insular posterior e giro de Heschl.
Vídeo 9-1.
Tratamento microcirúrgico de MAV da superfície suboccipital do cerebelo.
Vídeo 9-2.
Tratamento microcirúrgico de MAV da tonsila cerebelar.
Vídeo QR Code
Vídeo 9-3.
Tratamento microcirúrgico de MAV da superfície tentorial do cerebelo.
Vídeo 9-4.
Tratamento microcirúrgico de MAV da superfície petrosa do cerebelo.
Vídeo 10-1.
Tratamento microcirúrgico de MAV da fissura cerebelo-mesencefálica.
Vídeo 10-2.
Tratamento microcirúrgico de MAV mesencefálica.
Vídeo 10-3.
Tratamento microcirúrgico de MAV da lâmina quadrigêmea.
Vídeo 10-4.
Tratamento microcirúrgico de MAV ponto-peduncular esquerda.
Feres Chaddad Neto Marcos Devanir Silva da Costa Ádria Maria Simões Luis Ángel Canache Jiménez
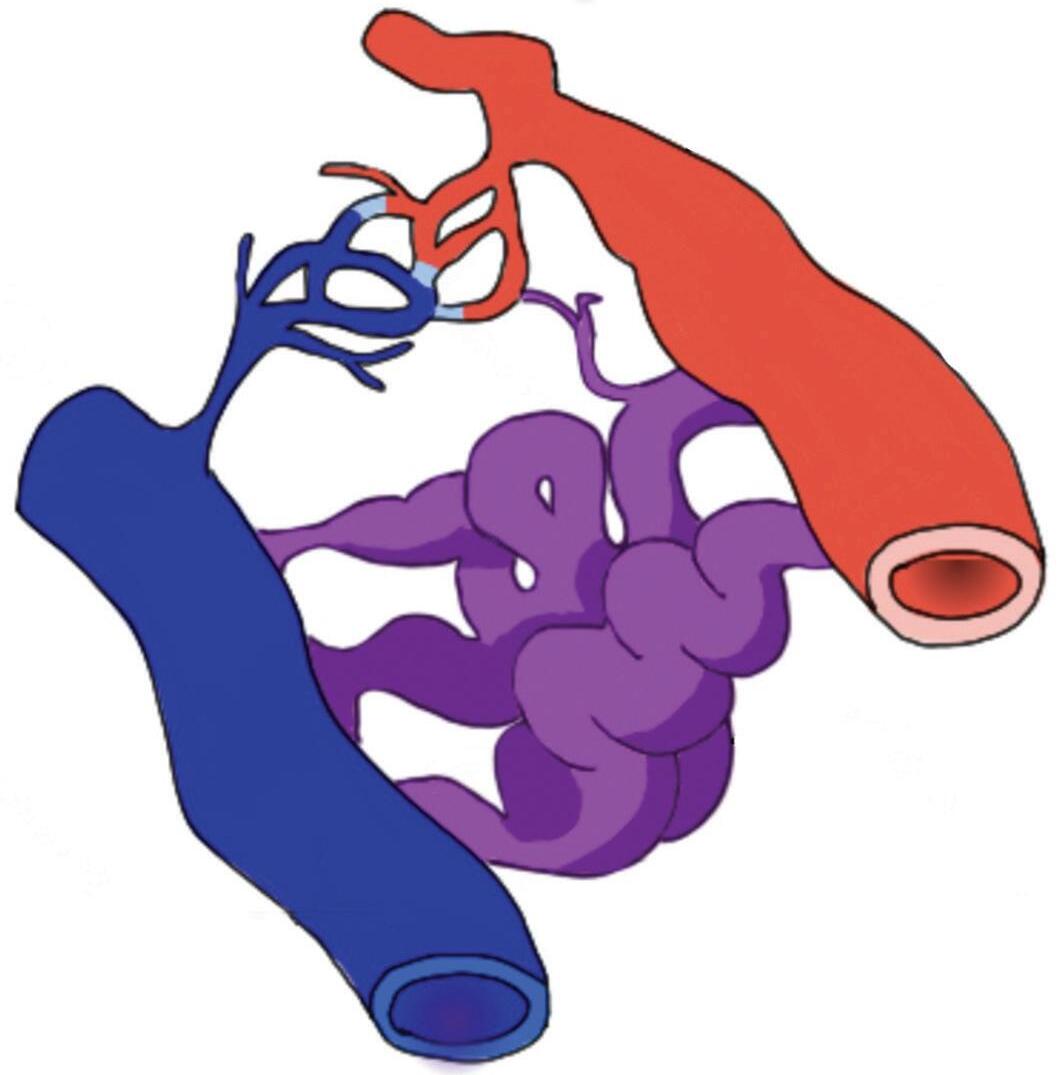
As malformações arteriovenosas cerebrais (MAVs) foram descritas pela primeira vez em 1895 por Steinheil como uma condição vascular cerebral rara caracterizada por uma conexão anormal entre artérias e veias sem a interposição dos capilares, como ocorre na anatomia vascular cerebral normal. Esta comunicação anormal faz com que o sangue arterial flua diretamente para a rede venosa sem a intermediação do leito capilar e do parênquima cerebral. As MAVs são consideradas como uma desordem neurovascular dinâmica, sendo composta por um complexo de artérias aferentes que drenam para veias por um leito capilar anormal, denominado nidus ou “ninho vascular”. O nidus da MAV pode ou não conter conexão/ shunt arteriovenoso direto e, em virtude dessa variação, foi proposto por Lasjaunias em 1993 a divisão em dois grupos:
1. Malformação arteriovenosa pial (MAVP): é composta pela(s) artéria(as) aferente(s), a(s) veia(s) de drenagem e o nidus como intermediário, portanto, não existe um ponto de shunt direto entre elas; podendo o nidus ser compacto ou difuso.
2. Fístula arteriovenosa pial (FAVP): é formada por uma comunicação direta entre a artéria aferente e a veia de drenagem, sem um nidus intermediando a comunicação. Podem ocorrer de forma única ou múltipla ou estarem acompanhadas de uma MAV.1-3
A MAV também é composta por vasos localizados próximo ao nidus (vasos perinidais), os quais formam uma rede capilar que é considerada por alguns autores como responsável pela hemorragia pós-operatória ou a recorrência da malformação após tentativa de ressecção cirúrgica.1,2
Dandy chamava as MAVs de aneurismas arteriovenosos do cérebro e acreditava que eram semelhantes a outras malformações vasculares situadas em qualquer localização do organismo.4 Os vasos anômalos que constituem a MAV podem variar de tamanho e de localização, podendo estar situados em uma área delimitada ou em regiões mais
amplas, afetando simultaneamente múltiplas áreas do cérebro. Quando a malformação é difusa, pode ser confundida com a angiopatia proliferativa cerebral, porém esta diferencia-se das MAVs por não apresentar veia de drenagem precoce, pela presença de suprimento transdural e pela estenose das artérias nutridoras (Figs. 1-1 e 1-2).5-7
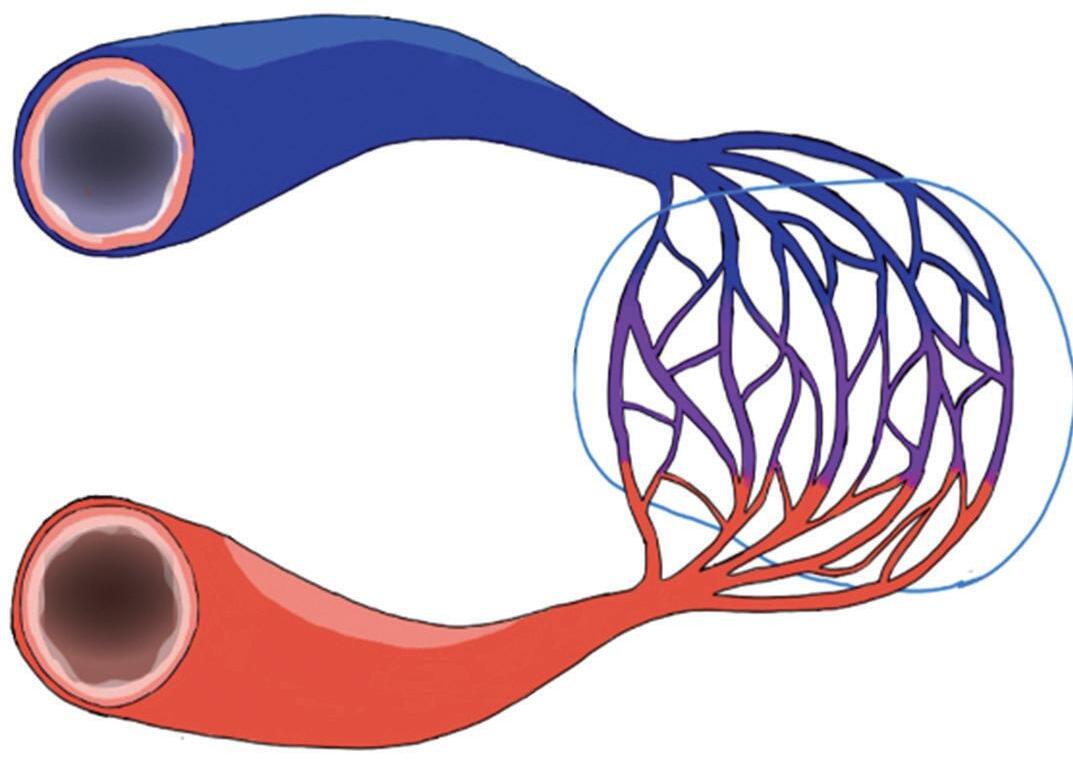
Na anatomia vascular cerebral normal, os capilares são vasos sanguíneos finos e permeáveis, que permitem a troca de nutrientes e resíduos entre o sangue e as células cerebrais, representados pela Figura 1-3. Nas MAVs, a ausência destes capilares promove um arranjo disfuncional dos vasos cerebrais (representado pelas Figuras 1-2 e 1-4) resultando em um fluxo sanguíneo local alterado, aumento da pressão venosa e turbilhonamento do fluxo sanguíneo intranidal. Estes fatores em conjunto, contribuem para o enfraquecimento do endotélio dos vasos envolvidos, elevando assim o risco de ruptura vascular e de sangramento intracraniano.6-8
Com o avanço da Medicina e uma melhor compreensão acerca da angiogênese, em 1982, Mulliken e Glowacki propuseram a divisão das anomalias vasculares cerebrais em duas categorias, malformações arteriovenosas e hemangiomas. Essa divisão permitiu uma análise separada dessas anomalias, de forma a detalhar as diferenças e especificidades de cada condição. Com isso, as MAVs foram reconhecidas por seu caráter raro e potencialmente grave, como uma fonte significativa de morbidade e mortalidade neurológica. Desse modo, compreender a sua história natural é essencial para delinear estratégias eficazes de manejo e intervenção.9-11
As MAV têm sua etiologia ainda pouco esclarecida, todavia a hipótese da origem congênita é a mais descrita pela literatura. Diferentes teorias sugerem que as MAVs representam alterações do desenvolvimento embrionário, período em que ocorre a persistência de comunicações entre artérias e veias dentro do plexo vascular primitivo. Apesar de se formarem no período embrionário, são frequentemente diagnosticadas apenas na vida adulta; fase da vida em que a maior parte dos sintomas se tornam mais evidentes.11-13

Veia de drenagem
Veia de drenagem

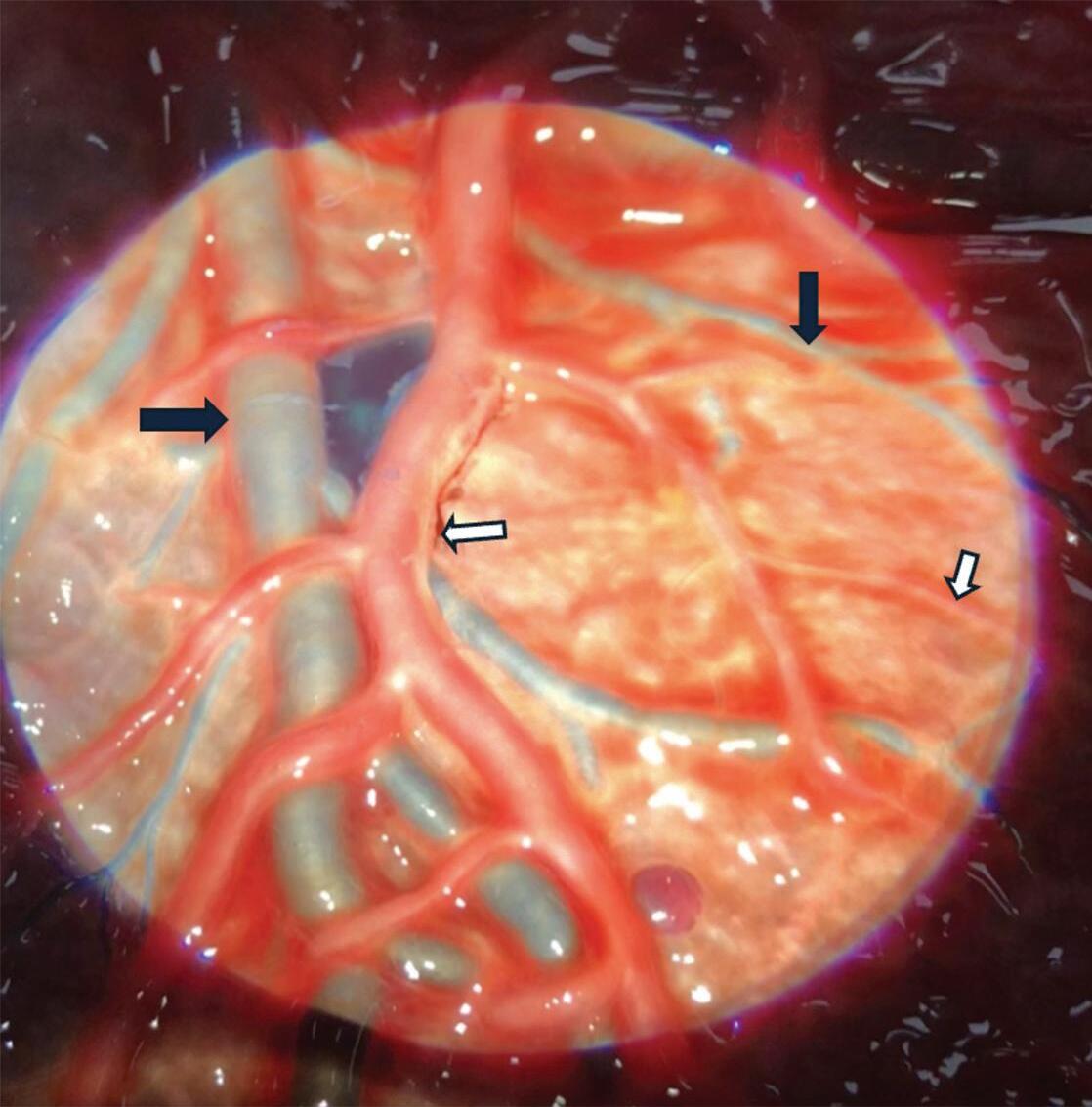
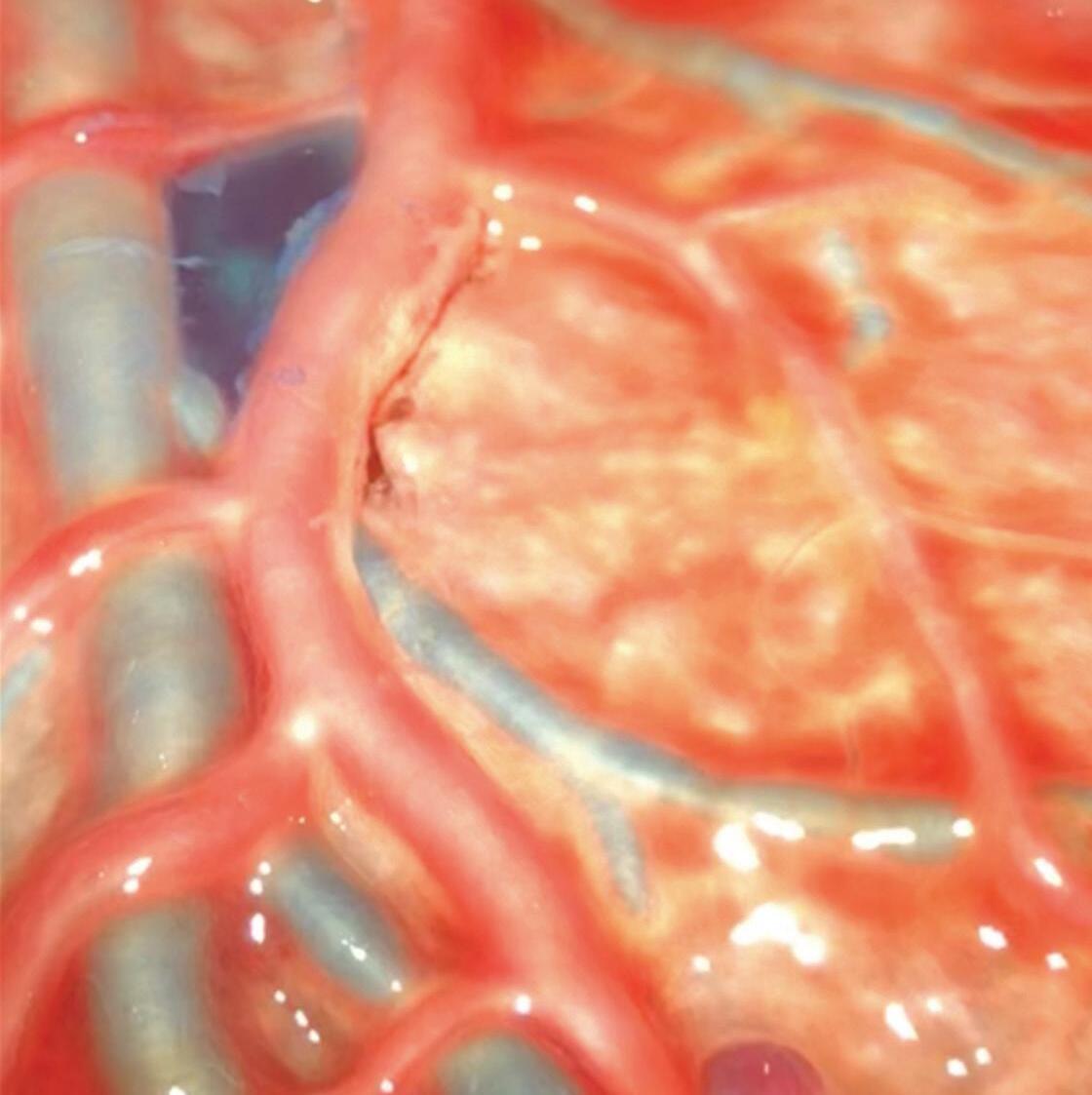
Fig. 1-2. Ilustrando a angioarquitetura da MAV composta por: artéria alimentadora (setas azuis) nidus (seta branca), e veias de drenagem (setas pretas).

Durante o seu desenvolvimento, as MAVs podem crescer, estabilizar ou regredir. Acredita-se que derivam de uma anomalia secundária a capilaropatia proliferativa, a qual promove a coalescência dos capilares no início do desenvolvimento vascular (7-9 semanas do período embrionário); portanto, é resultado da disfunção do processo de remodelamento nas junções entre capilares e veias. Outro fator relevante apontado pela literatura é que parte dessa anomalia ocorre também na 29a semana de gestação, momento que fisiologicamente ocorre a regressão das estruturas arteriais primitivas e o surgimento das artérias leptomeníngeas; sugere-se então que as MAVs se originariam potencialmente após esta transformação.14-16
Do ponto de vista fisiopatológico, a ausência dos capilares de pequeno diâmetro (menor resistência vascular) interpondo-se entre as artérias e as veias permite a transmissão direta da pressão arterial para as estruturas venosas, ocorrendo também aumento do fluxo sanguíneo intranidal, com consequente dilatação e tortuosidade dos
seus vasos. A persistência desse estresse hemodinâmico contribui para que ocorra além do processo de angiopatia, algumas alterações hemodinâmicas, tais como: inversão do fluxo venoso (sangue venoso arterializado), hipertensão venosa e hipoperfusão das áreas circunjacentes à malformação.14-16
Ainda no que se refere a fisiopatologia, pesquisas têm demonstrado resultados surpreendentes por meio do encontro de mutação do KRAS nas células endoteliais de cultura das MAVs, fato esse que abre uma nova perspectiva na patogênese da doença. Esse tipo de mutação é comumente encontrado na via de formação de tumores, confrontando dessa forma a hipótese congênita da sua origem. Em 2024 foi publicado estudo no qual dois pacientes com MAV refratária a várias estratégias de tratamento convencional e que apresentavam mutação G12C na via KRAS, foram submetidos ao uso de Sotorasib (bloqueador da via do KRAS), com uma resposta parcial na redução da MAV, mas, abrindo desta forma uma nova perspectiva para o estudo e o entendimento das patogêneses das MAVs.17,18
EPIDEMIOLOGIA
A MAV é uma condição rara, que pode surgir em qualquer área do sistema nervoso central, raramente é múltipla e, apesar de não haver confirmação acerca do caráter hereditário, pode vir associada a algumas síndromes genéticas familiares, como a de Rendu-Osler-Weber, Wyburn-Mason, Von Hippel-Lindau e Sturge-Weber.19-21
Diferentes estudos apontam uma variabilidade na incidência em diferentes populações, cerca de 0,89 a 1,34 casos por 100.000 pessoas por ano. 20 A idade média de apresentação dos sintomas ocorre entre a segunda e a quarta década da vida, embora os sintomas possam iniciar em qualquer faixa etária.19-21 Não se observam diferenças significativas de incidência entre os sexos ou prevalência entre diferentes grupos raciais, contudo alguns estudos identificaram que as populações hispânicas apresentam risco aumentado de hemorragia intracraniana secundária à ruptura de MAV cerca de duas a três vezes mais que as demais. 19,20 Os resultados do estudo da história natural das MAVs apontam uma taxa anual de hemorragia de 2-4%. 22,23 Uma vez que ocorra o sangramento da MAV, o risco subsequente de um novo evento hemorrágico aumenta cerca de cinco vezes, especialmente no primeiro ano, principalmente se houverem aneurismas associados e se a localização da mesma for profunda e com o aumento da idade do paciente. 13,20,23
Ainda é um desafio na atualidade eleger uma classificação perfeita, que defina estratégias de manejo, tratamento e prognóstico. Nosso serviço reconhece o valor de todos os trabalhos existentes que tentam sanar esta dificuldade, porém em virtude do estudo contínuo e da grande experiência adquirida no transcorrer dos anos nesta seara, não nos limitamos atualmente apenas às classificações descritas pela literatura para definirmos o tratamento das MAVs. Possuímos inúmeros trabalhos publicados nas maiores revistas de impacto mundial, nas quais compartilhamos nossa experiência no tratamento microcirúrgico das MAVs, incluindo casos considerados inoperáveis pela literatura corrente, com excelentes resultados pós-cirúrgicos.24 A seguir, citaremos algumas classificações descritas pela literatura, que certamente são de grande utilidade para nortear a condução dos casos.
Com relação à apresentação clínica, as MAVs podem ser classificadas em dois grandes grupos: rotas e não rotas, como representado nas Figuras 1-5 a 1-7. As MAVs não rotas subdividem-se em dois subgrupos: sintomáticas e assintomáticas, sendo a crise convulsiva o sintoma mais comum nas MAVs não rotas; embora a importância das crises epilépticas seja muitas vezes negligenciada em favor da hemorragia intracraniana, que é o evento mais frequente e temido da história natural das MAVs. Em contrapartida, as crises epilépticas não devem ser deixadas em segundo plano porque podem ser debilitantes e comprometer a qualidade de vida do paciente.23,25



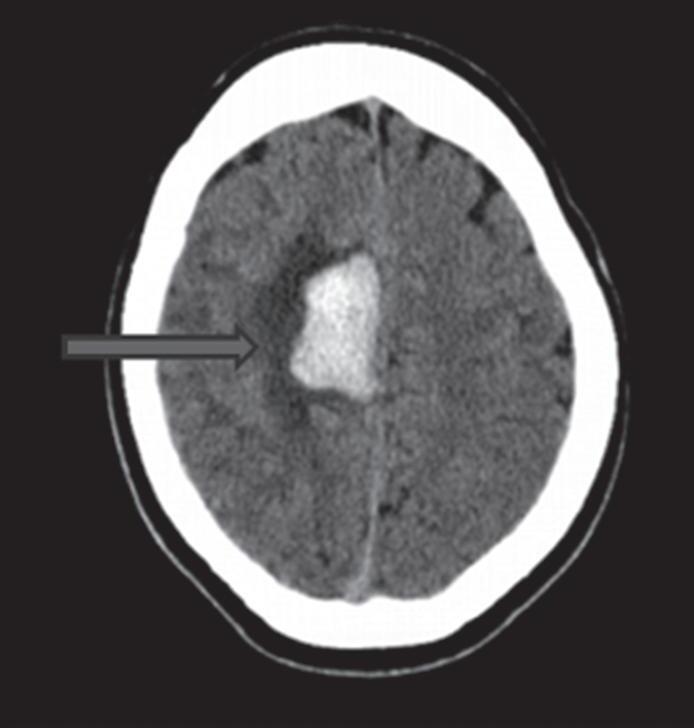
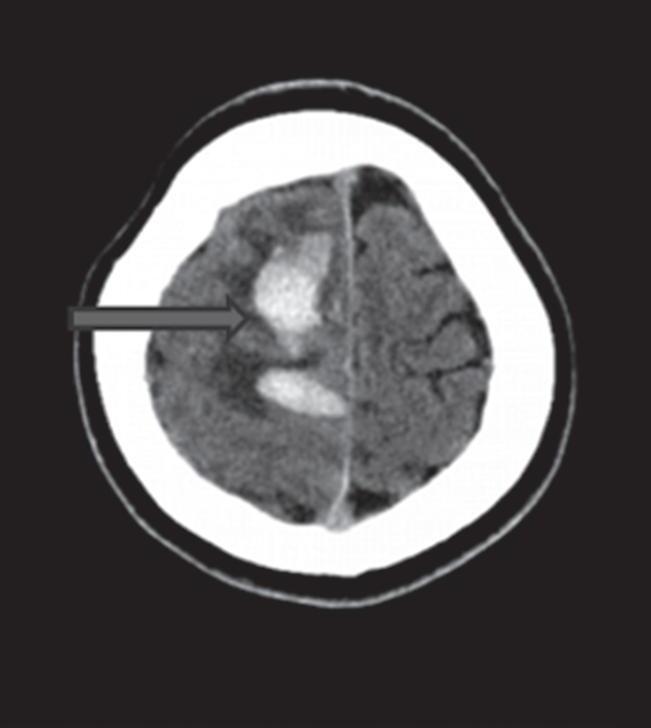
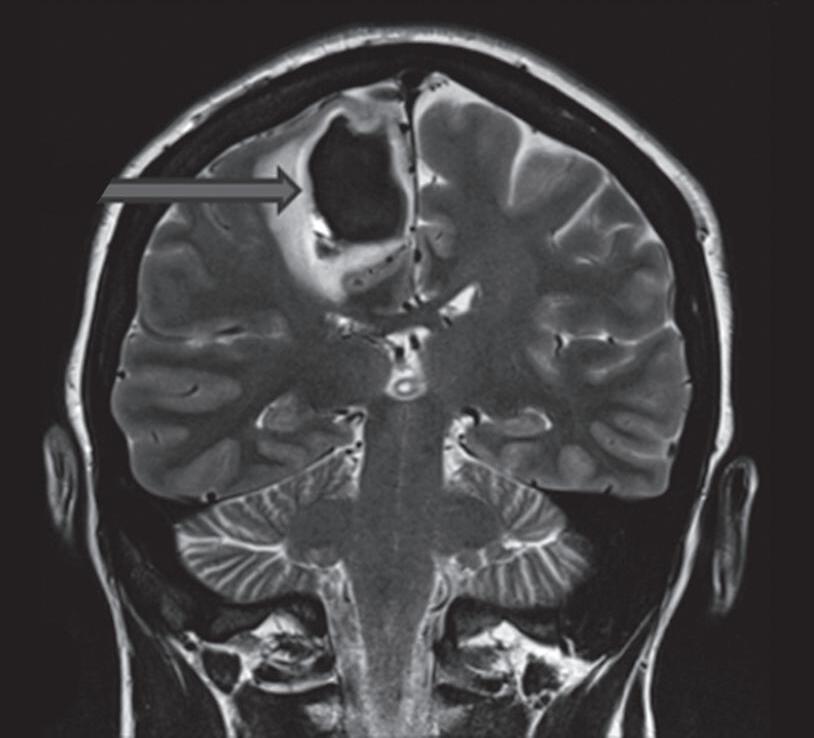
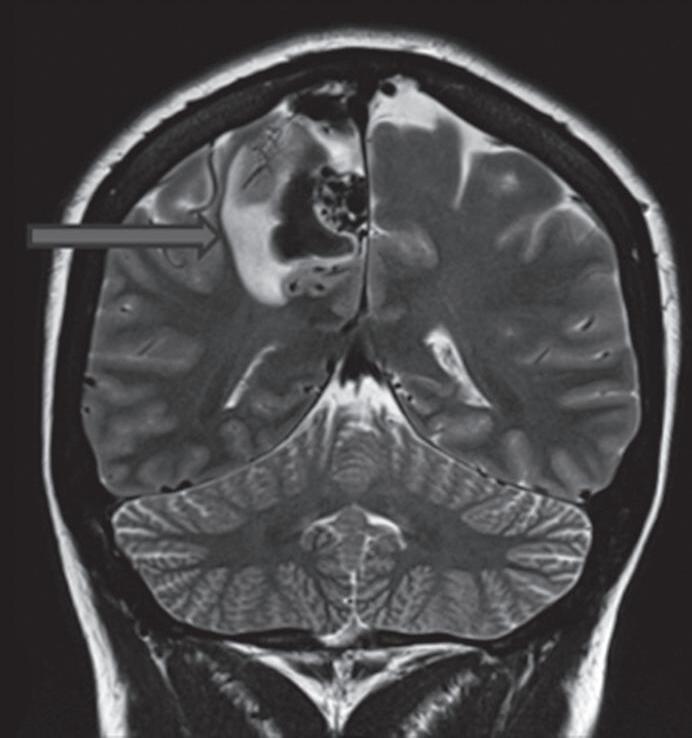
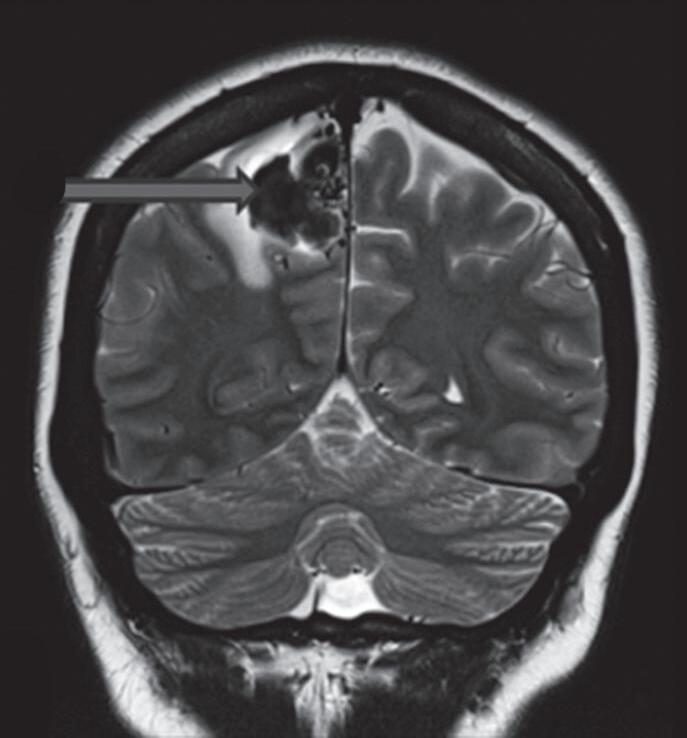
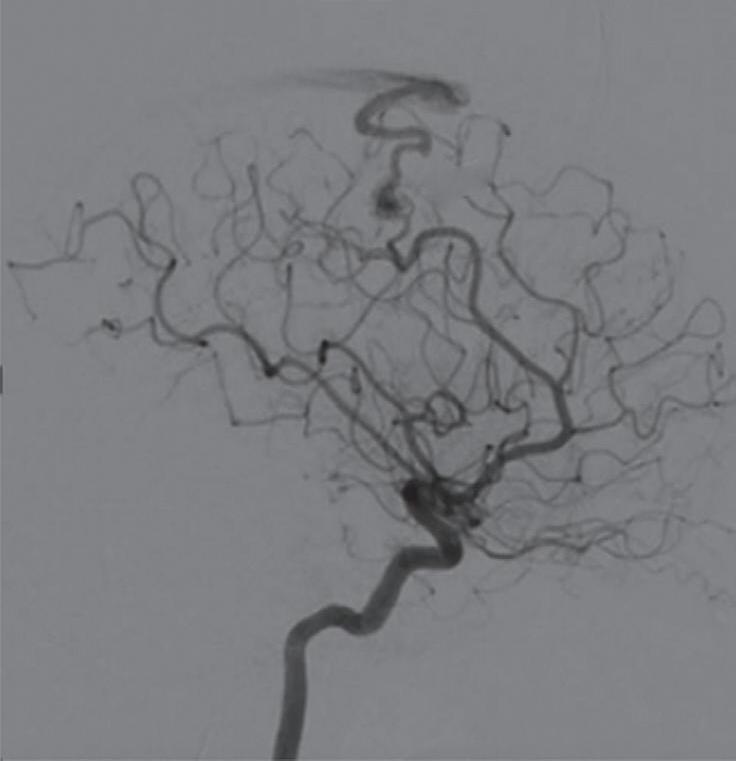
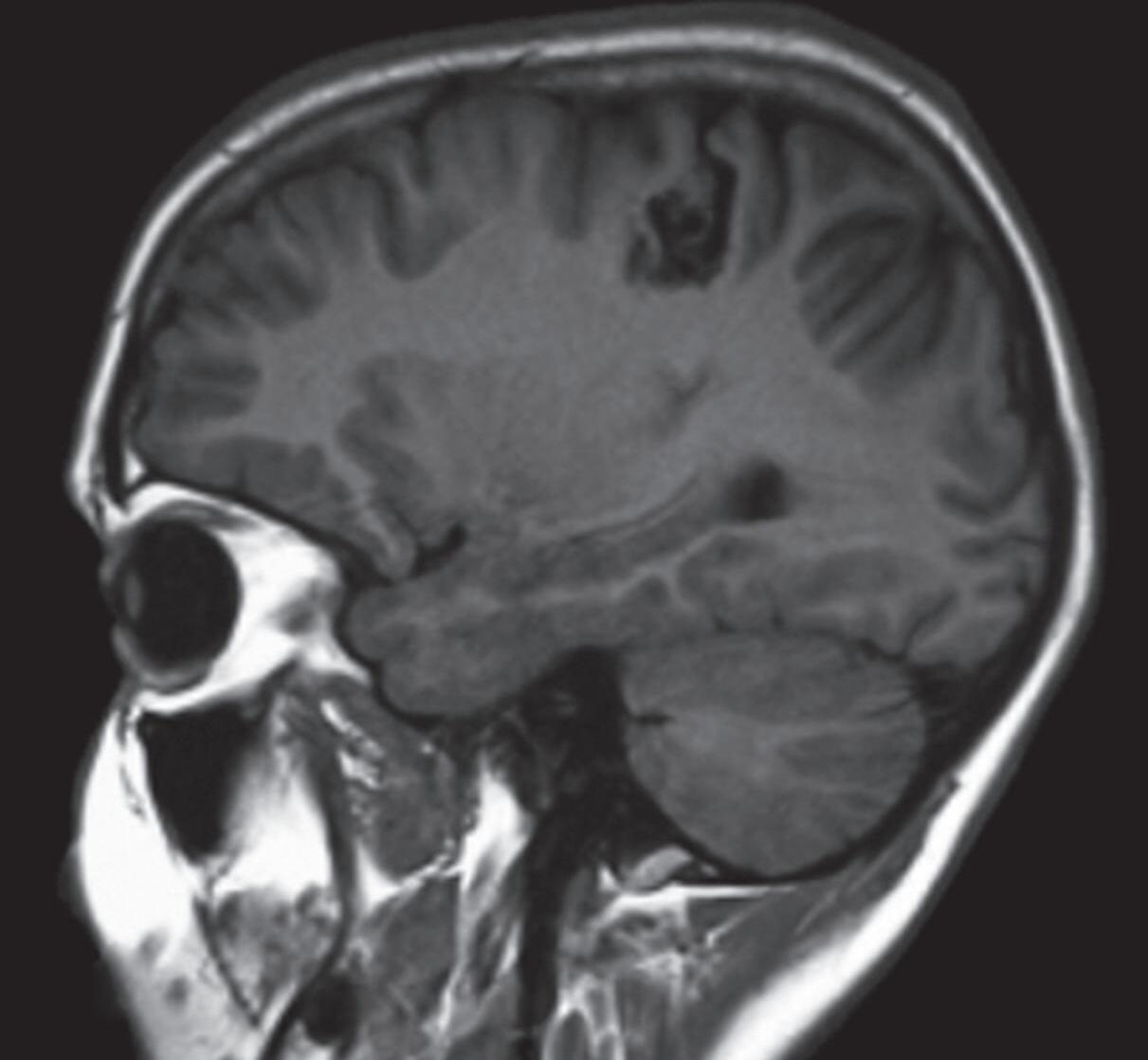
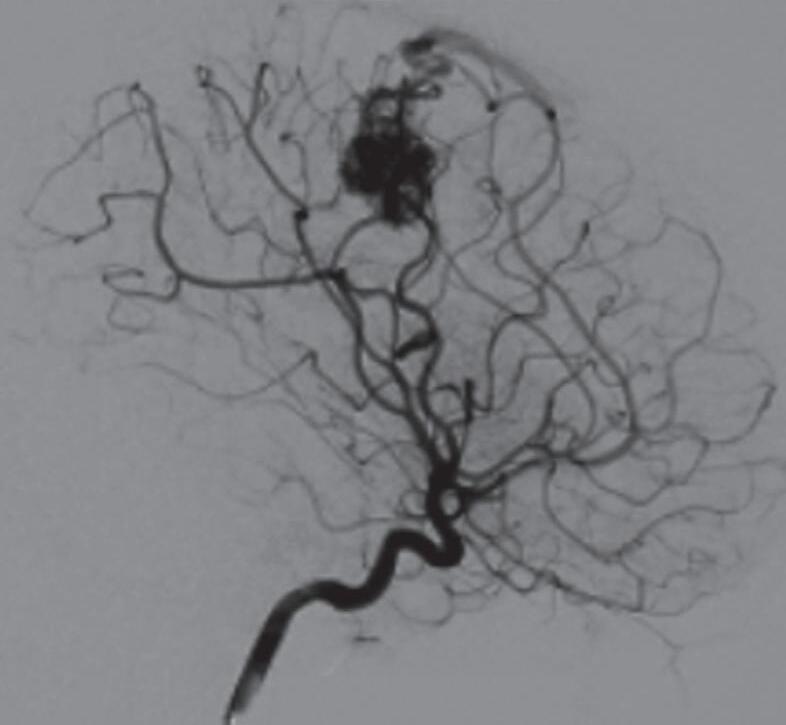
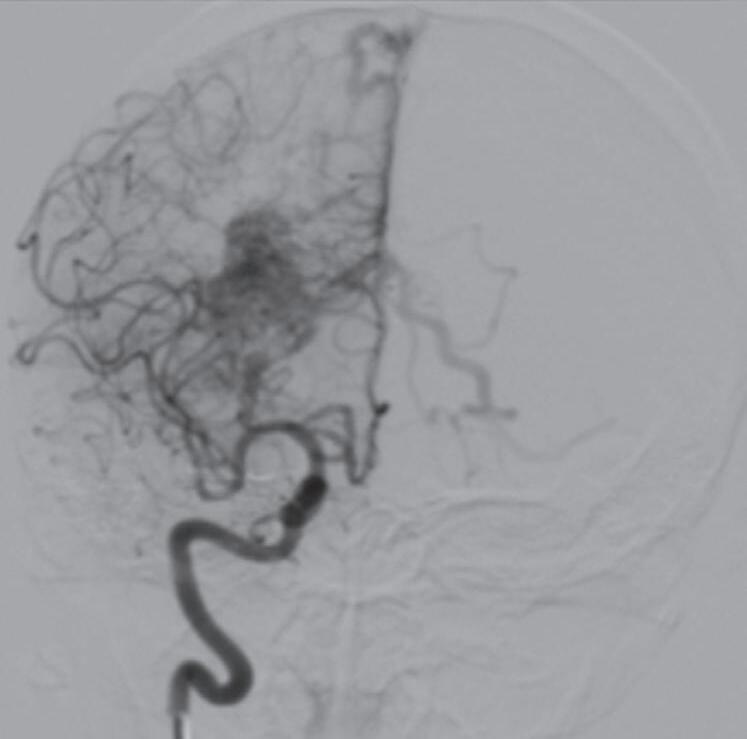
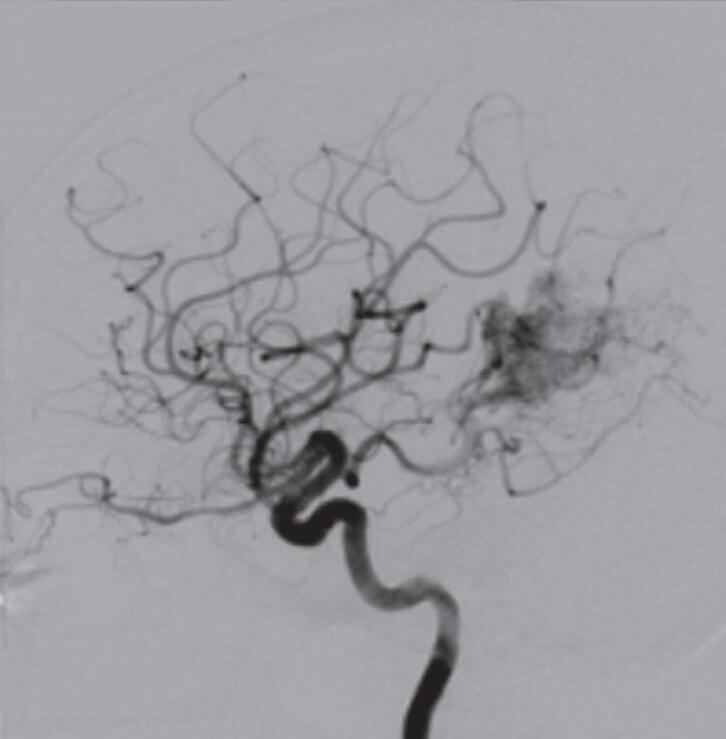
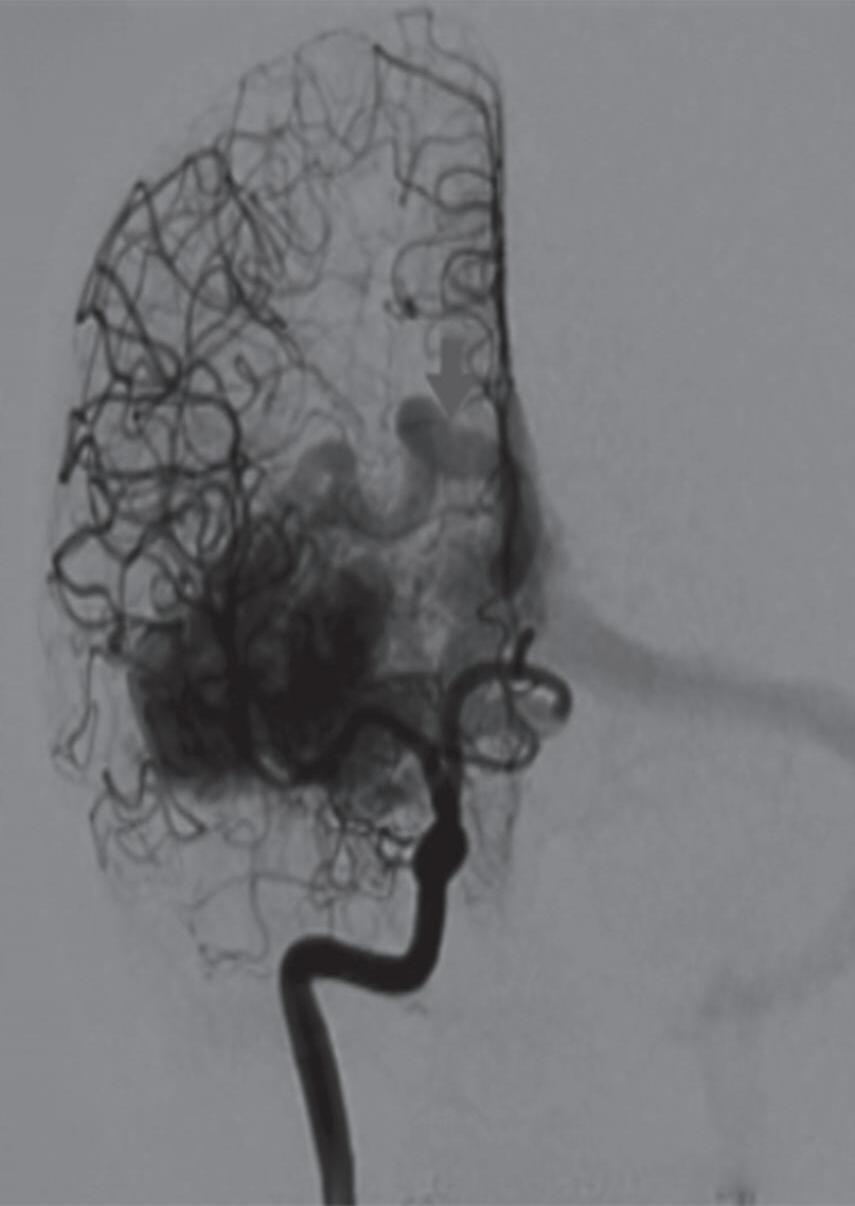
Com relação ao fluxo no interior do nidus, alguns autores classificam-nas em alto fluxo (Fig. 1-8) e baixo fluxo (Fig. 1-9). São consideradas de alto fluxo aquelas em que a opacificação após injeção de contraste ocorre apenas na malformação, em contrapartida, nas de baixo fluxo, ocorre opacificação da MAV e de outras artérias normais do mesmo território vascular. Exemplificando as lesões de alto fluxo temos as malformações arteriais, as malformações arteriovenosas e as fístulas arteriovenosas, enquanto as lesões de baixo fluxo são representadas pelas malformações venosas, linfáticas e capilares.25
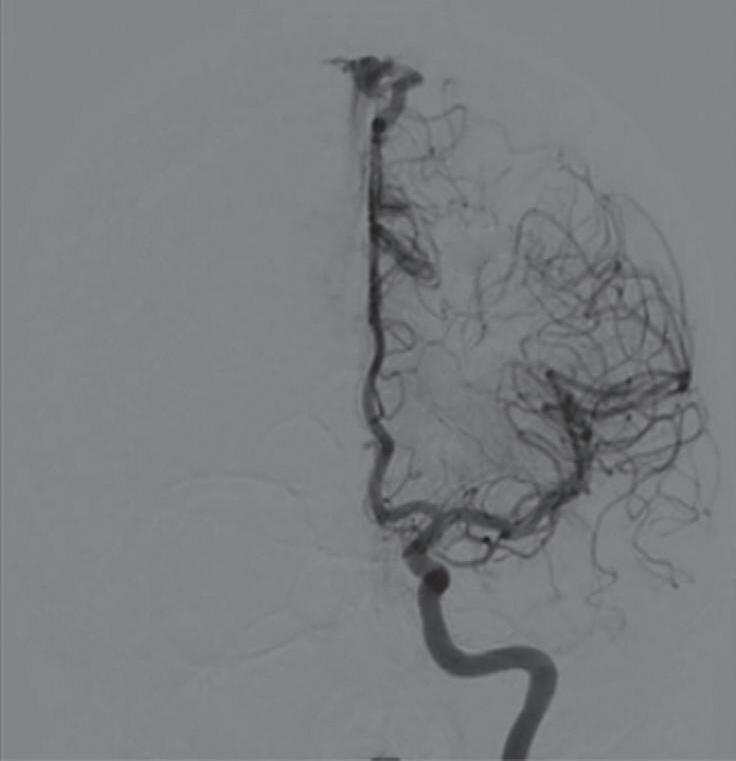
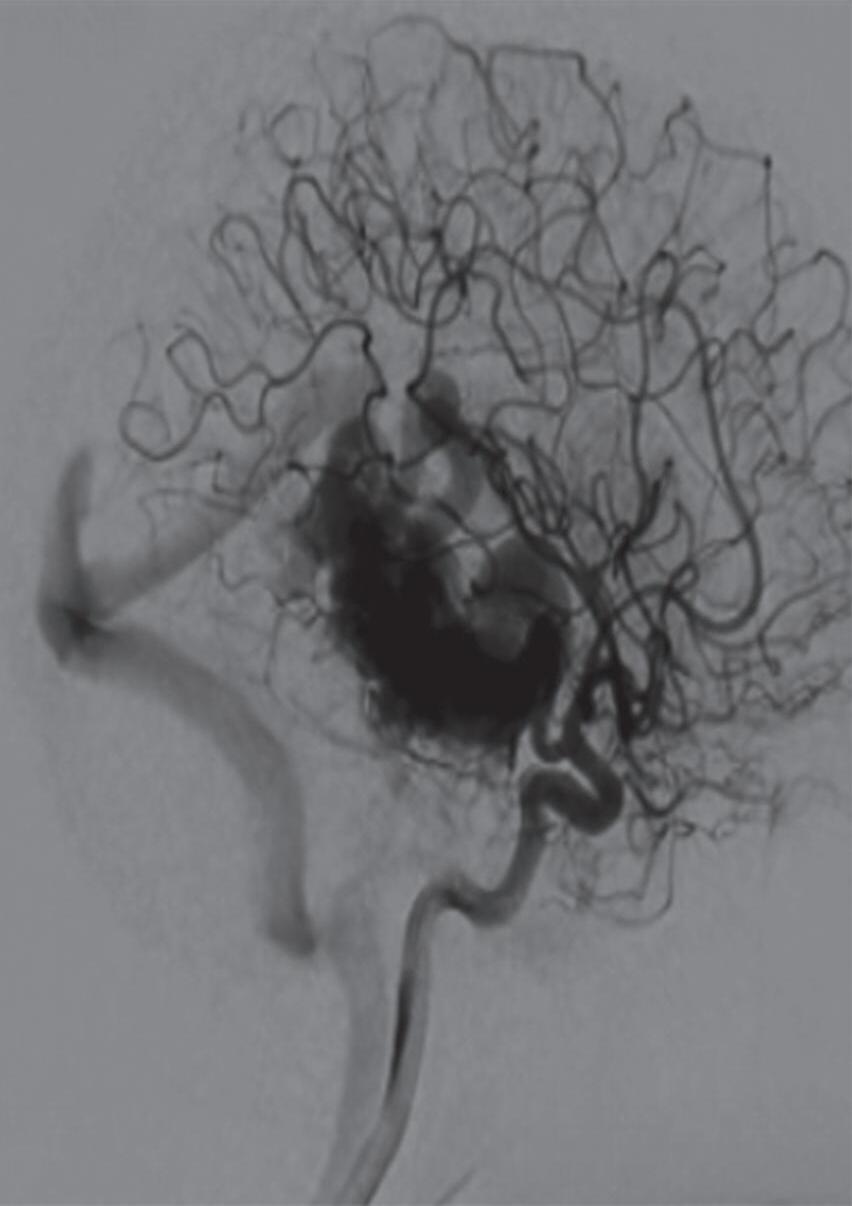
Outra classificação relacionada com a topografia divide as MAVs em: parenquimatosas, durais puras e mistas (durais e parenquimatosas). As parenquimatosas subdividem-se em: piais, subcorticais, paraventriculares (Fig. 1-10) e combinadas. Sendo que as piais, quando rompem, estão associadas mais frequentemente à hemorragia subaracnóidea e as paraventriculares associam-se ao hemoventrículo associado ou não à hidrocefalia obstrutiva.26


Objetivando compreender e classificar as malformações arteriovenosas de uma maneira sistemática e eficaz, no ano de 1986 foi publicada a escala de Spetzler-Martin (SM), que permitiu, na época, uma abordagem mais universal dessa patologia, facilitando a definição do tratamento e impactando favoravelmente o prognóstico do paciente.27

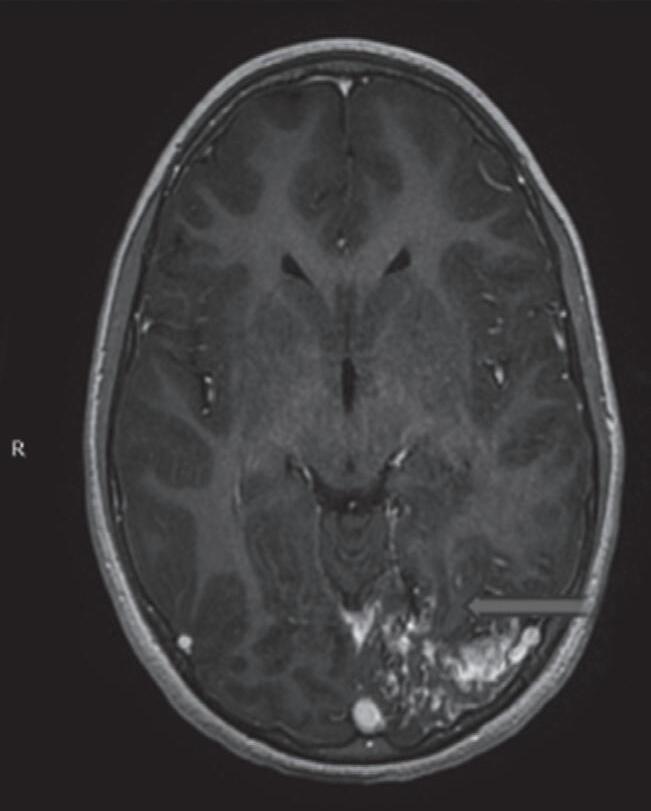
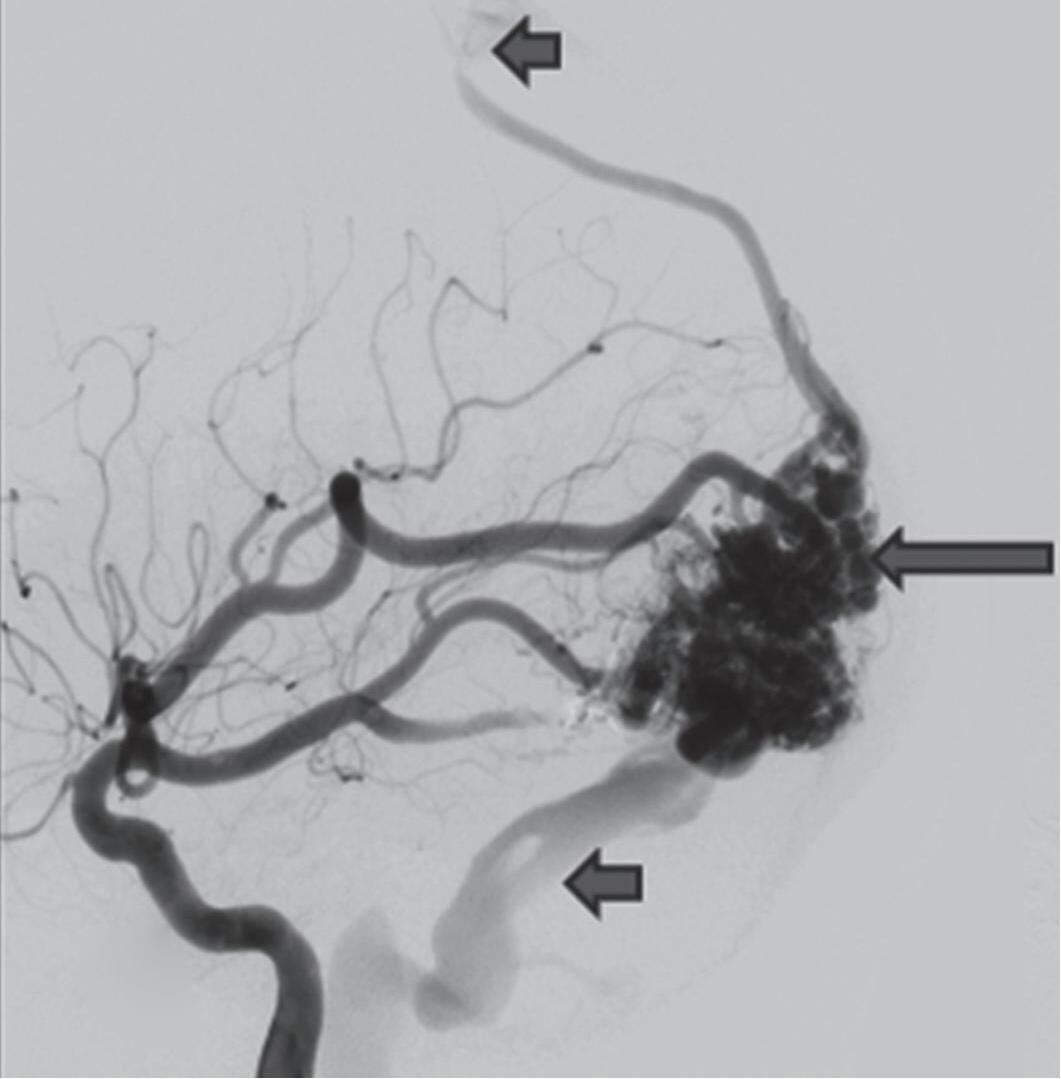
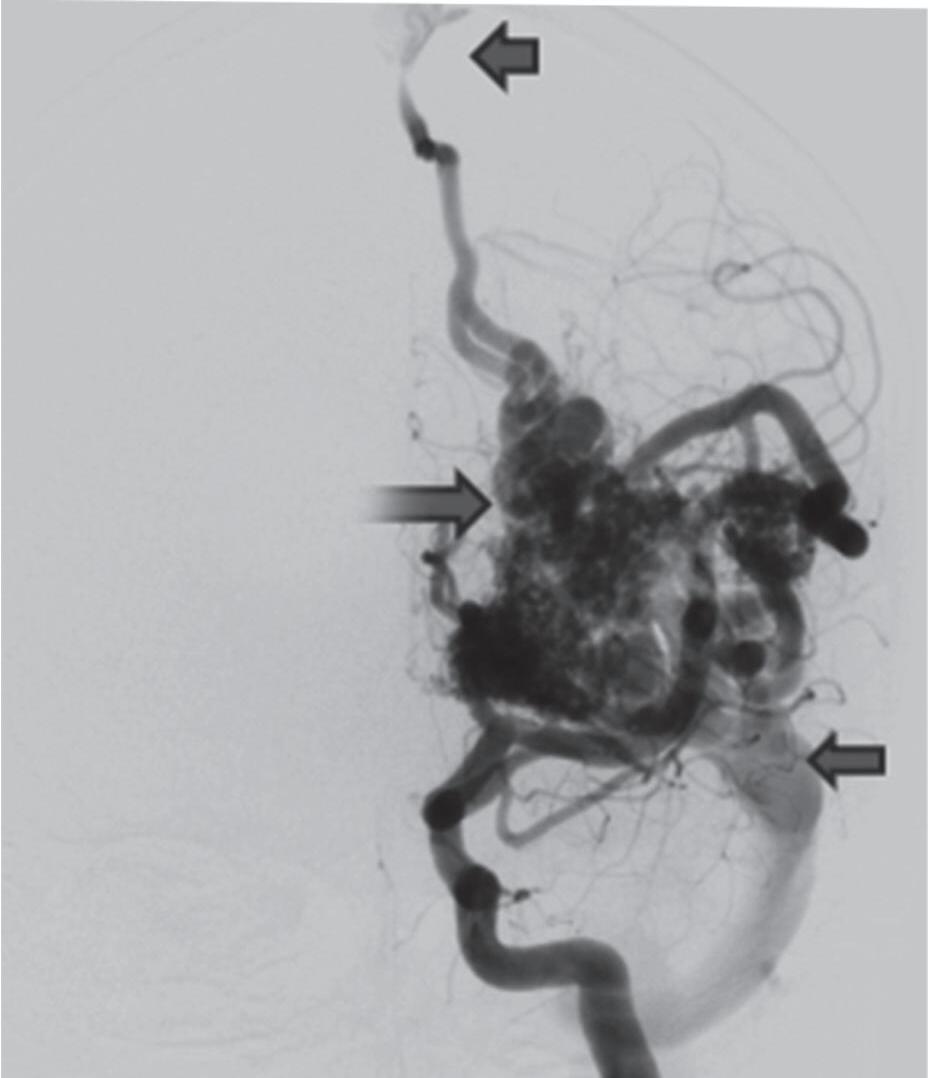

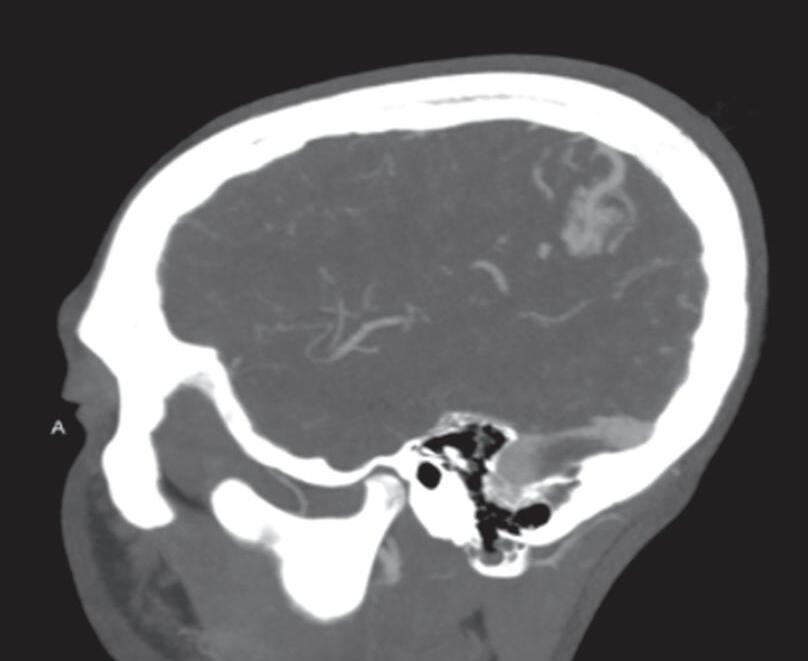
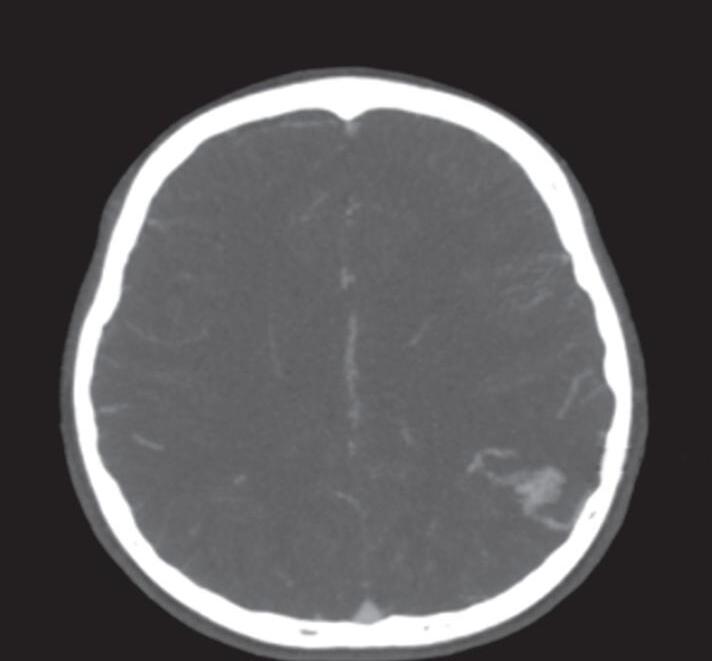
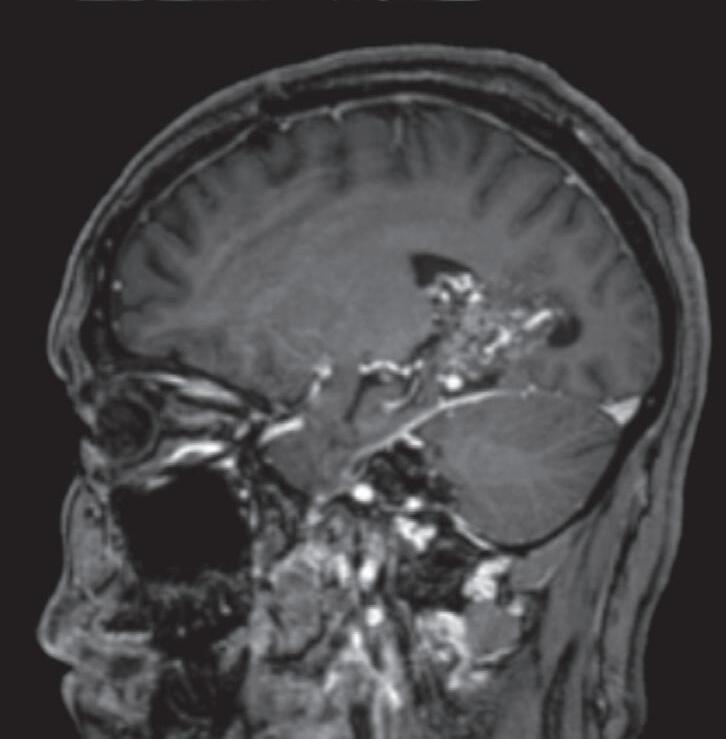
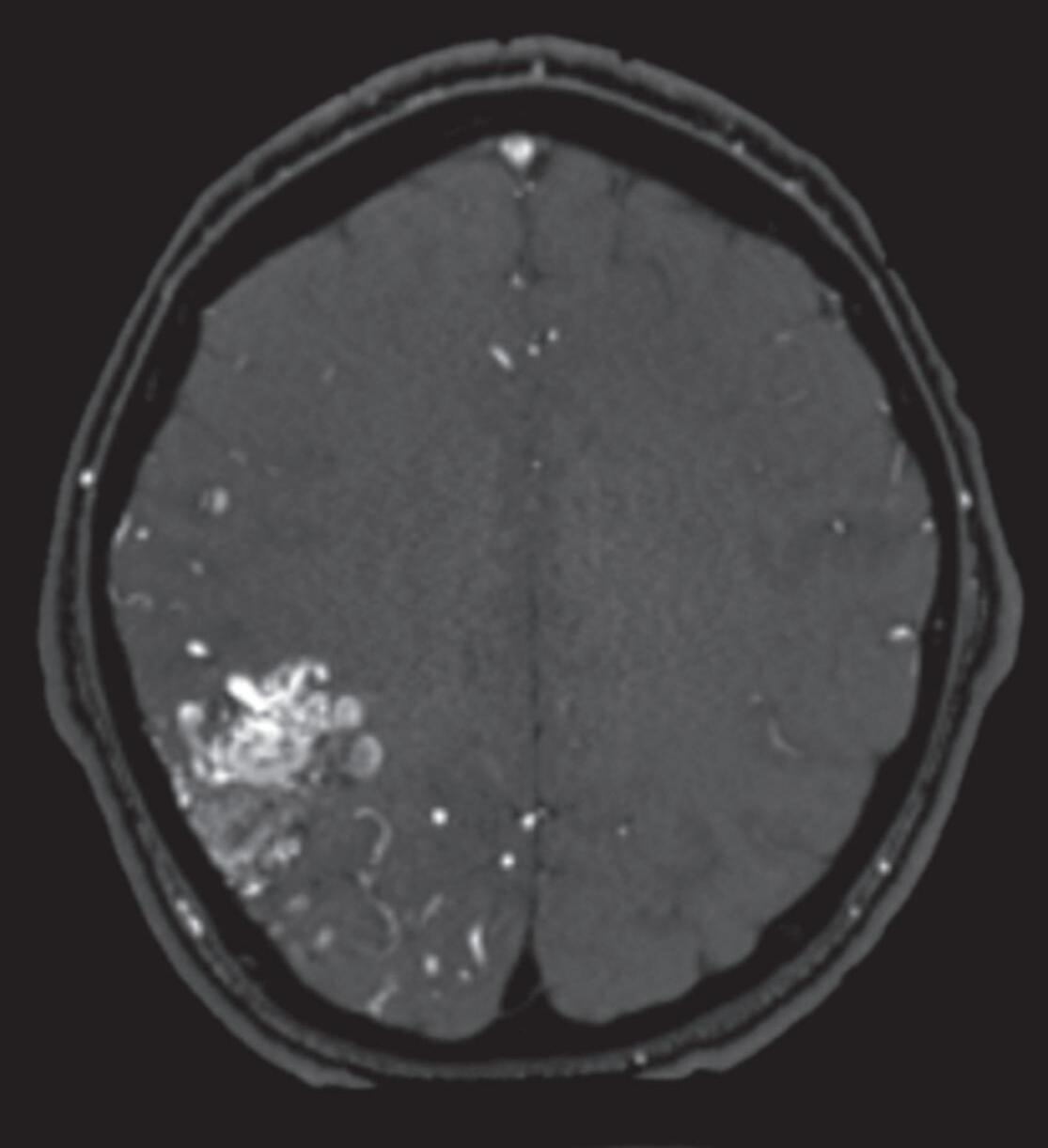
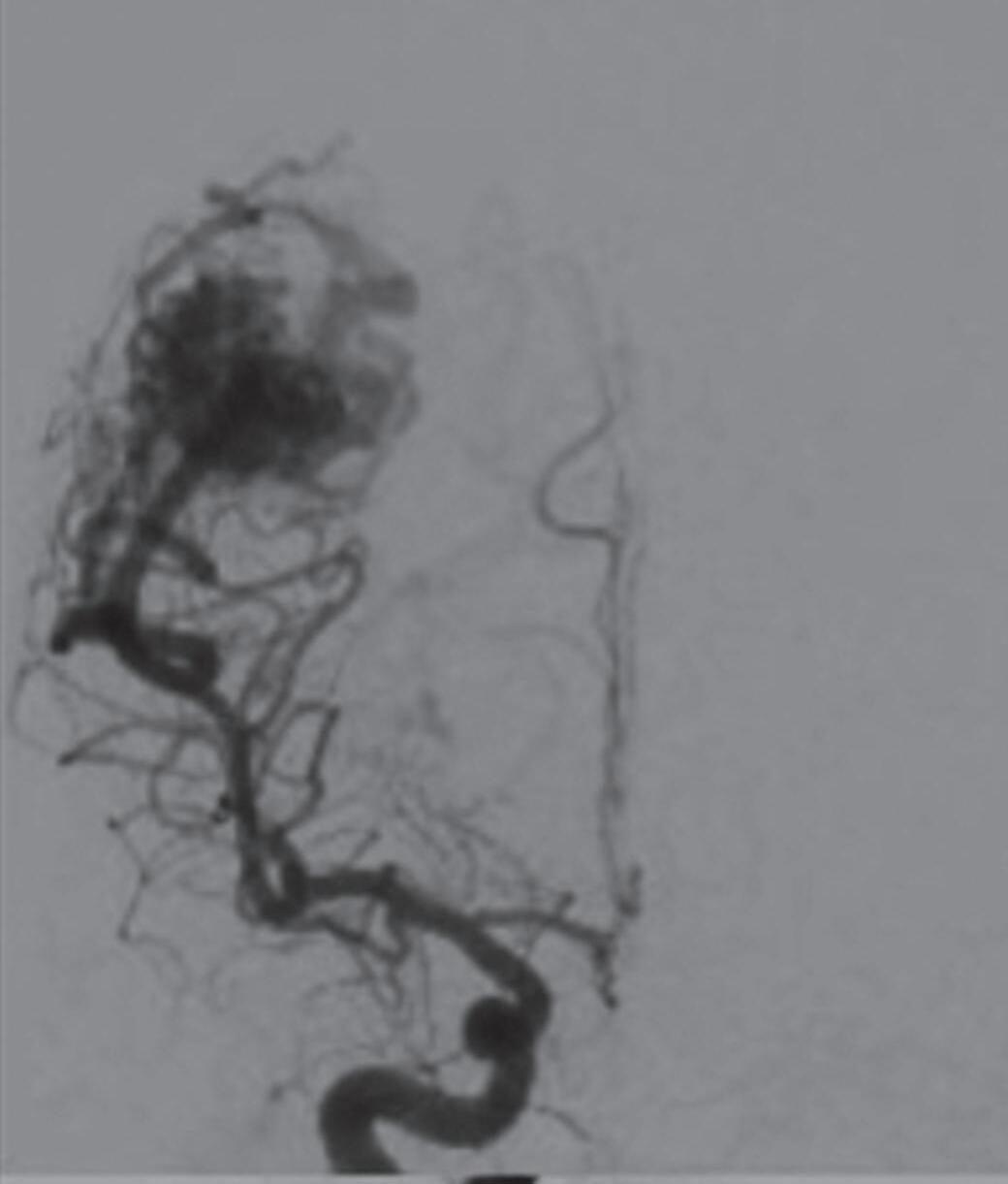
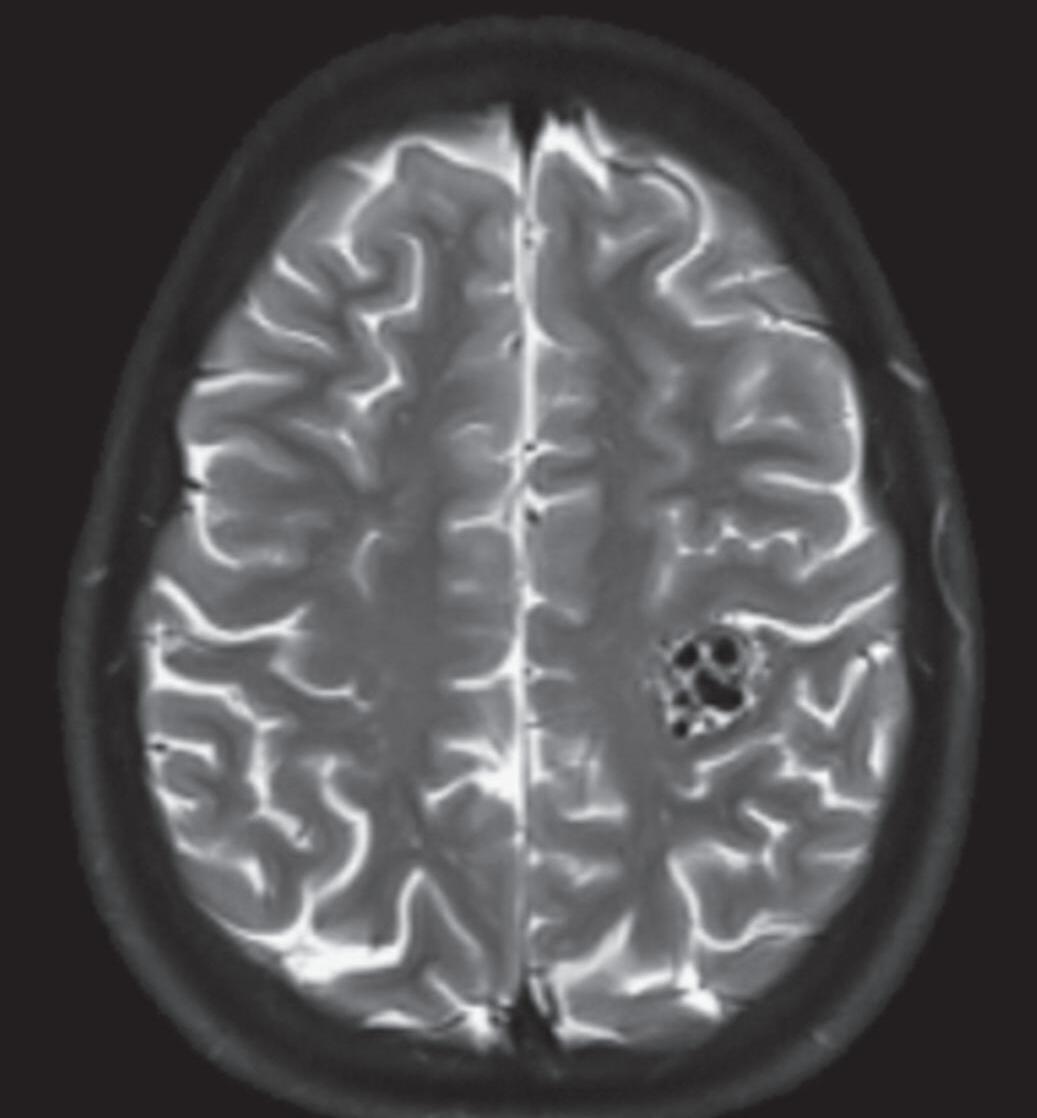
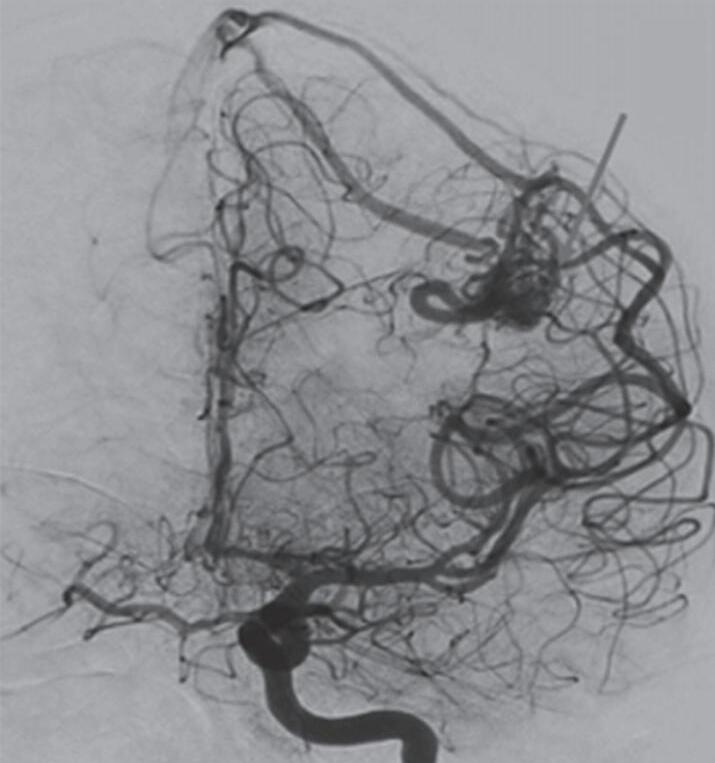
Fig. 1-8. (a-c) RNM T1 com contraste, cortes sagital (a), coronal (b) e axial (c) demonstrando MAV não rota com nidus localizado no lobo occipital à esquerda (setas longas). (d) Arteriografia digital cerebral com injeção de contraste via carótida direita (AP) mostrando a contribuição da carótida direita na irrigação da MAV contralateral. (e,f) Com injeção de contraste via carótida esquerda, em Perfil e AP respectivamente, observa-se nidus compacto nutrido por ramos da artéria cerebral média à esquerda e a veia de drenagem precoce se dirigindo para o seio sagital superior. Projeções em AP (g) e em perfil (h) demonstrando a contribuição do sistema vertebrobasilar por meio de ramos distais da artéria cerebral posterior à esquerda e drenagem para os seios sagital superior e sigmoide à esquerda (setas curtas).
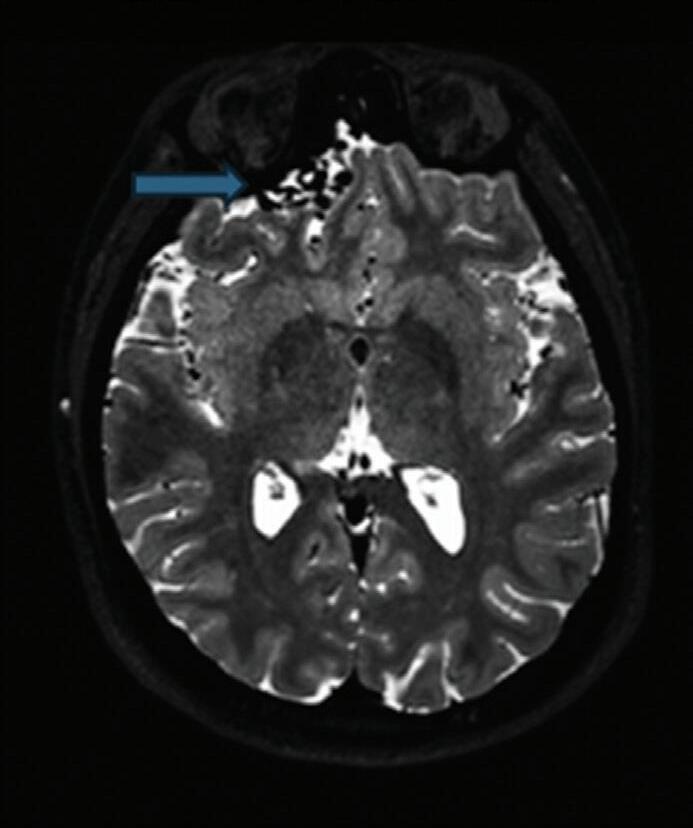
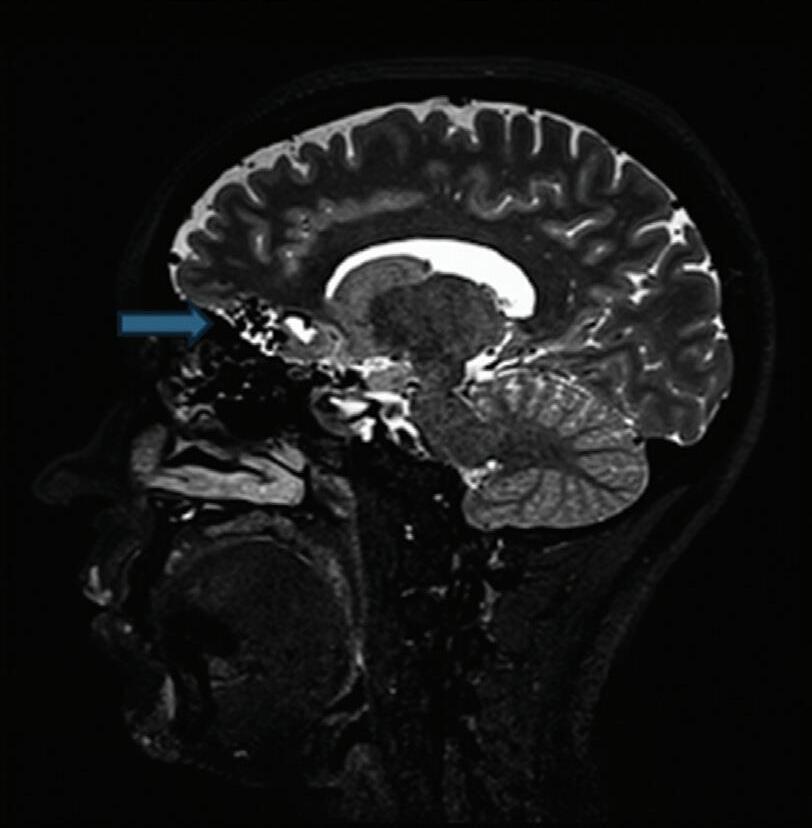
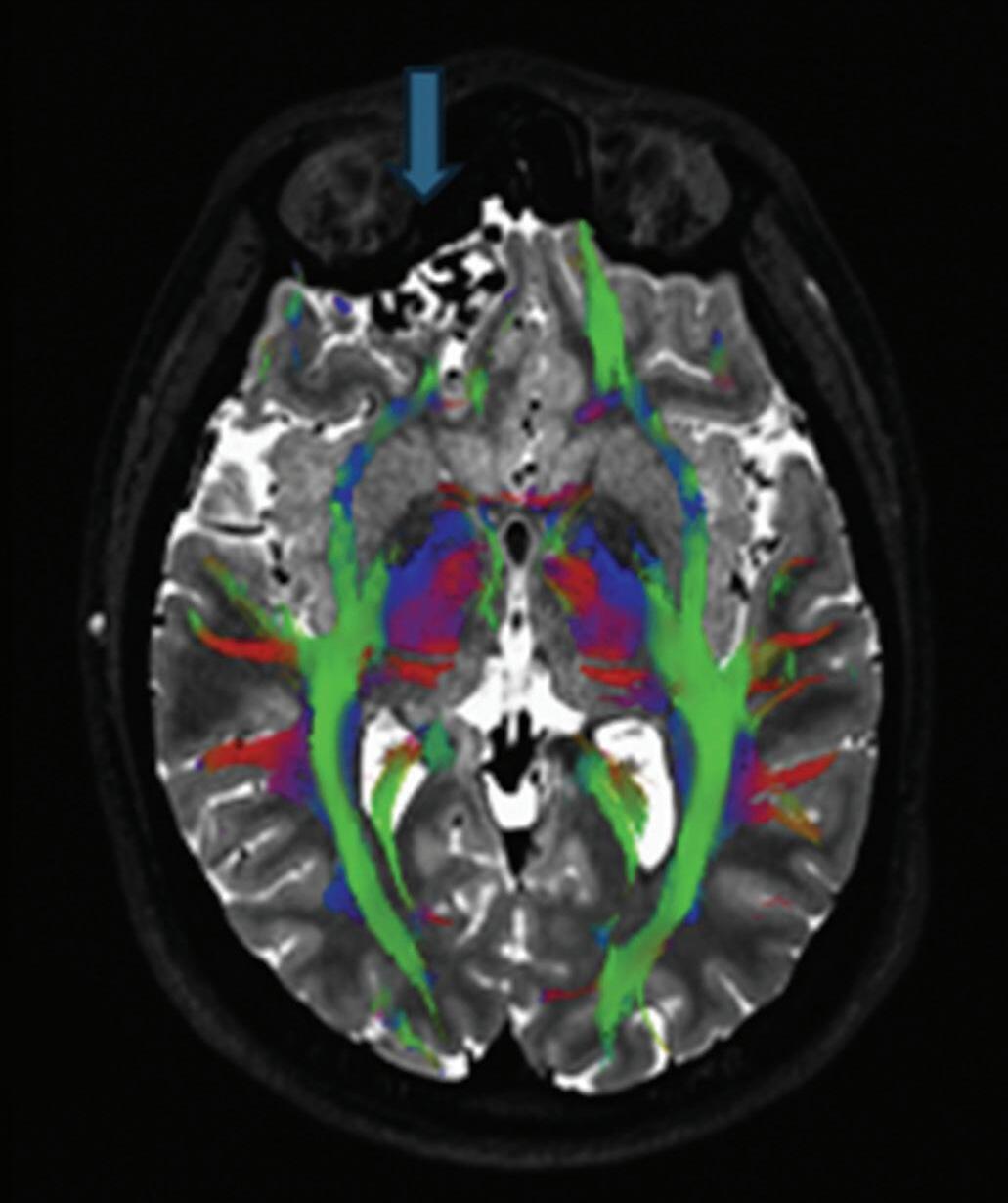

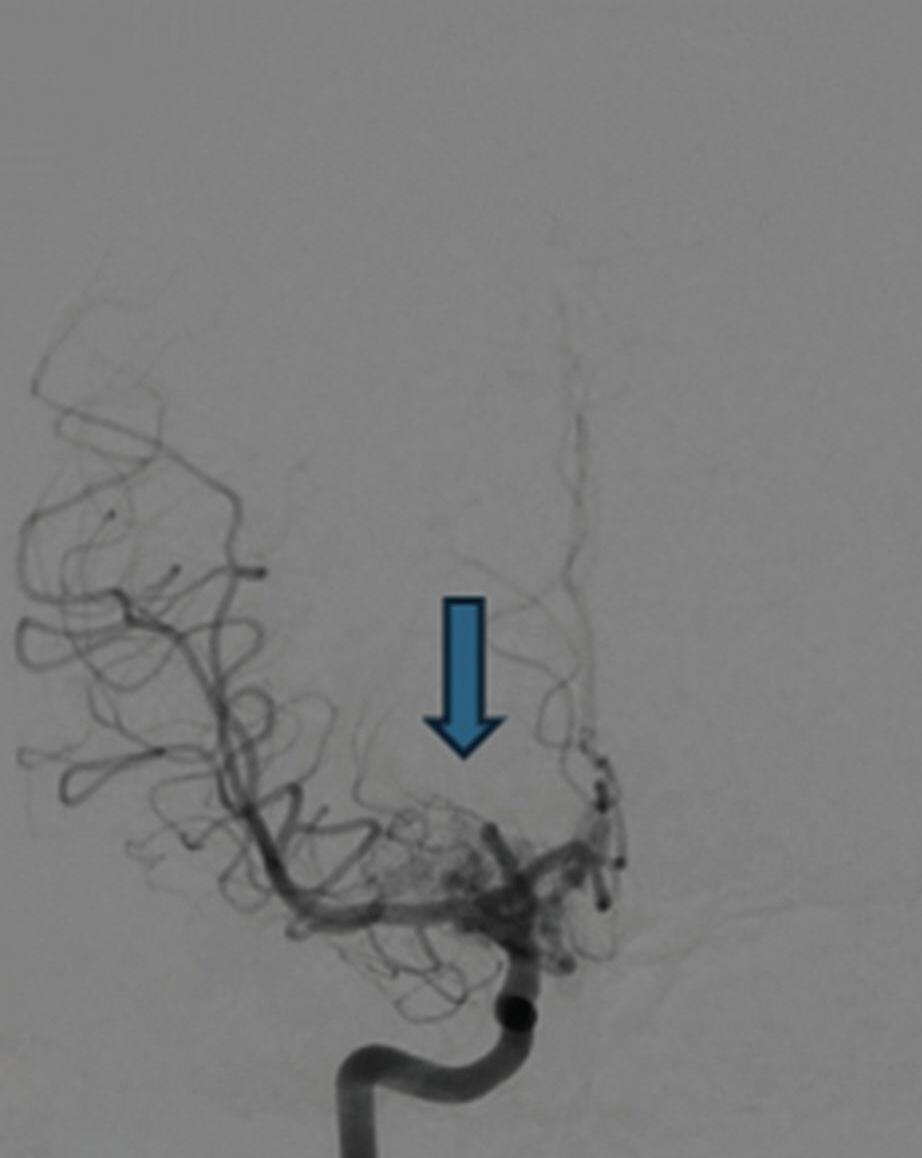



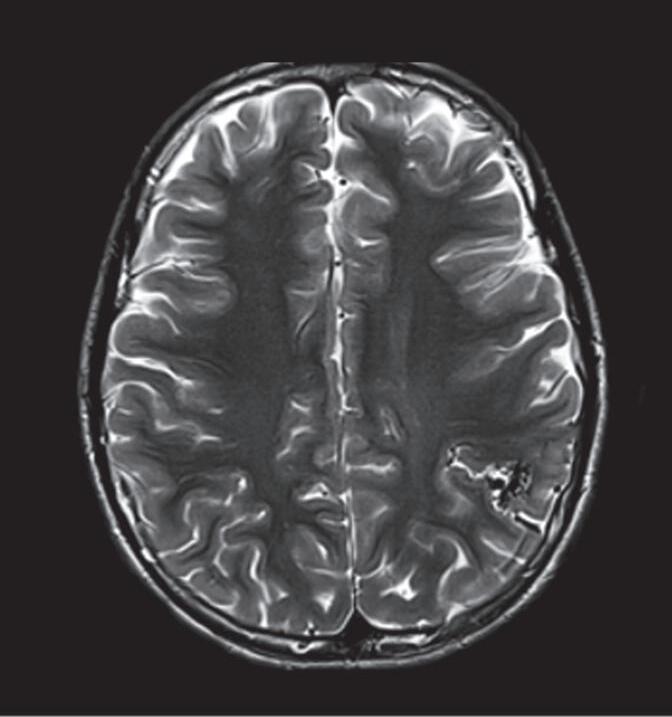
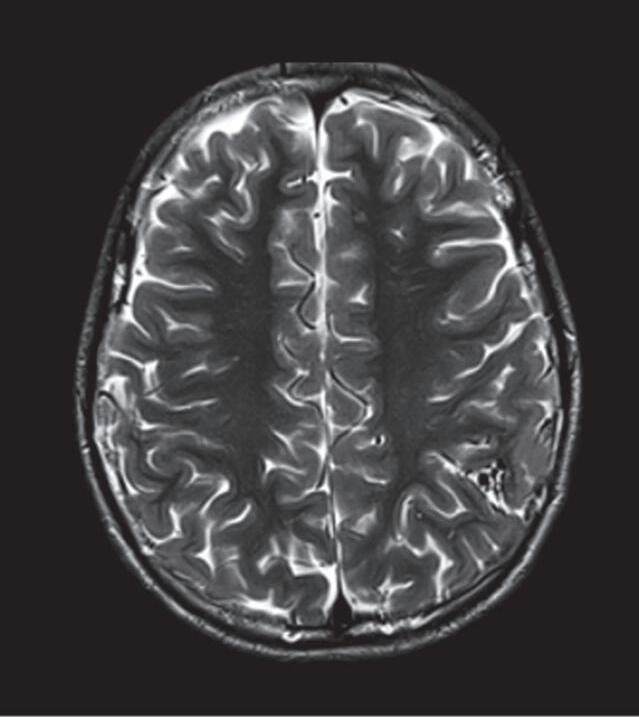
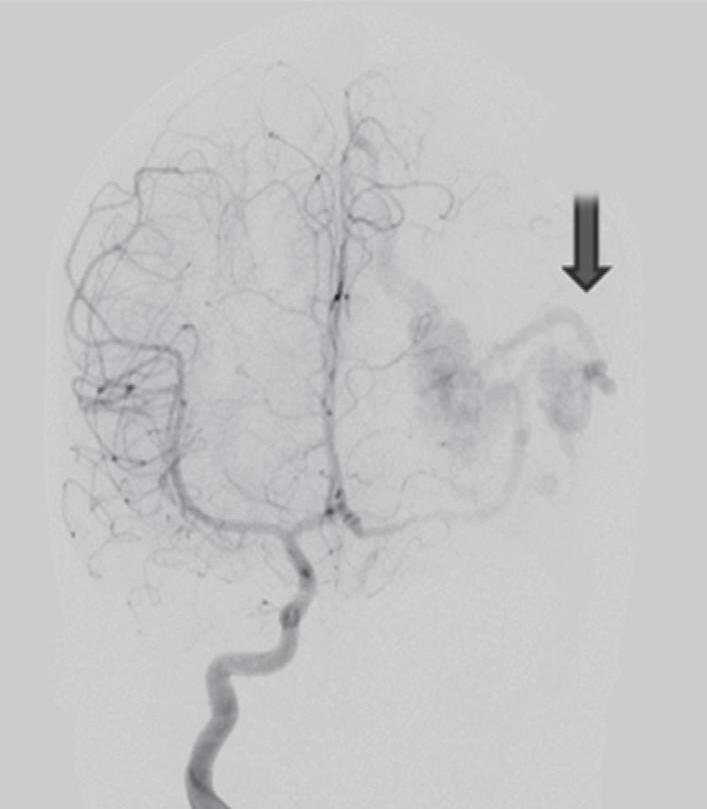
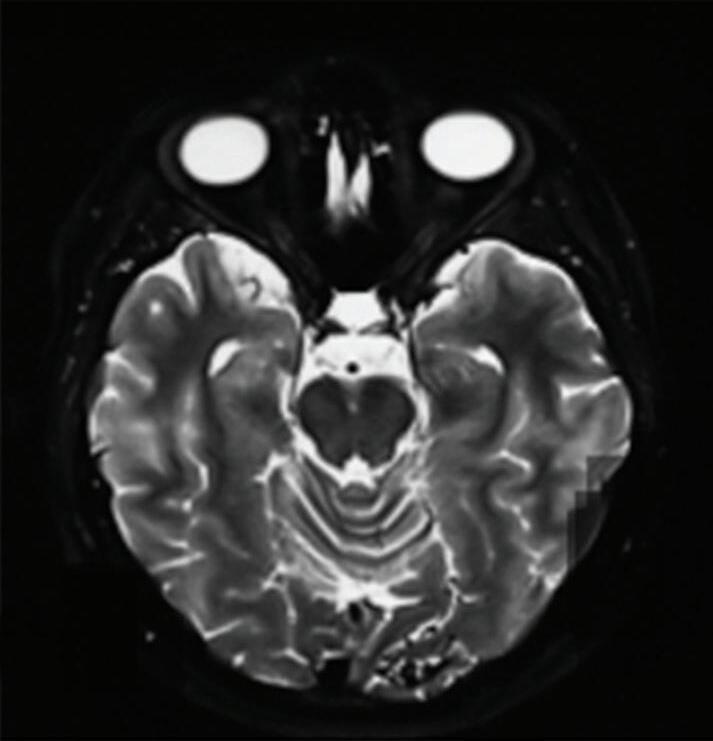
Fig. 1-9. RNM T2 em cortes (a) axial e (b) sagital. (c,d) Tractografia axial – sagital, demonstrando a posição de uma MAV não rota localizada na superfície basal do lobo frontal, nos giros orbitários e reto à direita (setas longas). Arteriografia digital cerebral com injeção de contraste via carótida direita, (e) AP e (f) em perfil demonstrando MAV nutrida por ramos da artéria cerebral média e cerebral anterior direita e drenagem para o seio sagital superior (seta curta).
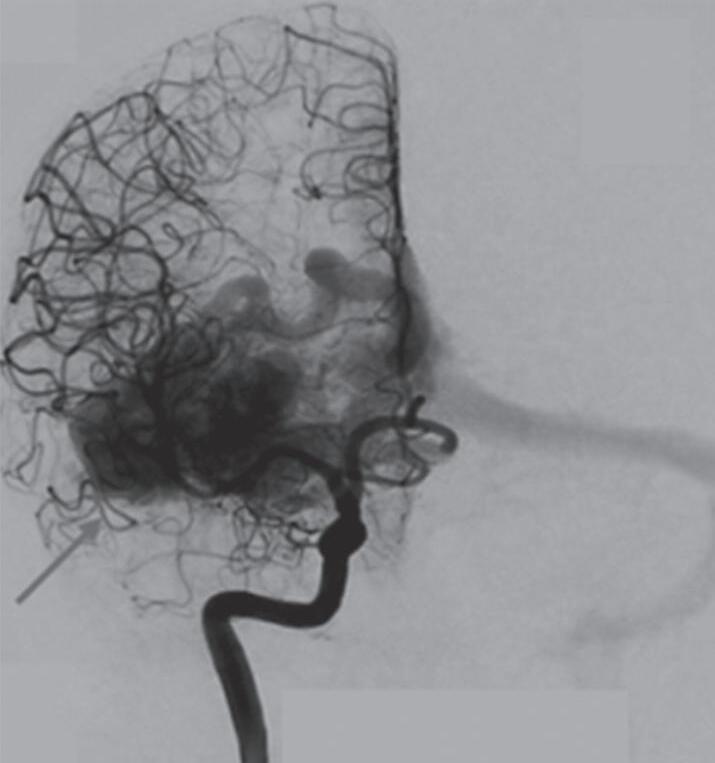
Fig. 1-10. Ressonância magnética em corte axial (a,b) e arteriografia digital (c,d) demonstrando uma MAV pial localizada na região parieto-occipital direita, irrigada por ramos da artéria cerebral média. RNM T2 axial (e) e T1 (f) sem contraste e arteriografia cerebral (g,h) demonstrando uma MAV não rota subcortical localizada no giro pós-central esquerdo, nutrida por ramos da artéria calosomarginal e cerebral média esquerda. RNM T1 em contraste axial-sagital (a,b) e arteriografia cerebral AP-P (k,l) demonstram MAV paraventricular, localizada no átrio ventricular, nutrida por ramos da artéria cerebral média.

A classificação de Spetzler-Martin é de grande valor clínico e foi um marco na história da neurocirurgia vascular, pois ainda auxilia os profissionais, mesmo com suas limitações, a planejarem estratégias de tratamento. A decisão de tratar uma MAV envolve não apenas o risco de sangramento, mas também a possibilidade de dano neurológico permanente, o que comprometeria a autonomia e a qualidade de vida do indivíduo.28
Quadro 1-1. Classificação de MAV segundo Spetzler-Martin
Critério
Categoria
Descrição
A classificação de SM considera os seguintes aspectos da MAV: tamanho, localização em área eloquente ou não é o padrão de drenagem venosa (Quadros 1-1 e 1-2).27
Com relação ao tamanho, as MAVs são classificadas em pequenas (diâmetro inferior a 3 cm), médias (diâmetro entre 3 e 6 cm) e grandes (diâmetros acima de 6 cm), demonstradas na sequência da Figura 1-11.26
1. Tamanho (A) A1 (pequeno) MAV com diâmetro menor que 3 cm. Tratamento mais fácil; menor risco de sangramentos 1
A2 (médio) MAV com diâmetro entre 3 e 6 cm. Maior risco de sangramento; abordagem mais cautelosa 2
A3 (grande) MAV com diâmetro maior que 6 cm. Alto risco de sangramento; tratamento complexo, envolvendo técnicas combinadas 3
2. Localização (B) B1 (área não eloquente) Localizada na cortical ou em áreas acessíveis. Menor risco; tratamento mais direto 0
B2 (área eloquente) Localizada em áreas centrais, como tronco encefálico. Acesso difícil; maior risco de complicações 1
3. Drenagem venosa (C) C1 (superficial) Drenagem para veias corticais superficiais. Menor risco de sangramento; tratamento menos complexo 0
C2 (profunda) Drenagem para veias profundas do cérebro. Risco elevado de complicações; tratamento mais desafiador 1 Quadro 1-2. Escala de classificação suplementar

Em geral, quanto maior a malformação, maior será o número de vasos nutridores, o volume do fluxo, o grau do roubo de fluxo nas áreas adjacentes e a complexidade.
São apontadas como áreas eloquentes, as áreas primárias sensitivas, as motoras, a linguagem, o córtex visual, o tálamo, o hipotálamo, a cápsula interna, o tronco cerebral, os pedúnculos cerebelares e os núcleos cerebelares profundos.27
São consideradas como drenagem venosa superficial, aquela que é oriunda do sistema venoso cortical, e drenagem venosa profunda, a que é oriunda das veias cerebrais internas, da veia basal de Rosenthal ou a veia cerebelar pré-central. Ver exemplo na Figura 1-12.27
Os principais fatores relacionados com a dificuldade de ressecção das MAV incluem o tamanho, o número de artérias nutridoras, a quantidade de fluxo sanguíneo através da lesão, o grau de roubo de fluxo do cérebro normal circundante, a topografia, a eloquência do cérebro adjacente e o padrão de drenagem venosa. Criar um sistema de classificação baseado em todas as variáveis acima citadas seria muito complicado para uso prático. Contudo, estudos relativos ao tratamento das MAV relatam que muitos destes fatores estão inter-relacionados, permitindo-nos simplificar o processo de classificação às três variáveis citadas anteriormente (tamanho, localização em área eloquente ou não é o padrão de drenagem venosa).27 O Quadro 1-1, demonstra a classificação de Spetzler-Martin.
A soma dos pontos de cada um desses três critérios resulta em uma pontuação total, que ajuda a determinar a gravidade da MAV e, assim, a abordagem terapêutica a ser instituída. Cada grupo da classificação de Spetzler-Martin demonstra graus variáveis de risco e complexidade, com implicações diretas na escolha do tratamento. A seguir, exemplos de cada um dos cinco graus desta classificação: grau 1 (Fig. 1-13), grau 2 (Fig. 1-14), grau 3 (Fig. 1-15), grau 4 (Fig. 1-16), grau 5 (Fig. 1-17). A classificação de EM pode gerar uma combinação de resultados e ser utilizada para nortear o tratamento. Apesar de ter sido, na época, um grande avanço na avaliação e no tratamento das MAVs cerebrais, a classificação de Spetzler-Martin necessitou ser modificada, em virtude dos avanços no diagnóstico e no tratamento dessas lesões. Em 2010, Lawton propôs essa mudança objetivando facilitar mais ainda a tomada de decisão terapêutica das MAVs.28 Assim, o novo sistema possibilita uma melhor análise do padrão de drenagem venosa, por exemplo. Então, com base nesse critério, malformações de pequeno tamanho localizadas em áreas não eloquentes, com drenagem venosa profunda, são mais complexas de tratar do que as MAVs grandes, localizadas em áreas eloquentes, porém sem comprometimento da drenagem venosa ou que apresentem um sistema de drenagem
venosa alternativo. Essa modificação de Lawton trouxe, portanto, a possibilidade de ampliar o leque de indicações no tratamento das MAVs anteriormente consideradas intratáveis; em contrapartida, sua classificação reforça a necessidade de um maior cuidado e critério na indicação de tratamento para as MAVs pequenas, de fácil acesso, porém com padrão de drenagem venosa considerado complexo (Quadro 1-2).28
Segundo este autor, a idade do paciente, a apresentação hemorrágica, a compactação do nidus e o suprimento arterial perfurante profundo, também são fatores importantes a serem considerados na seleção dos pacientes para a indicação do tratamento microcirúrgico; sendo a sua classificação um sistema complementar e não um substituto ao proposto por Spetzler-Martin.28
Embora a modificação de Lawton tenha mantido a divisão original em cinco grupos (I a V), ela possibilita uma maior personalização na avaliação do risco, especialmente com a introdução do novo critério C3 para MAV com drenagem venosa não comprometida. Além disso, também oferece uma maneira mais assertiva em determinar o risco de sangramento e a complexidade do tratamento, facilitando assim a decisão entre tratamentos como cirurgia, embolização e radiocirurgia.28
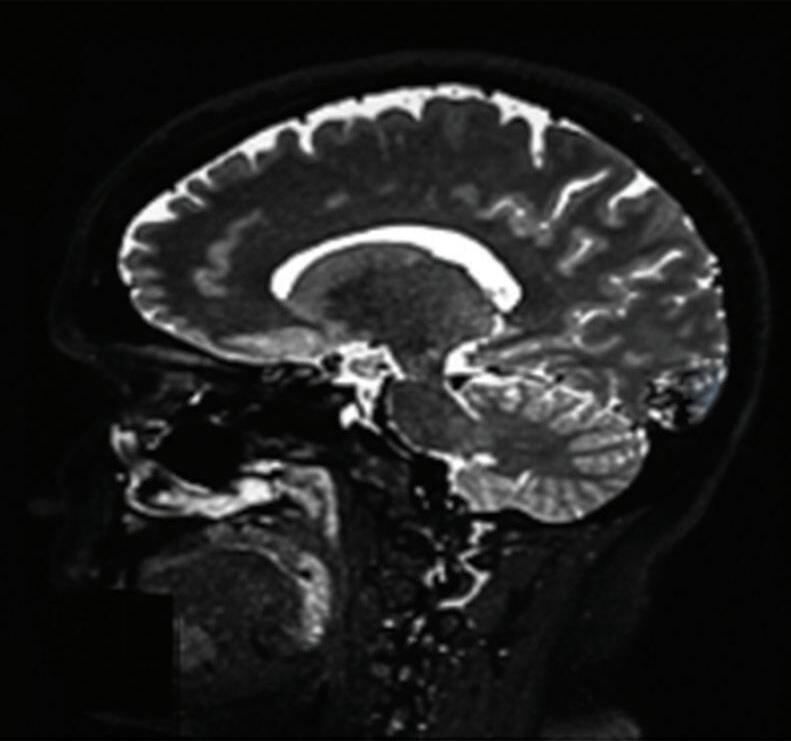
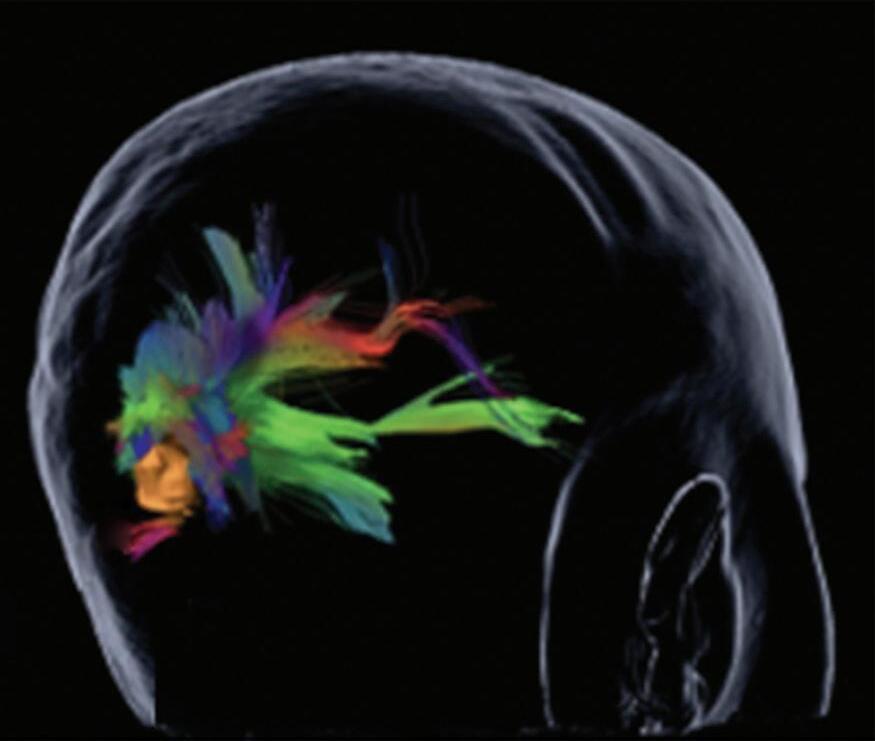

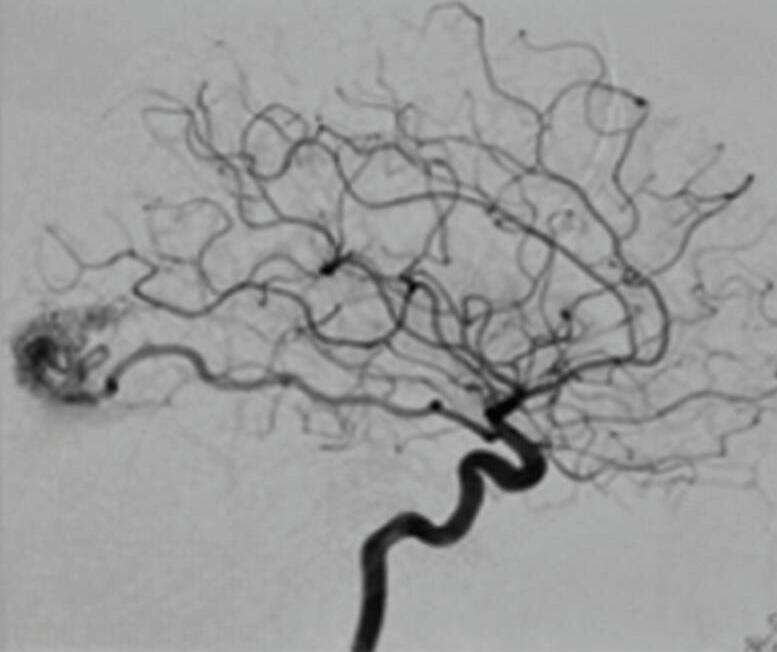
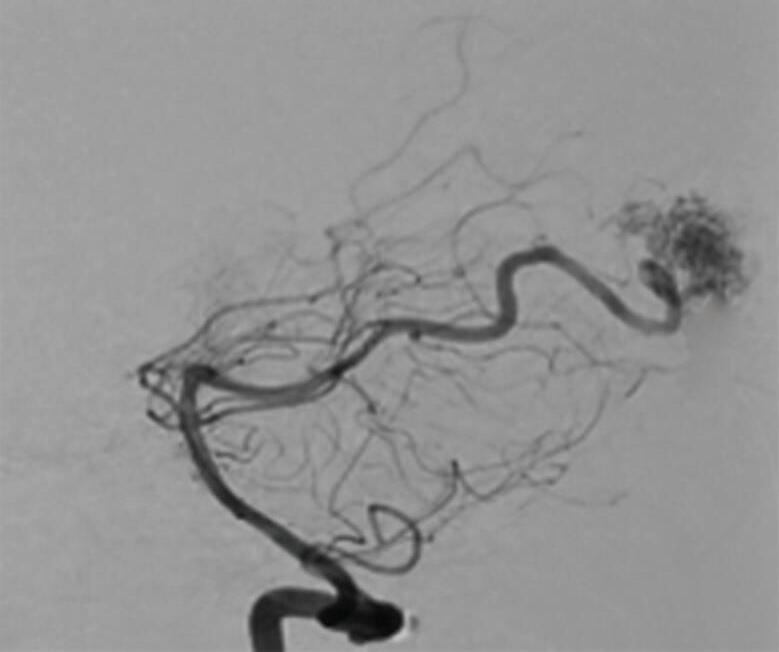
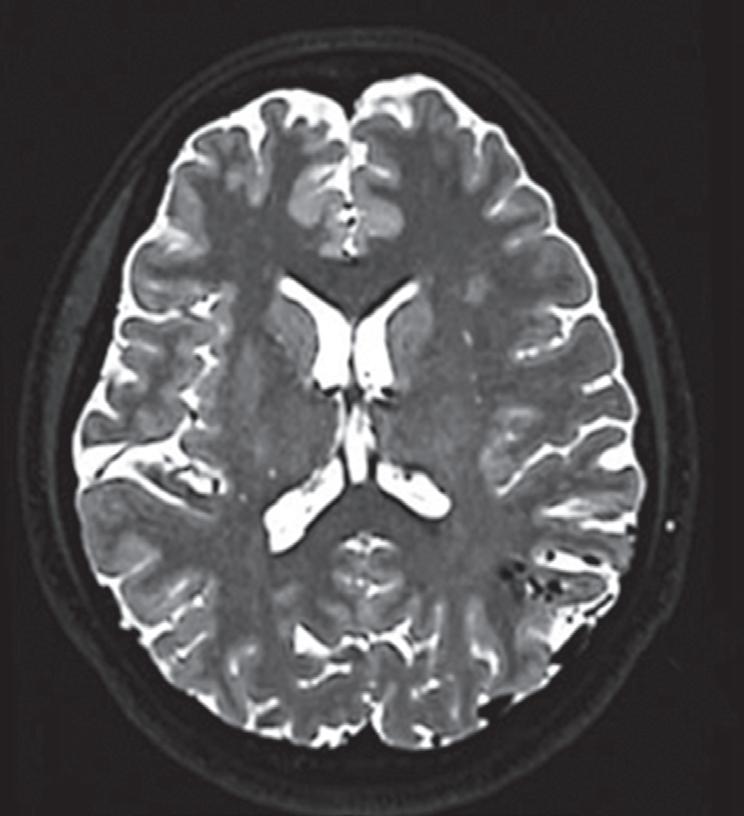
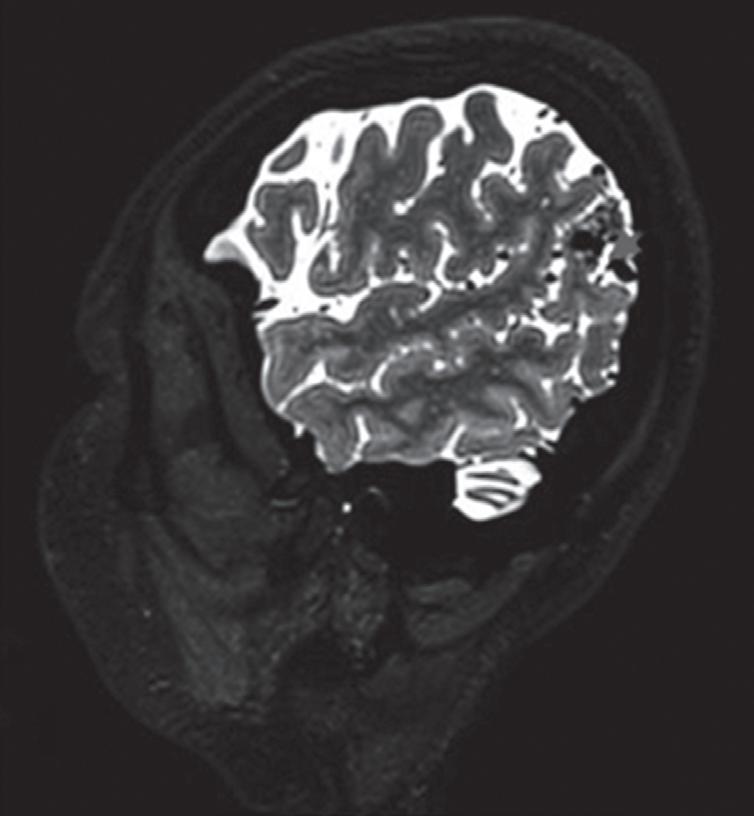

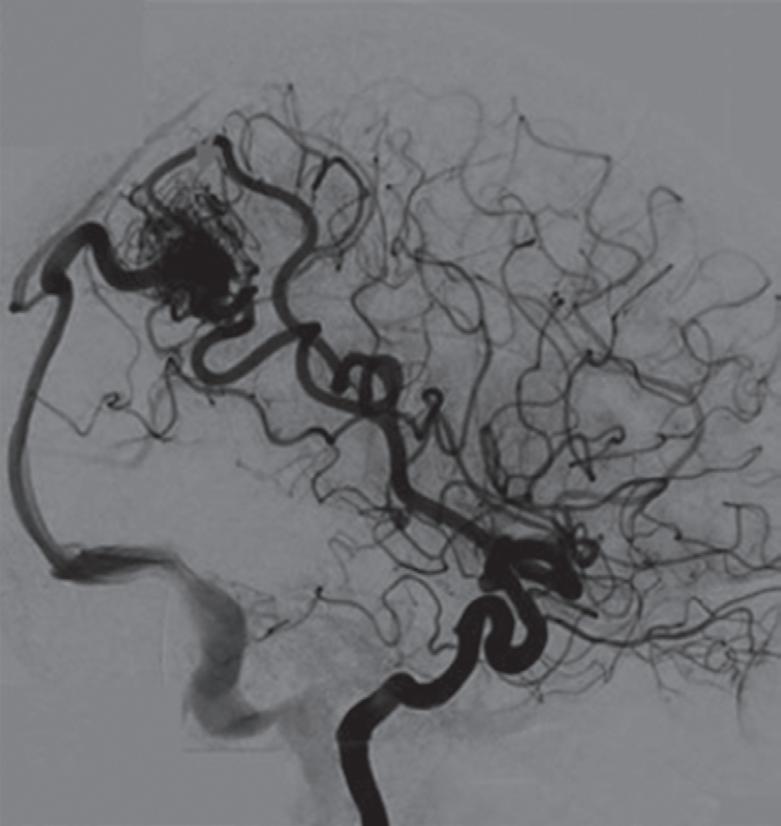
Fig. 1-14. RNM encéfalo, T2 axial (a) e coronal (b), demonstrando MAV grau 2 no lobo parietal esquerdo.
Arteriografia cerebral (c) AP e (d) em perfil, demonstrando a irrigação pelos ramos da artéria cerebral média (ACM) e anterior (ACA), com drenagem pela veia de Labbé, no seio transverso sigmoide.
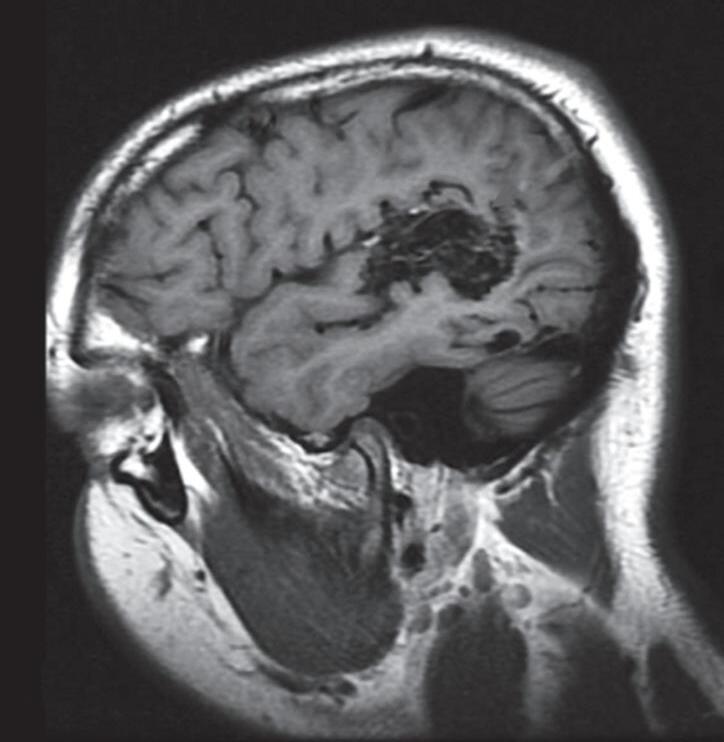
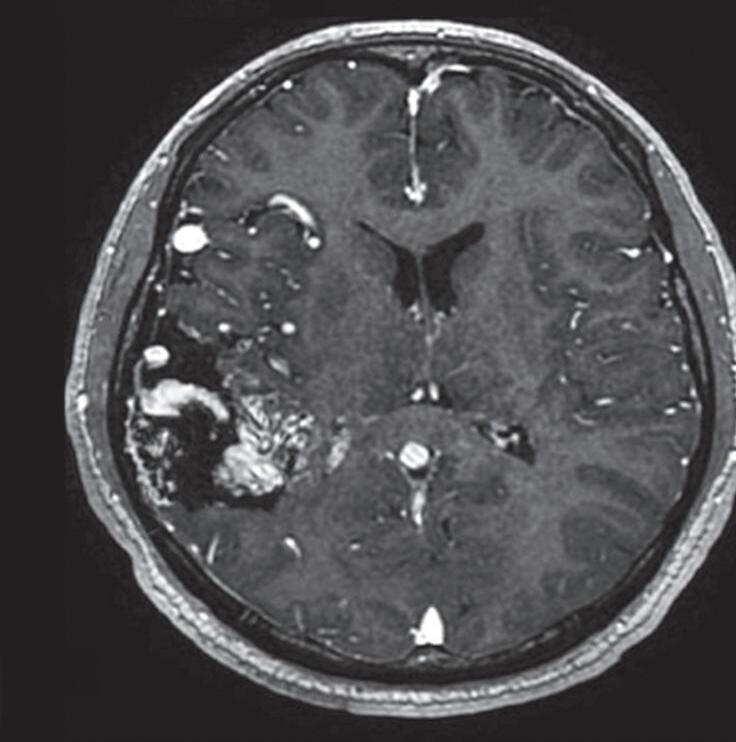

Fig. 1-15. RNM encéfalo T1 (a) sagital sem contraste e (b) axial com contraste demonstrando MAV grau 3, parcialmente embolizada, localizada no giro temporal superior e lobo parietal direito. (c) Arteriografia cerebral em perfil, demonstrando a irrigação pelos ramos da artéria cerebral média e posterior, com drenagem superficial nas veias de Labbé até o seio sigmoide, e o complexo de Trolard no seio sagital superior. O nidus da MAV está demonstrado pelas setas azuis grandes e a drenagem venosa pelas pontas de setas.
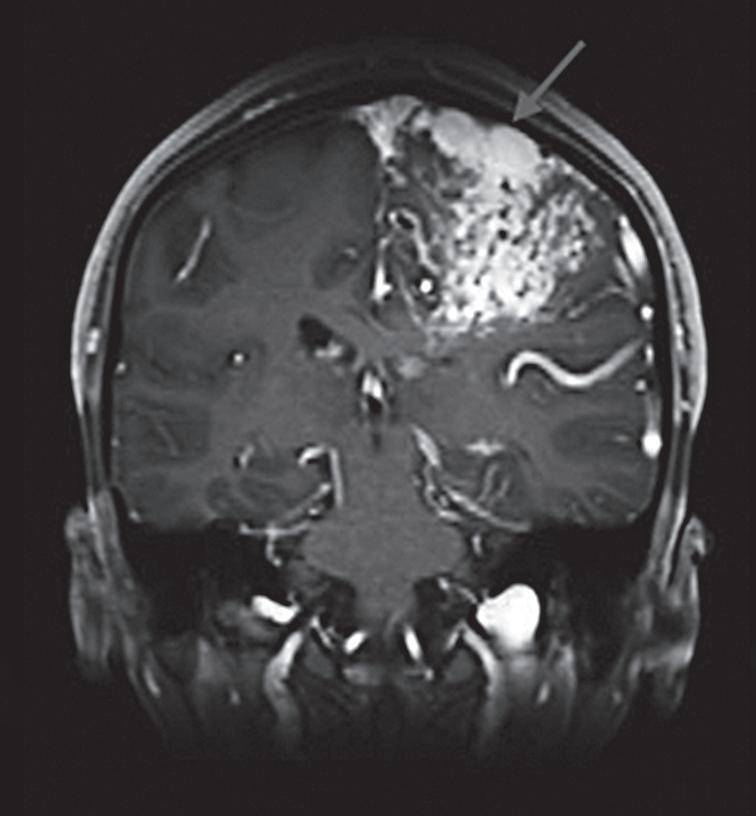
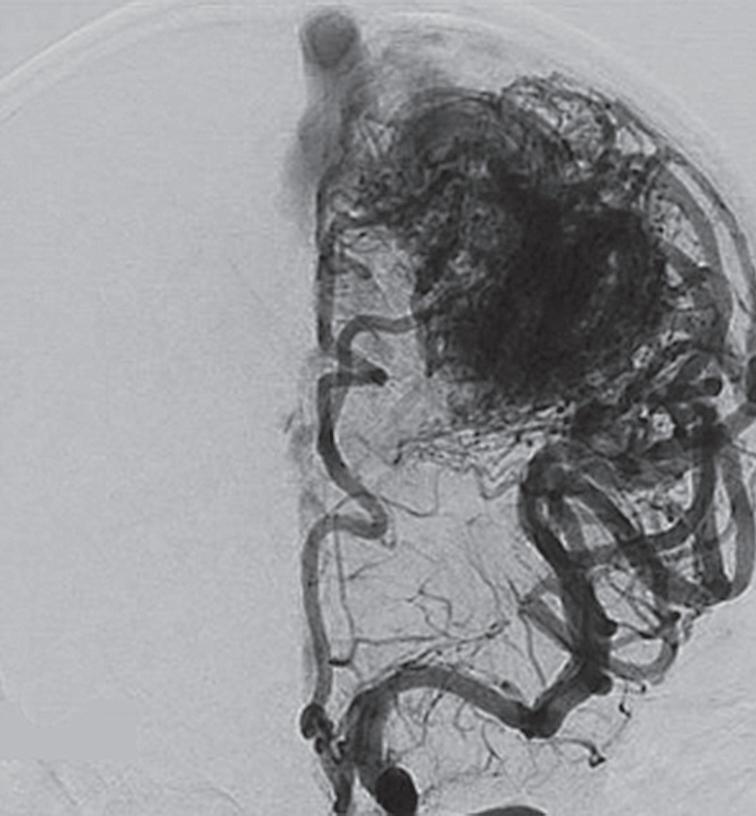
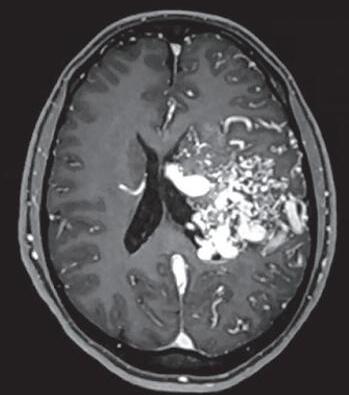
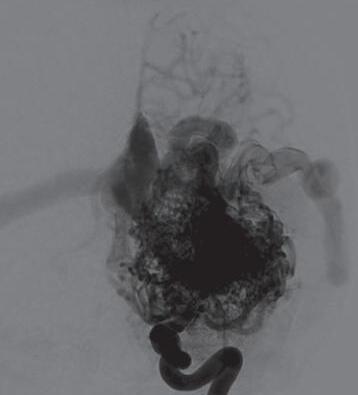


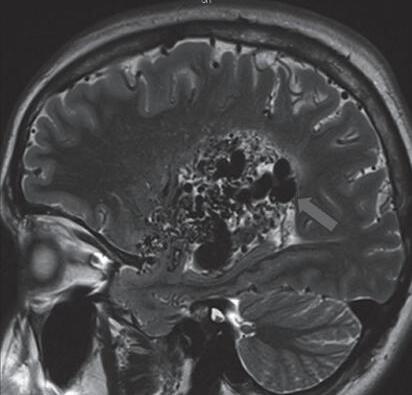

Fig. 1-16. RNM encéfalo T1 com contraste: (a) Coronal e (b) axial demonstrando MAV grau 4 frontoparietal esquerda. (c,d) Arteriografia cerebral AP mostrando a irrigação pelos ramos da cerebral anterior e média esquerda, além da cerebral anterior direita, com drenagem superficial para o seio sagital superior. Seta azul apontando para o nidus da MAV.
Fig. 1-17. RNM encéfalo T1 com contraste (a) axial e (b) T2 sagital demonstrando MAV grau 5 profunda temporoinsular esquerda com extensão nos núcleos da base. (c,d) Arteriografia cerebral,demonstrando a drenagem venosa profunda para veia cerebral interna (seta azul) com sinais de hipertensão.
O Quadro 1-3 apresenta um resumo das classificações citadas anteriormente, para facilitar a sedimentação do conteúdo.
De Oliveira et al., também propuseram modificação na escala de Spetzler-Martin, subdividindo o grupo III em três subgrupos III A (MAV de grau III de tamanho grande) e III B (MAV de grau III pequenas situadas em áreas eloquentes e giro do cíngulo), e MAV grau III C (MAV pequenas da região dos núcleos da base) visando, por meio deste ajuste pontual, agregar mais informações que facilitem a tomada de decisão terapêutica microcirúrgica; além disso destacaram a importância da abordagem multidisciplinar com a integração, quando necessário, de técnicas microcirúrgicas, endovascular (embolização) e a radiocirurgia. Estes autores concluem no seu trabalho a seguinte estratégia de tratamento para as MAVs: cirurgia para graus I e II, embolização combinada com cirurgia para grau III A, cirurgia para grau IIIB, radiocirurgia para grau III C e conservadora para graus IV e V.29
Contrariando o estudo ARUBA, acreditamos que o tratamento das MAVs pode alcançar melhores resultados quando comparado com a história natural da doença, desde que seja conduzido por um grupo bem treinado de especialistas liderados por um neurocirurgião vascular experiente. 29-31 Nosso serviço concorda com esta filosofia e a aplica sistematicamente, agregando equipe multiprofissional na abordagem do tratamento das MAVs (neurologistas, neurorradiologistas, radiointervencionistas e neuropsicólogos). Rotineiramente, todo paciente que é submetido a tratamento da MAV tem avaliação neuropsicológica pré e pós-tratamento. 32,33
Não há consenso acerca da infalibilidade e da segurança do estudo ARUBA, pois o mesmo foi desenhado como se descreve a seguir:
A) Tempo de seguimento curto: o seguimento médio foi de apenas 33 meses (cerca de 2,75 anos), o que é considerado curto para analisar o comportamento de uma patologia crônica como as MAVs.34 Como o risco de ruptura espontânea das MAVs aumenta ao longo do tempo, muitos especialistas argumentam que um
Quadro 1-3. Algumas Classificações das MAVs
Características da angioarquitetura
Localização
seguimento mais longo poderia demonstrar benefícios do tratamento intervencionista.30,34
B) Heterogeneidade dos tratamentos no grupo intervencionista: os pacientes do grupo tratado receberam diferentes modalidades de intervenção (cirurgia, radiocirurgia, embolização ou combinações) sem uma padronização clara, isso pode significar que os resultados desfavoráveis do grupo tratado podem ter sido influenciados por abordagens menos eficazes e ou por intervenções de maior risco. Alguns especialistas, assim como nosso serviço, argumentam que estratégias individualizadas para cada paciente, conduzidas por centros com experiência podem trazer melhores desfechos.24,29-31
C) Critérios de seleção dos pacientes: o estudo excluiu as MAVs que já estavam em tratamento e pode ter incluído casos com menor risco de sangramento espontâneo, favorecendo o grupo de manejo clínico, além disso, este estudo não diferenciou as MAVs com padrões anatômicos de maior risco, como aquelas com drenagem venosa profunda ou com aneurismas associados. Inúmeros especialistas argumentam que pacientes com MAV de alto risco, deveriam ser tratados, mesmo que assintomáticos.24,34
D) Falta de experiência e variabilidade nos centros participantes: o estudo envolveu 39 centros com diferentes níveis de experiência, e alguns locais podem não ter utilizado técnicas ideais ou cirurgiões experientes para tratar as MAVs. Alguns centros de referência, assim como o nosso, argumentam que com equipes experientes, os riscos do tratamento podem ser reduzidos significativamente.29-31
E) O Grupo de tratamento incluía pacientes com MAVs pequenas e de baixo risco: algumas MAVs pequenas e superficiais podem ser tratadas com risco relativamente baixo, especialmente por microcirurgia. O estudo ARUBA não diferenciou claramente os subgrupos que se poderiam beneficiar da intervenção, fortalecendo a ideia dos especialistas que defendem a conduta de tratar MAVs pequenas e acessíveis, a fim de evitar sangramento futuro.29-31,34
Formas de classificação de MAV
Locais ou difusas
Parenquimatosas, durais e mistas
Classificação de Spetzler-Martin I, II, III, IV, V
Classificação suplementar – Lawton I, II, III, IV, V + idade, apresentação, difusão nidal e suprimento arterial perfurante profundo Fluxo Alto ou baixo
Apresentação clínica
Rotas ou não rotas. Não rotas: sintomáticas ou assintomáticas
RISCO
Clinicamente, as MAVs apresentam uma ampla gama de sintomas neurológicos (Quadro 1-4),2,13,35 incluindo cefaleia, convulsões, déficits cognitivos e neurológicos focais e distúrbios comportamentais. A apresentação clínica e a gravidade dos sintomas estão diretamente relacionadas com fatores como a angioarquitetura, o tamanho e a localização, bem como as alterações hemodinâmicas associadas à malformação.36,37
O curso natural das MAVs é altamente variável, enquanto algumas permanecem estáveis ao longo do tempo, outras podem crescer, aumentando o risco de complicações, outras podem até involuir espontaneamente no decorrer dos anos, embora existam poucos relatos na literatura acerca deste último comportamento.38 Embora algumas MAVs possam permanecer assintomáticas por longos períodos, especialmente as não rotas, sabe-se que as alterações estruturais e hemodinâmicas progressivas que ela propicia, podem levar ao surgimento de sintomas neurológicos outros antes da sua ruptura.36,39,40 Não há um consenso na literatura com relação ao tamanho da MAV e o risco de sangramento. Alguns autores acreditam que o risco de sangramento aumenta proporcionalmente ao tamanho em associação a características específicas de sua angioarquitetura (alta pressão venosa intranidal e a presença de aneurismas arteriais pré e intranidais). Em contrapartida, outros autores relacionam nidus menores de 3 cm como fator preditor independente para hemorragia intracraniana ou o mesmo em associação à drenagem venosa profunda.36,39,40
Aproximadamente 18% dos pacientes com MAV têm aneurismas associados, os quais podem ser intra, pré e pós-nidais (Figs. 1-18 a 1-20). A presença de aneurisma, especialmente o intranidal, potencializa o risco de sangramento; estes estão localizados frequentemente nas áreas de alto fluxo sanguíneo, como na topografia das artérias nutridoras da malformação.28,39,40
A apresentação clínica mais comumente relatada nas MAV é o acidente vascular cerebral hemorrágico, cerca de 41-79% dessas malformações estão associadas a hemorragia intracraniana, as quais são apontadas como a segunda causa mais frequente de
Quadro 1-4. Alguns sintomas associados às MAVs cerebrais Manifestações clínicas das MAVs cerebrais
Hemorragia intracraniana: 20-50%
Todos AVCs: 1-2%
AVC adulto jovem: 3%
Crises epilépticas/não rotas: 8%
Crises epilépticas/rotas: 23%
Déficits focais: 23%
sangramento intracraniano; sendo o aneurisma cerebral a primeira causa. Além disso, elas são responsáveis por cerca de 10% de todos os casos de hemorragia subaracnóidea. Segundo alguns autores, as crianças têm maior probabilidade de apresentar hemorragia cerebral neste contexto do que os adultos.41
O sangramento geralmente é intraparenquimatoso, mas pode ocorrer inicialmente no espaço subaracnoide. Os sintomas relacionados com o sangramento intracraniano incluem perda da consciência, cefaleia intensa e súbita (thunderclap headache), náuseas e vômitos. Outros sintomas que podem ser transitórios ou permanentes, são secundários ao dano tecidual cerebral causado pela hemorragia cerebral. Dentre eles podemos citar: crises epilépticas, déficits motores, déficits sensitivos, déficits da linguagem, déficits cognitivos e ou comportamentais. Há relatos de casos específicos do comprometimento da linguagem, (síndrome do sotaque estrangeiro), que pode acontecer quando a MAV está localizada na parte posterior do giro frontal superior esquerdo.32,39,42
Os pacientes também podem manifestar déficits da leitura, escrita, audição, fala, atenção, controle inibitório, organização, cálculo e desenho; haja vista que alguns autores afirmam que as MAVs podem afetar a conectividade cerebral inteira e não apenas as áreas que estão situadas e as adjacentes.32,37,43
A cefaleia pode ser inespecífica nas MAV não rotas e desta forma nem sempre é um sintoma facilitador de diagnóstico.36 Entretanto há relatos na literatura de que as dores de cabeça relacionadas com elas são predominantemente não pulsáteis e ipsilaterais; além disso, descrevem em 80-97, 4% dos casos a topografia da dor com a localização das MAV no cérebro.13,36,40
As crises epilépticas podem estar presentes em 15-40% dos pacientes. Alguns estudos relatam que os fatores que aumentam o risco dessas crises são a localização cortical, as MAVs grandes, múltiplas e com drenagem superficial. Com relação à semiologia das crises, essas podem ser focais ou generalizadas secundariamente. Alguns estudos relatam que as MAVs do lobo temporal são responsáveis por crises epilépticas em 46% dos casos, enquanto as de outras regiões são responsáveis por 24%.20,35
Os déficits neurológicos progressivos podem ocorrer em 6-12% dos pacientes em um período variável de poucos meses a vários anos. A síndrome do roubo do fluxo tem sido correlacionada como a responsável por essas manifestações clínicas, porém, muitas vezes, essas são secundárias ao efeito de massa causado pela MAV, ao sangramento intracraniano ou às crises epilépticas de repetição. Dentre elas, podemos citar as hemiparesias, os distúrbios visuais, as hemi-hipoestesias e as afasias. Vale ressaltar que sangramentos pequenos podem não manifestar sintomas clínicos perceptíveis. 38,35,39
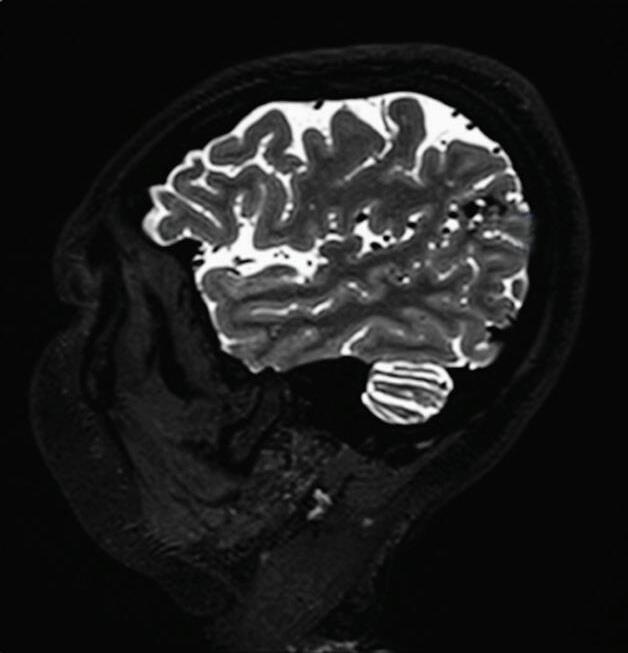
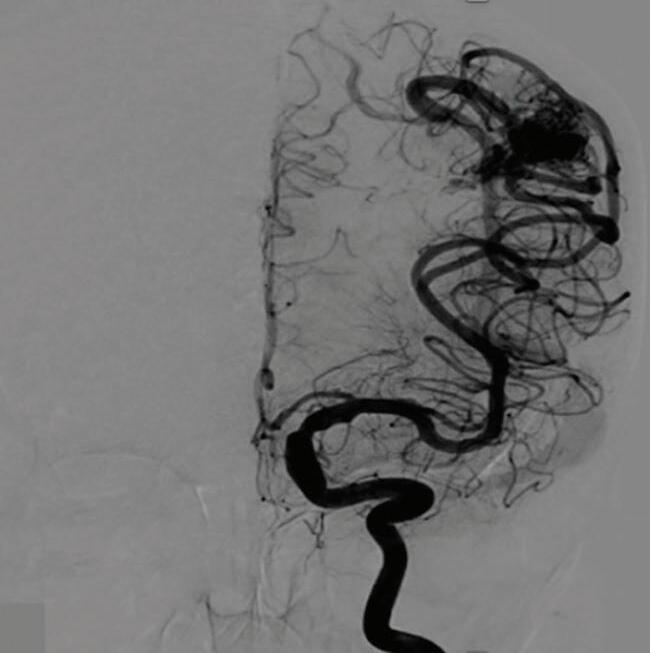

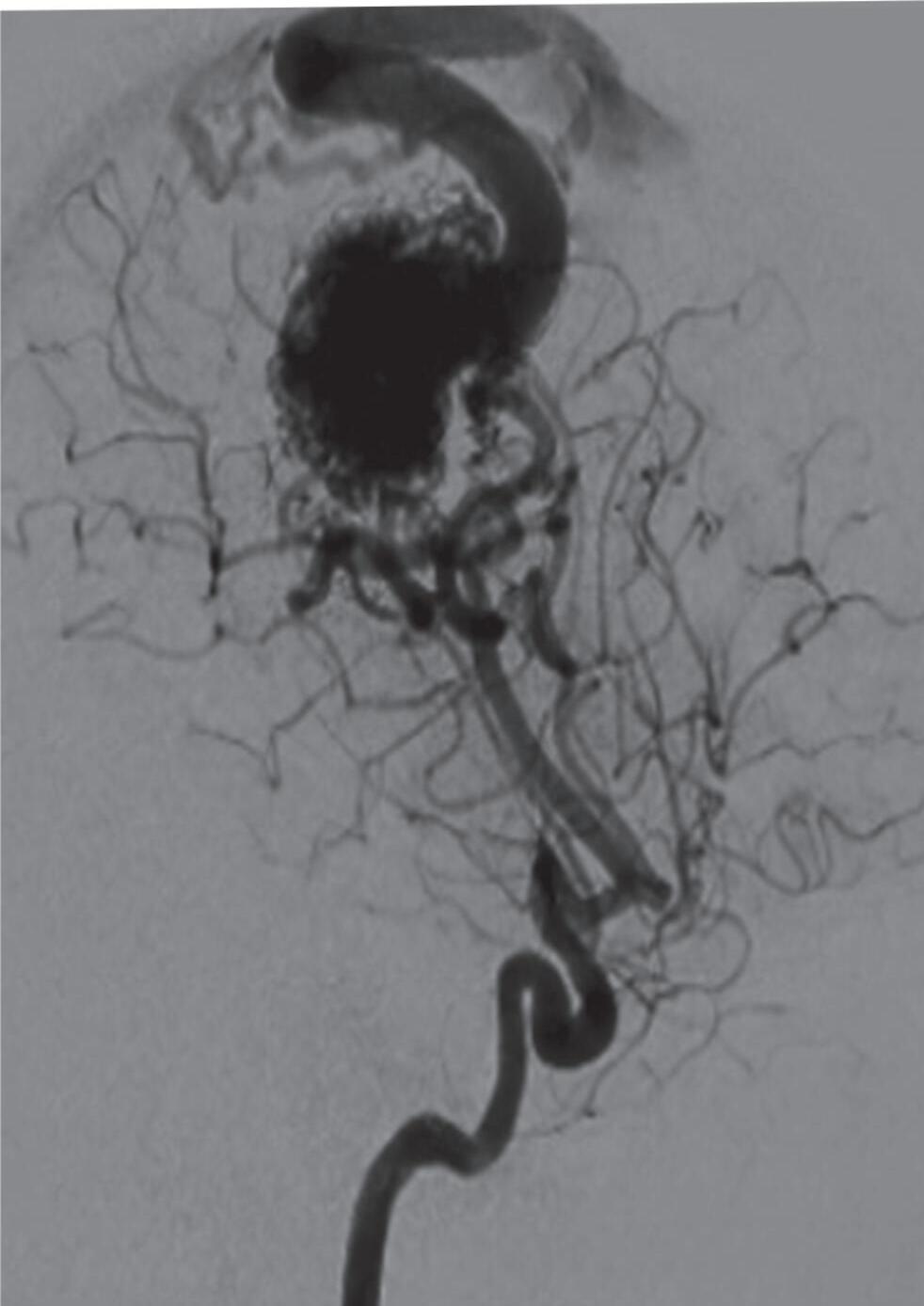
1-18. (a) RNM T2 corte sagital, (b) arteriografia digital em AP e (c) imagem intraoperatória demonstrando MAV do giro angular esquerdo com aneurisma pré-nidal (setas azuis).
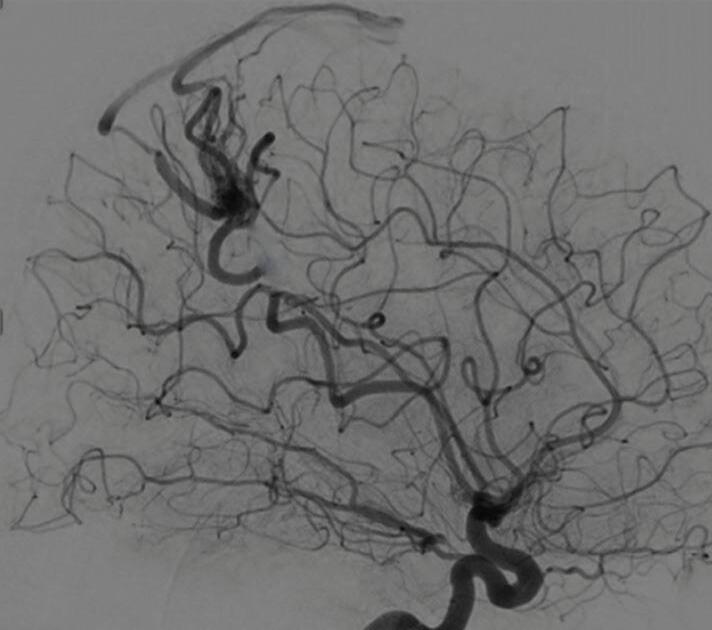
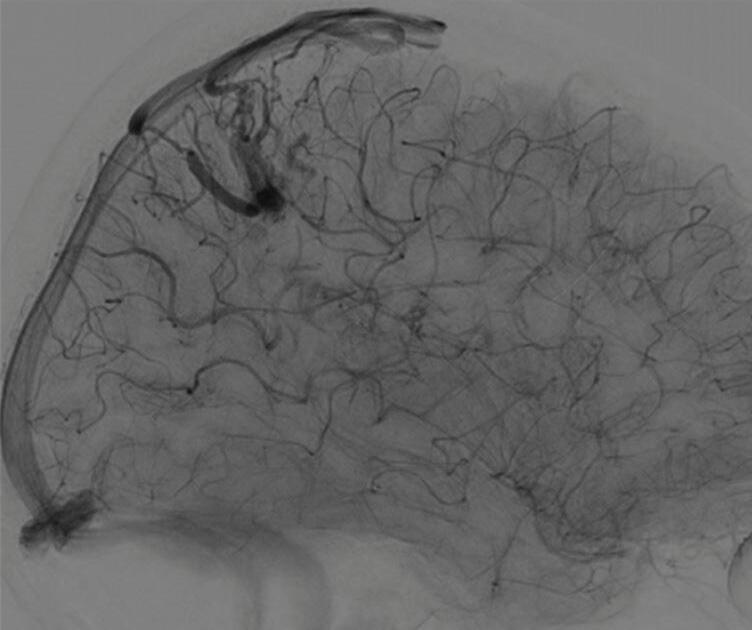

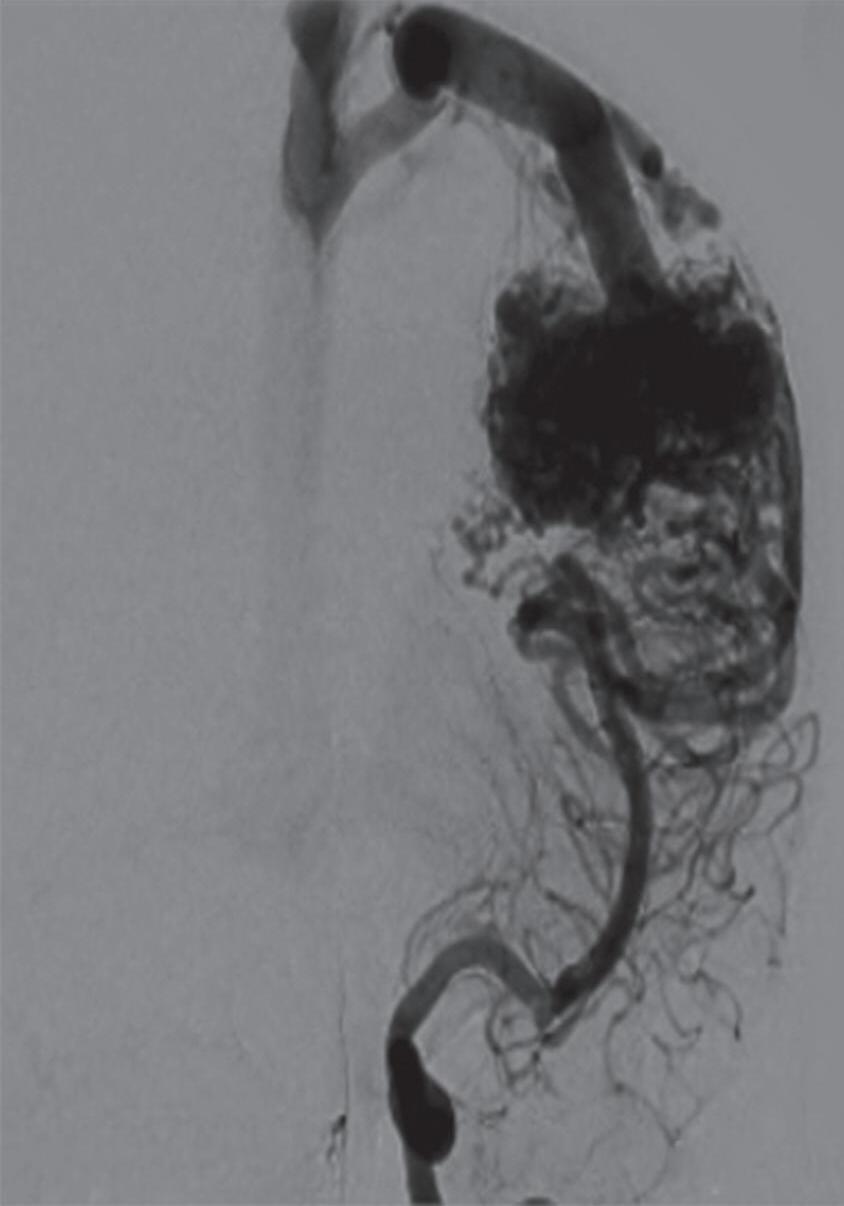
Fig. 1-19. Angiografia pré-operatória em: (a) perfil em fase arterial e (b) venocapilar demonstrando uma MAV no sulco intraparietal direito grau 2, nutrida por ramo da artéria cerebral média e calosa marginal, com drenagem venosa superficial para o seio sagital superior e com aneurisma nidal (setas azuis). (c) Visão intraoperatória do aneurisma intranidal.


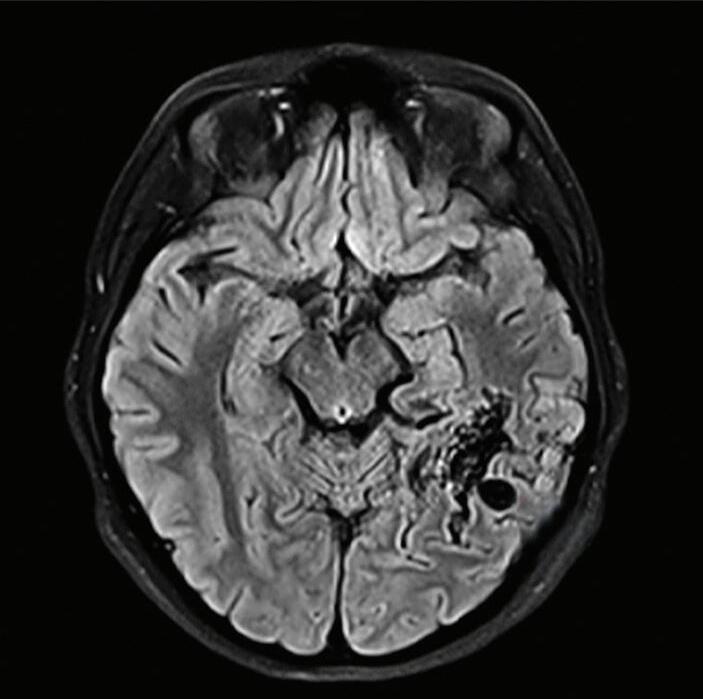
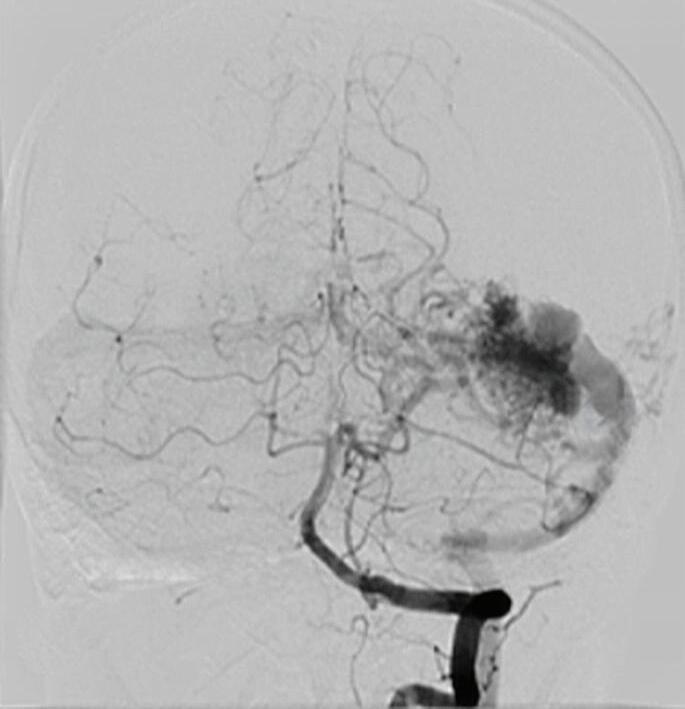
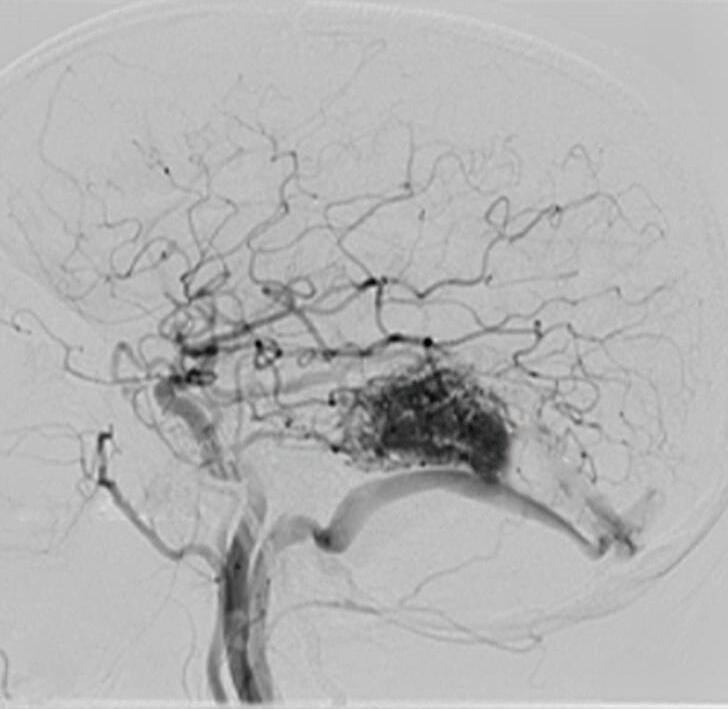
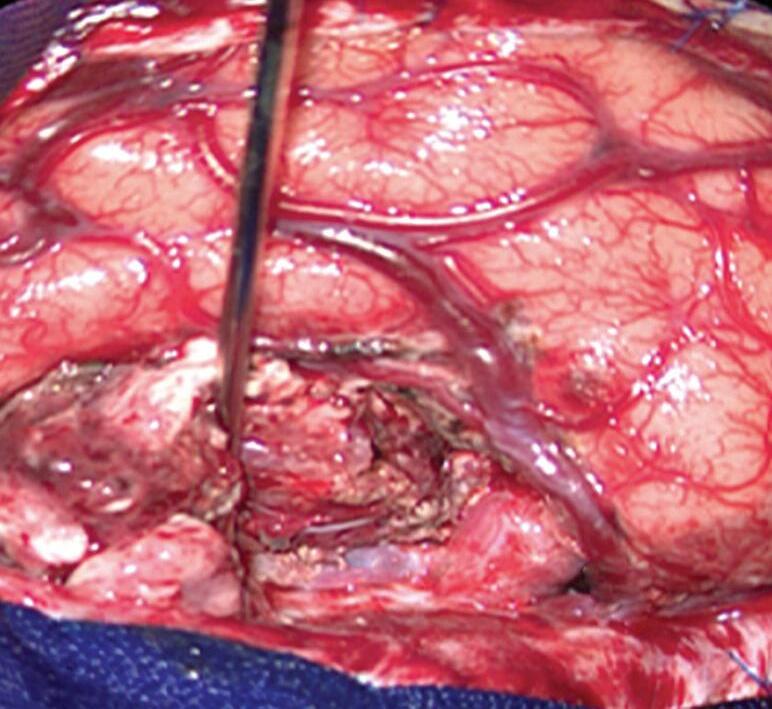
Fig. 1-20. RNM T1 com contraste em cortes (a) axial e (b) sagital e (c) FLAIR axial, demonstrando MAV do giro fusiforme esquerdo com presença do aneurisma pós-nidal (setas azuis). Angiografia pré-operatória em (d) AP e (e) em perfil mostrando a MAV anteriormente descrita, nutrida por ramos da artéria cerebral média e posterior esquerda, com drenagem superficial para o seio transverso e sigmoide ipsilateral e aneurisma pós-nidal venoso (setas azuis). (f) Visão intraoperatória do aneurisma pós-nidal (seta azul).
DIAGNÓSTICO
A suspeita diagnóstica das MAVs geralmente é feita por meio de métodos não invasivos de aquisição de imagem, tais como tomografia computadorizada (TC), angiotomografia, ressonância magnética (RNM) e angiorressonância, contudo, as informações anatômicas vasculares necessárias para o planejamento e a execução terapêutica demandam geralmente do estudo dinâmico da angioarquitetura da MAV pela arteriografia cerebral, considerado o exame padrão-ouro para o diagnóstico (Figs. 1-21 e 1-22).35
Em virtude de as manifestações clínicas não serem exclusivas das MAVs, a tomografia computadorizada do crânio sem contraste


é geralmente o primeiro exame realizado na investigação diagnóstica. Algumas alterações presentes nessa tomografia, associadas à história clínica do paciente podem direcionar a suspeição diagnóstica; são eles: pacientes jovens com hemorragia intraparenquimatosa lobar espontânea, sangramento inexplicável intraventricular ou subaracnóideo, presença de calcificações curvilíneas ou salpicadas, ou imagens serpiginosas espontaneamente hiperdensas, que podem corresponder a vasos anômalos integrantes do nidus, a veias de drenagem ou a artérias nutridoras dilatadas. Embora a angiotomografia possibilite uma melhor visualização das estruturas vasculares, a ressonância magnética em contrapartida, permite melhor

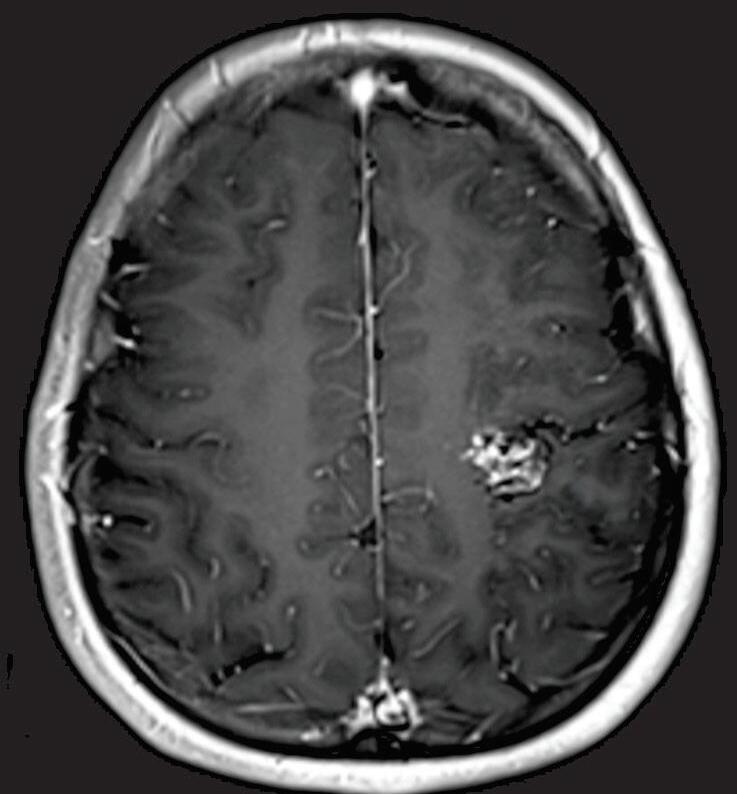
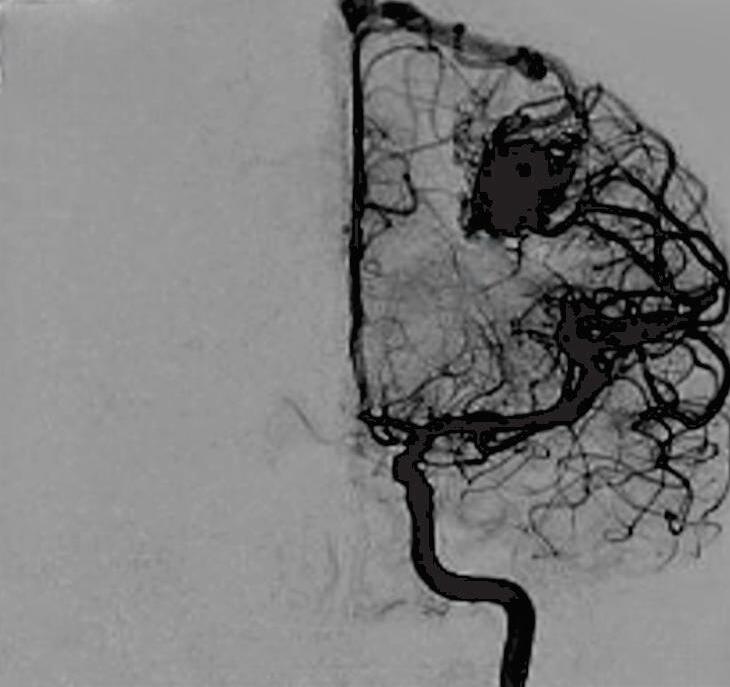

Fig. 1-21. TC de crânio sem contraste em cortes (a) axial e (b) coronal. (c) RNM encéfalo T1 com contraste axial. (d) Angiorressonância arterial sagital. Arteriografia digital em (e) AP e (f) perfil, demonstrando MAV não rota localizada no giro pré-central à esquerda nutrida por ramos da artéria cerebral média e caloso marginal esquerdo. Setas azuis apontando para o nidus da MAV.

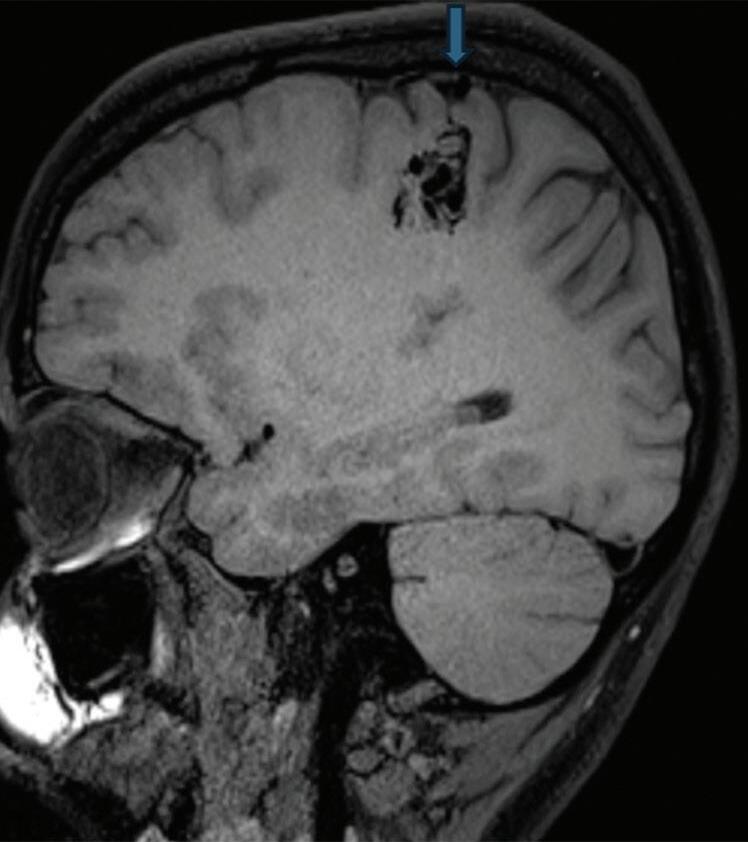
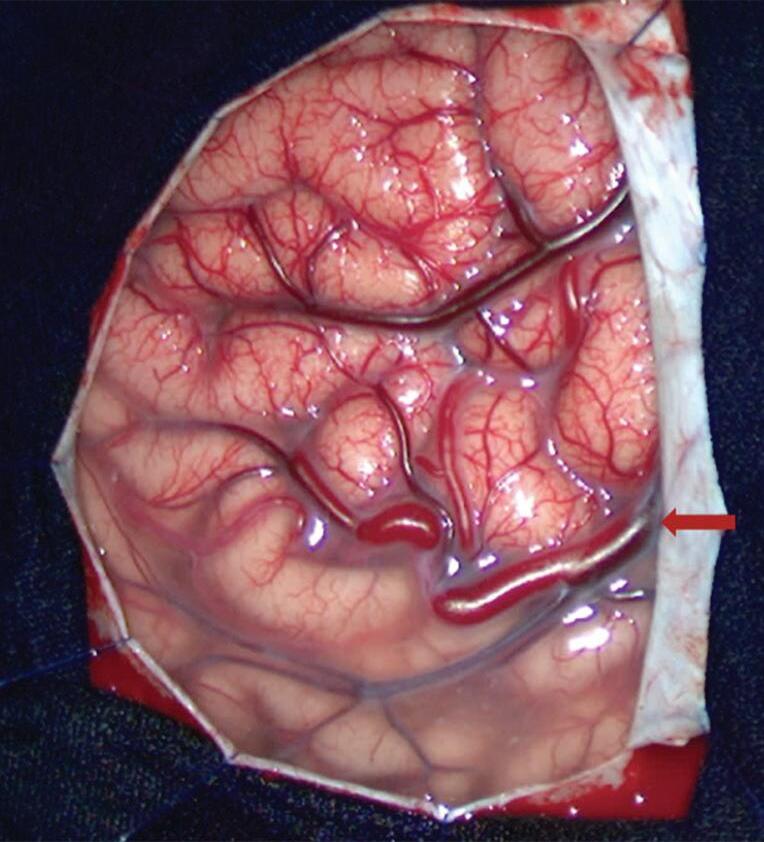
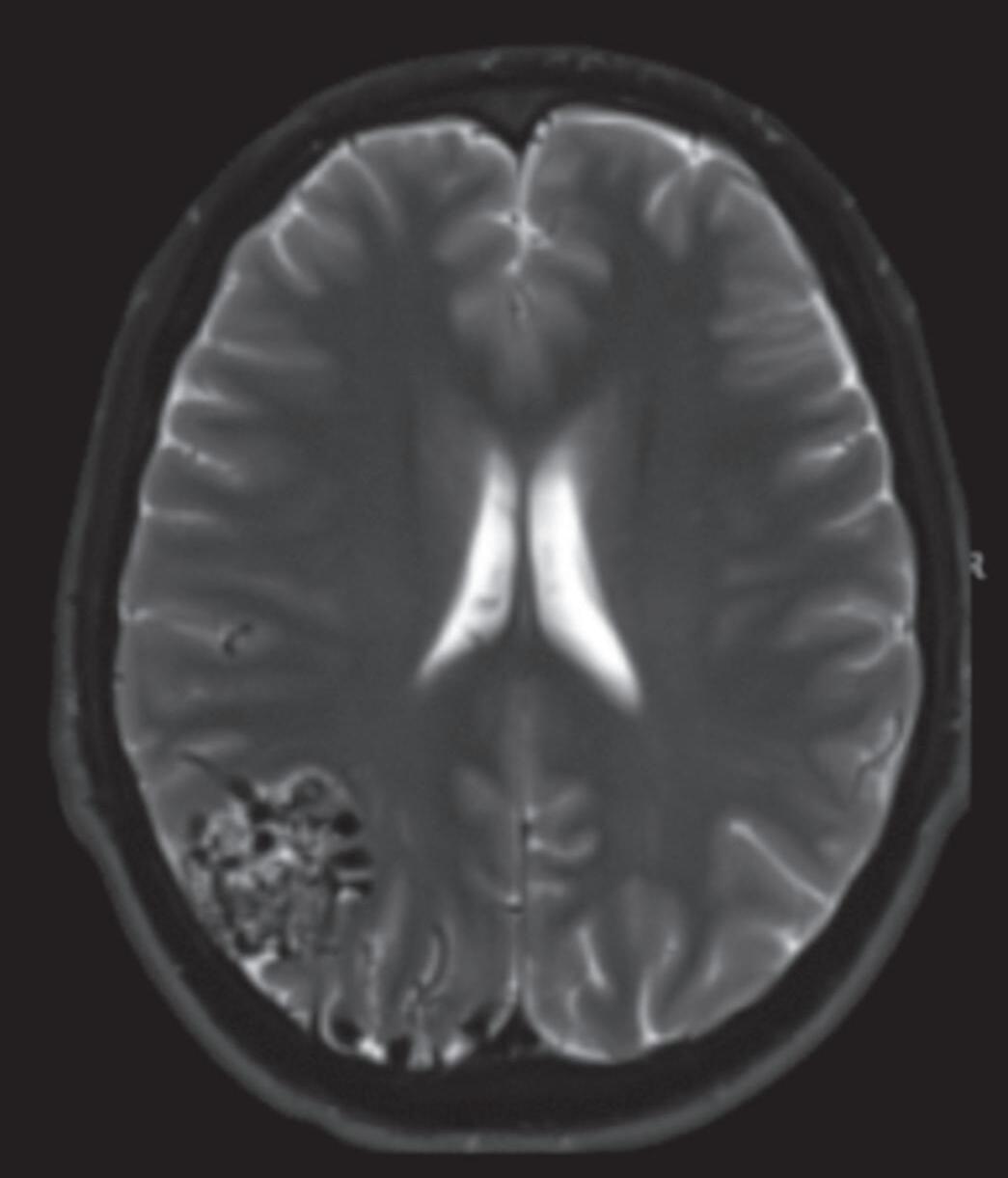
Fig. 1-22. RNM encéfalo FLAIR (a) axial e (b) sagital mostrando hipossinal no sulco central à esquerda. MAV não rota localizada no sulco central à esquerda (seta azul). (c) Imagem intraoperatória mostrando veia arterializada, dilatada localizada no sulco central esquerdo (seta vermelha).
visualização da anatomia cerebral, das alterações parenquimatosas, bem como: gliose peri ou intranidal, atrofia parenquimatosa com dilatação focal do sistema ventricular, possibilita a diferenciação da hemorragia aguda da crônica (visualização da hemossiderina nas sequências gradiente eco [GRE] e hidrocefalia (secundária a hemorragia prévia e ou compressão do sistema ventricular por veias de drenagem dilatadas).35
A utilização de técnicas avançadas, como a tractografia (Fig. 1-23), reconstruções 3D, permitem um estudo detalhado de estruturas anatômicas e sua relação com as patologias cerebrais, facilitando assim o planejamento cirúrgico. A tractografia, uma técnica de ressonância magnética, permite estudar os tratos da substância branca do cérebro, mostrando sua posição, anatomia e integridade, por meio da análise do movimento das moléculas de água no tecido cerebral.35
Dentre os estudos funcionais de neuroimagem podemos citar a ressonância magnética funcional (fMRI), que permite a identificação de áreas ativas do cérebro enquanto o paciente realiza tarefas específicas, como movimentos, fala ou reconhecimento visual; orientando assim, com maior precisão, a abordagem cirúrgica.35
A arteriografia cerebral digital com subtração é considerada o exame padrão-ouro para avaliação das MAV, possui excelente resolução espacial e temporal, o que é necessário para avaliar o tamanho do nidus, a presença de estenose de artéria nutridora, da veia de drenagem, avaliar a presença de aneurismas arteriais e venosos e o fluxo da malformação. Rotineiramente ela deve ser realizada pelo cateterismo dos seis vasos (carótidas internas, externas e artérias vertebrais) e a descrição do exame necessita conter a localização anatômica da malformação, além dos seguintes achados (Figs. 1-24 e 1-25):
Artérias:
• Tipo e número de aferentes arteriais.
• Presença de aneurismas associados (no vaso nutridor ou intranidal).
• Colaterais em territórios vasculares adjacentes (podem ser mal interpretadas como nidus).
Shunt:
• Nidus compacto ou difuso.
• Presença de fístulas de baixo ou alto fluxo.

Veias:
• Número de veias de drenagem.
• Localização superficial ou profunda.
• Presença de estenose ou ectasia.
• Grau de congestão venosa.39
O avanço das tecnologias em neuroimagem funcional e estrutural têm revolucionado a compreensão do cérebro humano e mudado os paradigmas tradicionais sobre o que são consideradas áreas eloquentes, fornecendo uma visão mais acurada e dinâmica das funções e conexões neurais, impactando diretamente na tomada de decisões clínicas e cirúrgicas, com melhora dos resultados; portanto, os avanços em neuroimagem funcional e conectividade cerebral mudaram drasticamente a perspectiva sobre o que se define como uma área eloquente. Atualmente, entende-se que a função cerebral é distribuída e adaptável, possibilitando abordagens cirúrgicas mais seguras, precisas e individualizadas. Essas tecnologias representam não apenas ferramentas diagnósticas, mas também são guias essenciais para a tomada de decisão, transformando a neurocirurgia moderna e melhorando a qualidade de vida dos pacientes.44
Então, o antigo conceito de “áreas eloquentes”, como regiões fixas, baseadas em mapas anatômicos clássicos, tem sido substituído por uma visão mais dinâmica e individualizada do cérebro e do tratamento de patologias cerebrais, tais como MAV, por exemplo. Estudos em conectividade mostram que a função cerebral é distribuída em redes interconectadas, e o impacto de uma lesão ou intervenção depende não apenas da área afetada, mas também de como outras regiões se interconectam e/ou tentam compensar os prejuízos funcionais existentes.41,45-47
Várias patologias que envolvem o encéfalo podem mimetizar o quadro clínico de uma MAV. Dentre elas podemos citar: dissecção da artéria carótida ou vertebral, trombose do seio cavernoso, angiopatia amiloide cerebral, trombose venosa cerebral, aneurismas cerebrais rotos, enxaqueca oftalmoplégica, cefaleias em salvas, doença de Moyamoya, acidente vascular cerebral isquêmico, acidente vascular cerebral hemorrágico, malformação da veia de galeno, angiopatia proliferativa; todas essas doenças podem ser diferenciadas das MAVs com o uso correto dos exames subsidiários anteriormente citados.48
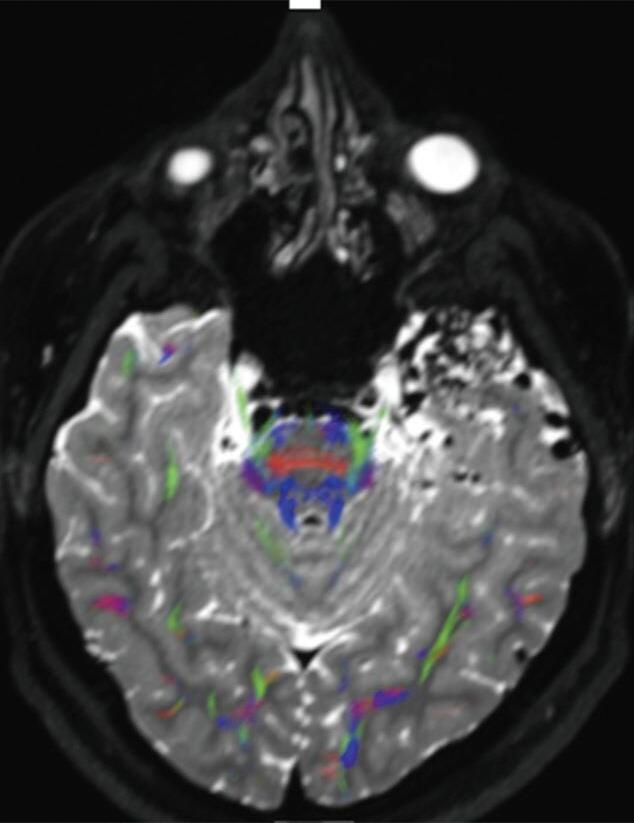
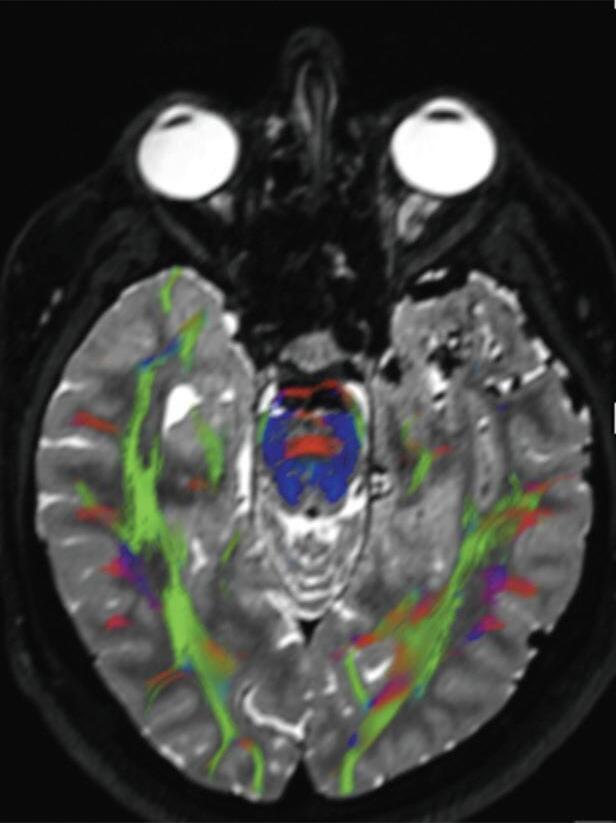
tractografia cerebral, cortes axiais. A codificação de cores demonstra as fibras com orientação laterolateral em vermelho, a orientação anteroposterior em verde e a craniocaudal em azul. Observe o deslocamento das fibras de associação (verde) no lobo temporal esquerdo em relação à MAV.
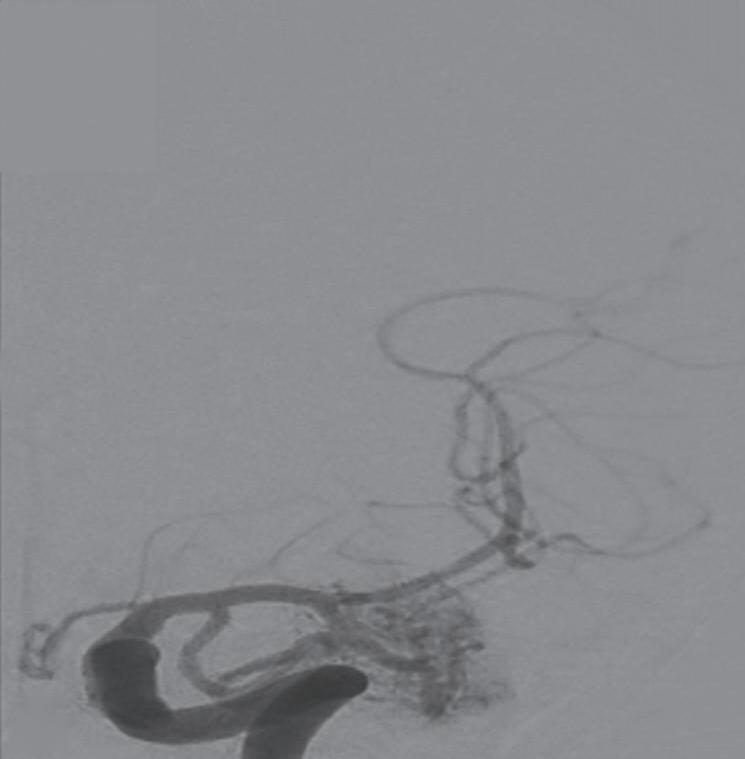

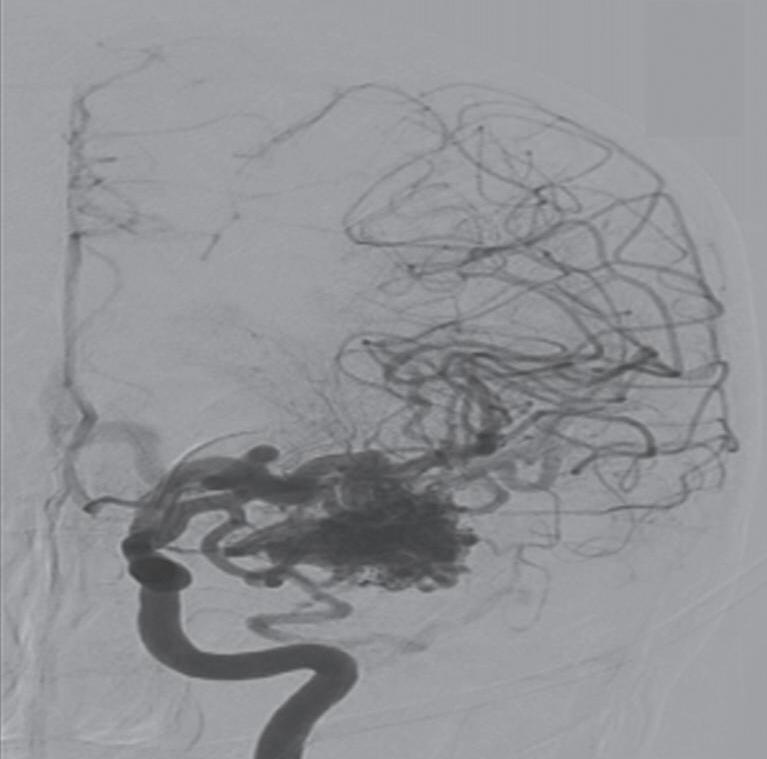

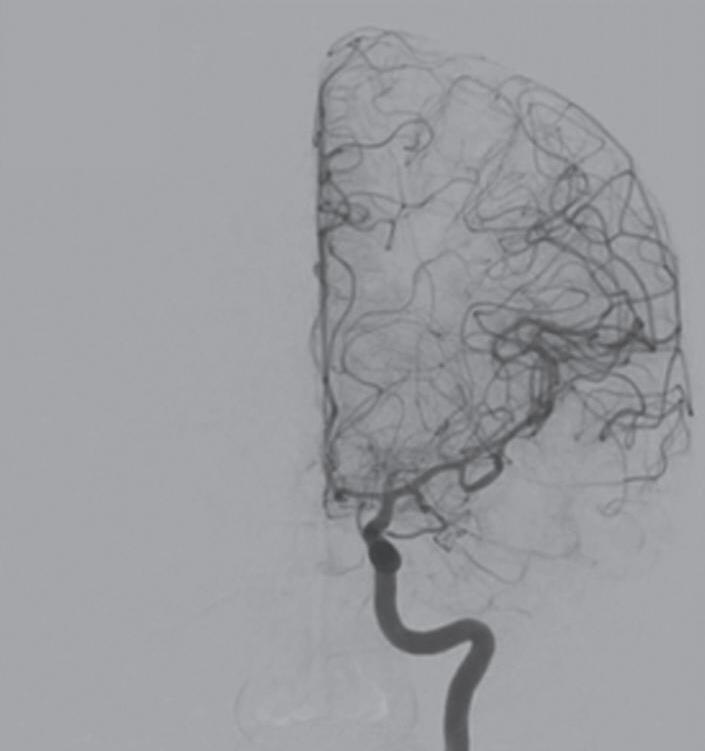
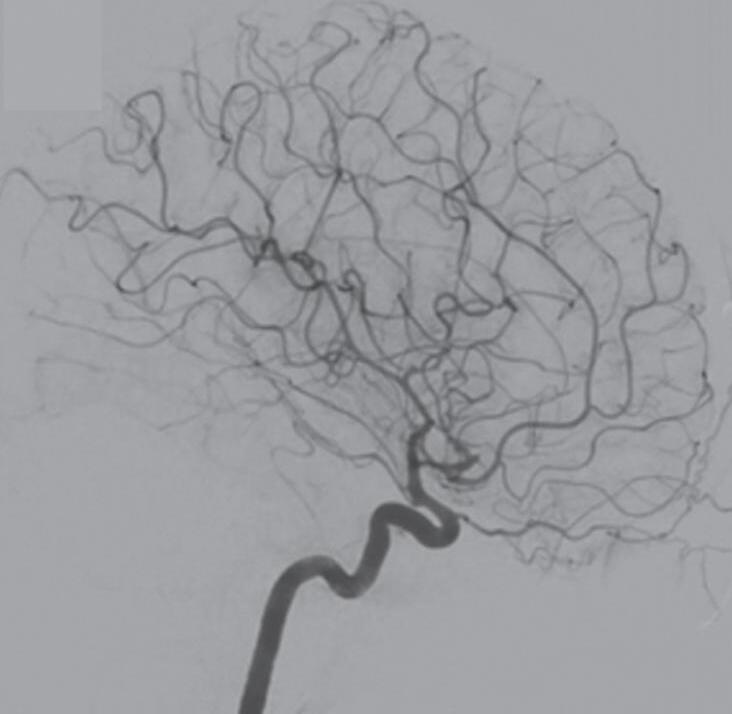
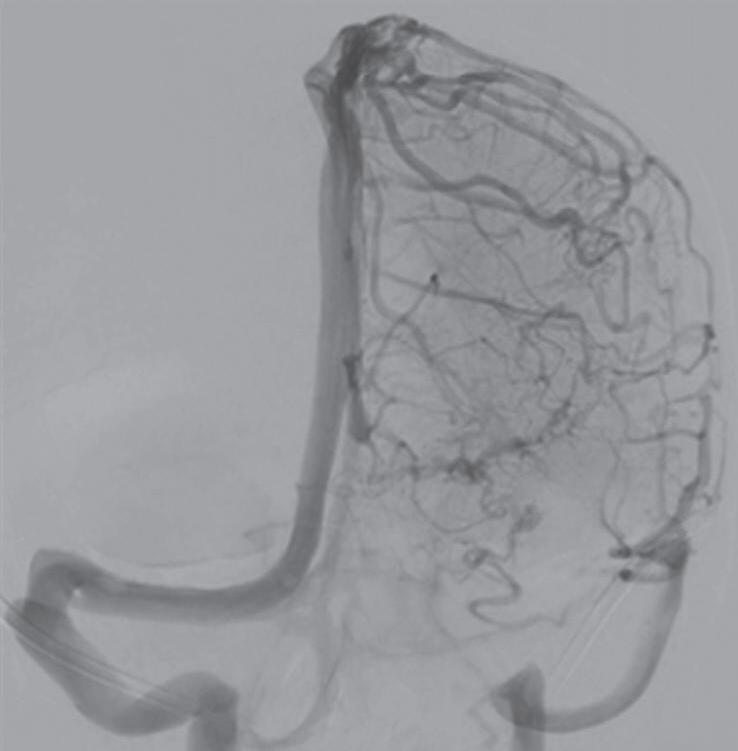

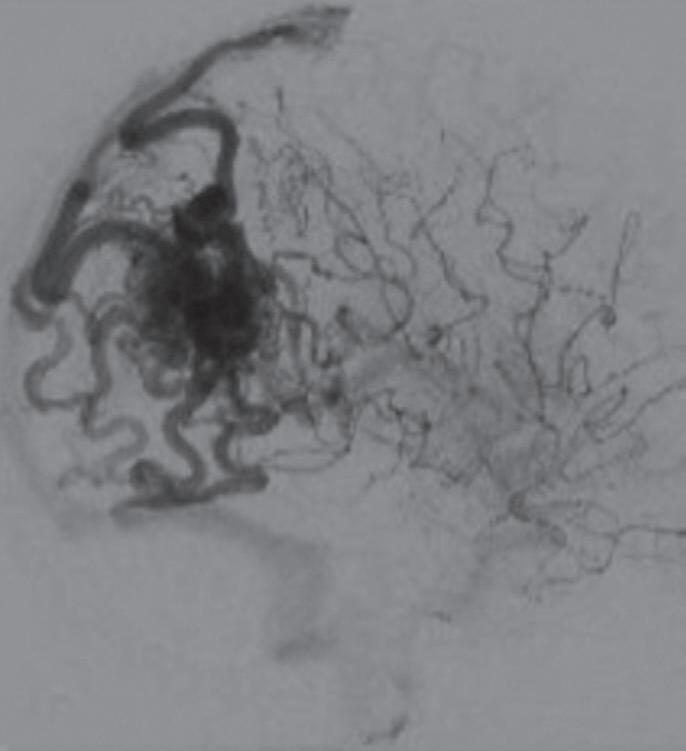
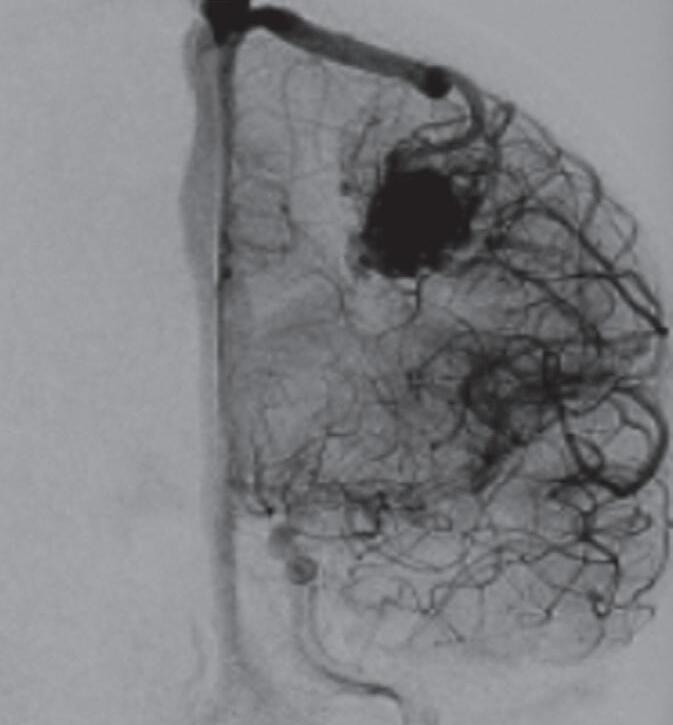
Fig. 1-24. Angiograma anteroposterior mostrando MAV nutrida pelas artérias cerebrais média (ramos precoces) setas azuis, com uma grande veia de drenagem – veia cerebral média profunda, seta vermelha relacionada com a ponta do lobo temporal esquerdo. (a-d) Pré-operatório. (e-h) Pós-operatório, mostrando a ressecção completa da lesão e restabelecimento do fluxo regional.
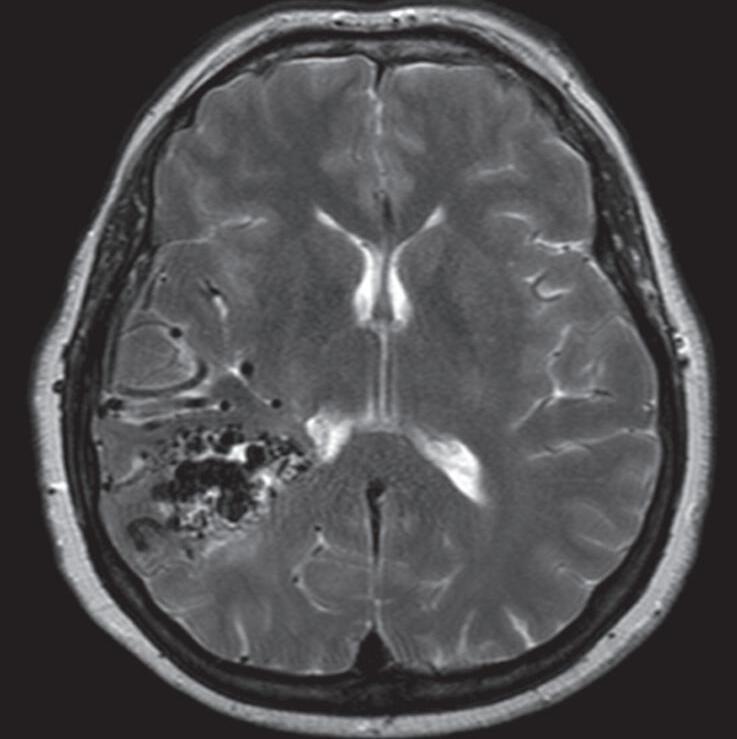
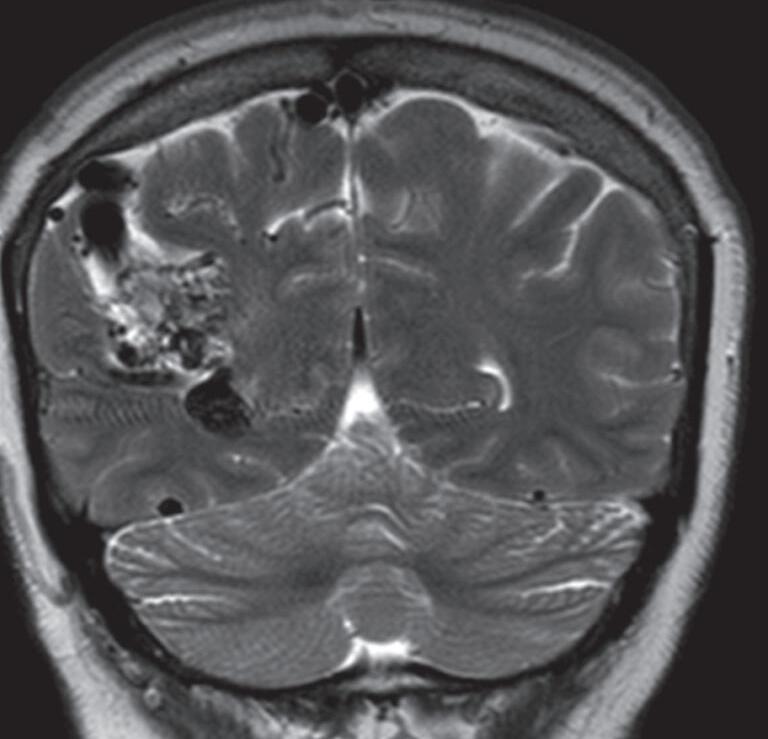
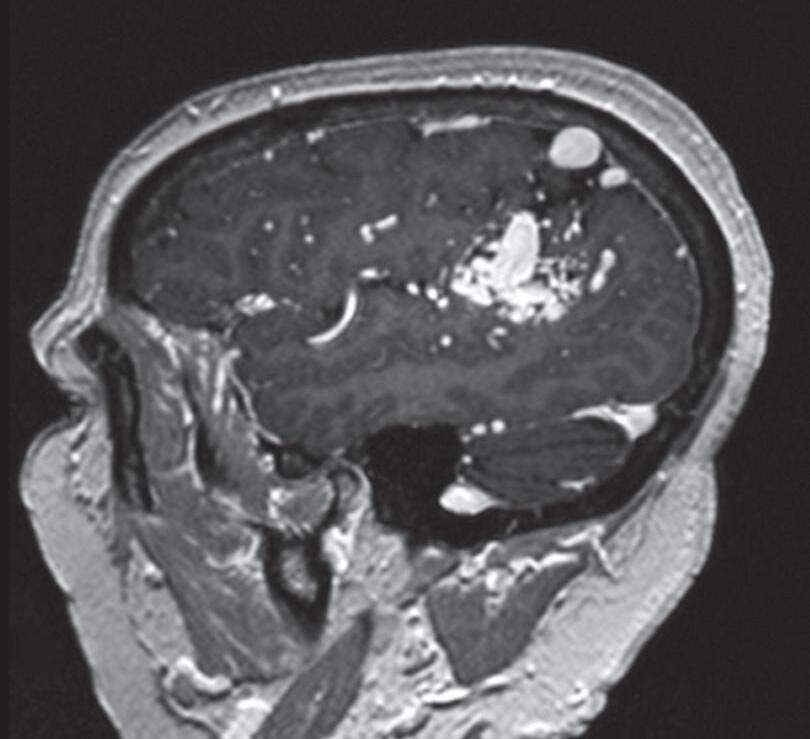




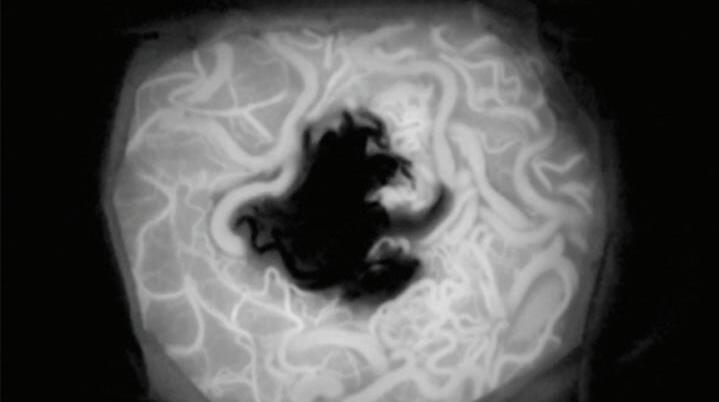
Fig. 1-25. RNM T2 (a) axial, (b) coronal e (c) T1 com contraste sagital demonstrando MAV não rota localizada na região temporoparietal direita “giro supramarginal”. (d-f) Angiograma anterosuperior mostrando a MAV alimentando-se por ramos da artéria cerebral média direita. As setas azuis apontam para a veia de drenagem ectasiada (hipertensão venosa) e com estenose (seta amarela) na entrada no seio sagital superior.
TRATAMENTO
O tratamento das malformações arteriovenosas cerebrais visa prevenir o risco contínuo de hemorragias intracranianas potencialmente fatais. A abordagem terapêutica deve ser definida por uma equipe multidisciplinar em centros de referência e ser ponderado se o tratamento proposto trará benefícios que superem a história natural da doença.49,50
As modalidades de tratamento existentes na atualidade são citadas a seguir.
Tratamento Conservador
A abordagem conservadora é recomendada para as MAVs classificadas como graus IV e V, segundo a escala de Spetzler-Martin, porém esta conduta tem sido reavaliada na atualidade. A conduta conservadora pode ser modificada em casos de sangramento recorrente, déficits neurológicos progressivos ou hipertensão intracraniana. O monitoramento regular é essencial para avaliar a evolução e identificar possíveis indicações para intervenções futuras. 13,50
Tratamento Cirúrgico
A microcirurgia é considerada o tratamento definitivo para MAV, especialmente as classificadas como graus I e II da escala Spetzler-Martin. Já as MAV de grau III, dependendo da localização e das características da sua angioarquitetura, podem requerer abordagem combinada, incluindo embolização previamente. Subdivisões do grau III, como IIIA (lesões corticais volumosas) e IIIB (localizadas no lobo límbico), são frequentemente tratadas cirurgicamente após embolização pré-operatória. Já o subtipo III C bem como alguns
casos de MAV grau IV e V podem ser tratados cirurgicamente se bem avaliados e submetidos à embolização pré-operatória.29,50
As limitações desta abordagem incluem ruptura intraoperatória, difícil acessibilidade anatômica, edema por retração, ressecção de tecido cerebral normal, trombose do vaso nutridor ou de drenagem e inchaço cerebral com comprometimento da pressão de perfusão normal.13,51
Alguns serviços de referência mundial em tratamento microcirúrgico das MAVs, assim como o nosso, têm transformado este cenário, ampliando assim o leque de indicações cirúrgicas de casos complexos e inoperáveis em uma nova realidade com excelentes resultados anatômicos e funcionais. Entretanto, para que esta filosofia seja aplicada com segurança, é necessário que o serviço disponha de recursos tecnológicos na sala de cirurgia a fim de facilitar o ato operatório e minimizar as complicações.52-54
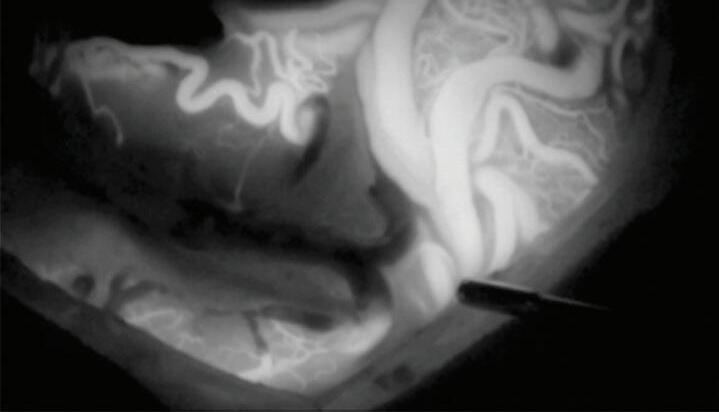
O microscópio com tecnologia de angiografia intraoperatória utilizando indocianina (ICG) é uma ferramenta avançada que tem transformado a prática de cirurgias neurovasculares (Fig. 1-26), propiciando ao neurocirurgião uma ferramenta poderosa que permite visualização em tempo real do fluxo sanguíneo e assim a confirmação dos resultados das intervenções de forma imediata.55
Além disso, outras ferramentas importantes utilizadas no nosso serviço são a neuronavegação, a monitorização neurofisiológica intraoperatória, o ultrassom Doppler e, em casos selecionados, a possibilidade de cirurgia acordada (awake surgery) com a participação da neuropsicologia durante a fase acordada (Figs. 1-27 e 1-28).56
Além disto, nosso serviço se dedica também ao ensino continuado, estimulando o treinamento em laboratório, utilizando modelos que simulam malformações arteriovenosas em placentas, por exemplo (Figs. 1-29 e 1-30).57

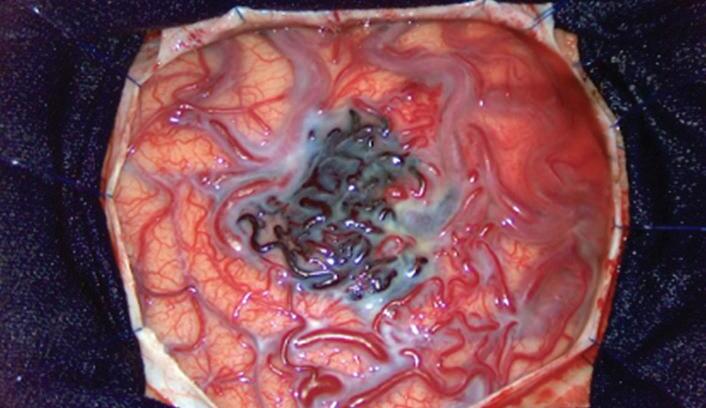

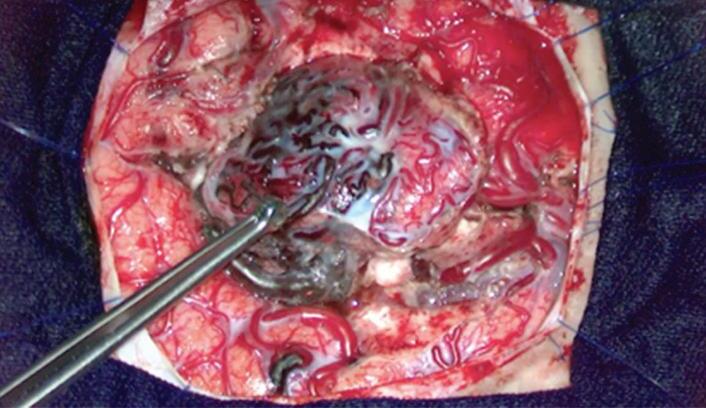
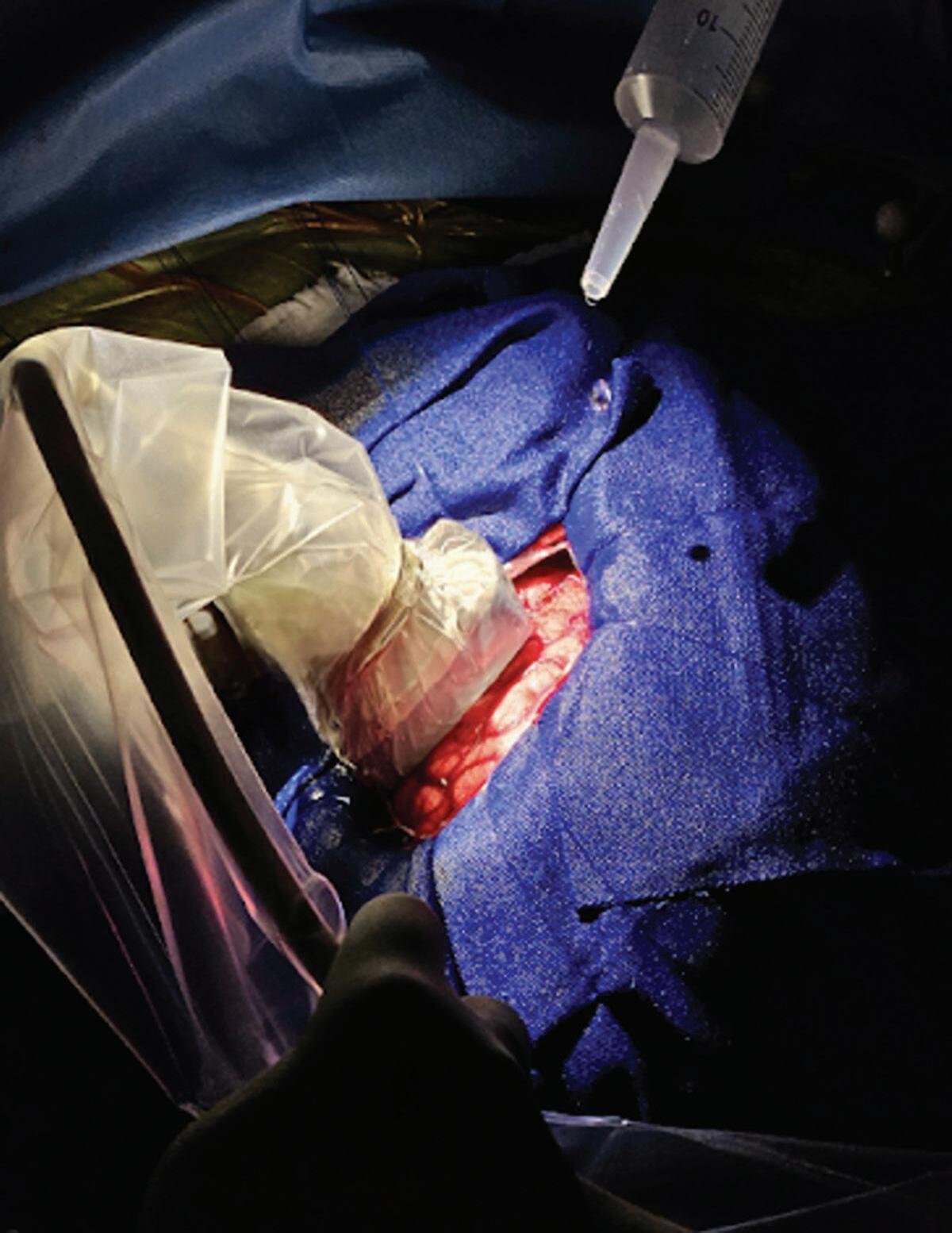
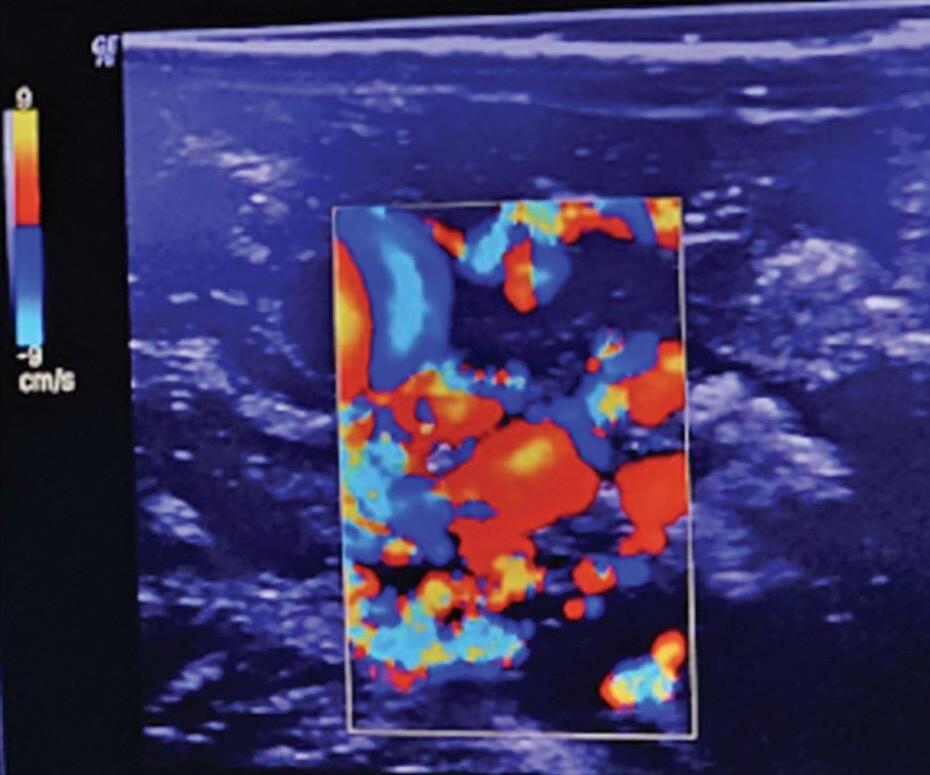

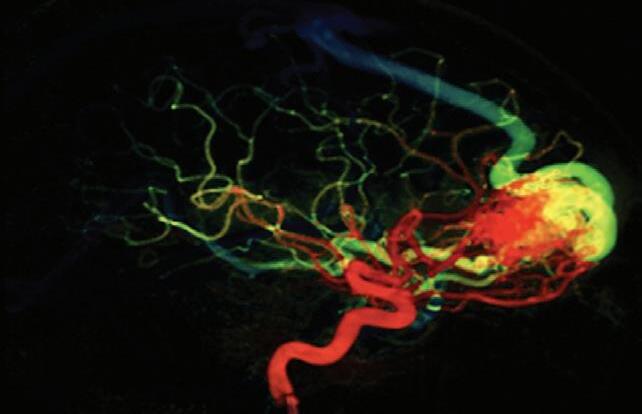

Fig. 1-27. (a,b) Demonstração de uso do ultrassom com efeito Doppler. (c-e) Neuronavegação intraoperatória na cirurgia de MAV. São recursos importantes e de grande utilidade na cirurgia de malformações arteriovenosas.
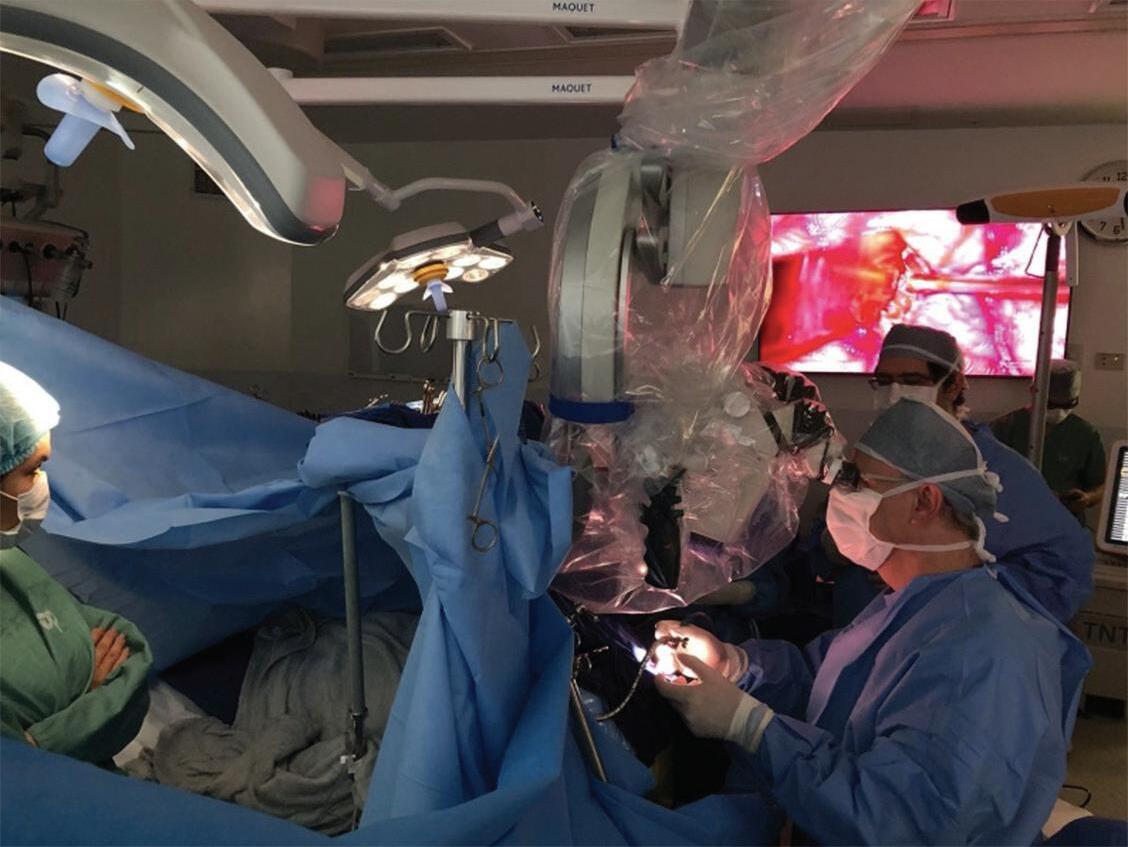
Fig. 1-28. Demonstração wake up surgery de uma MAV próxima a área da linguagem. Observe a presença da neuropsicologista (seta azul), avaliando múltiplos aspectos no paciente durante a ressecção.

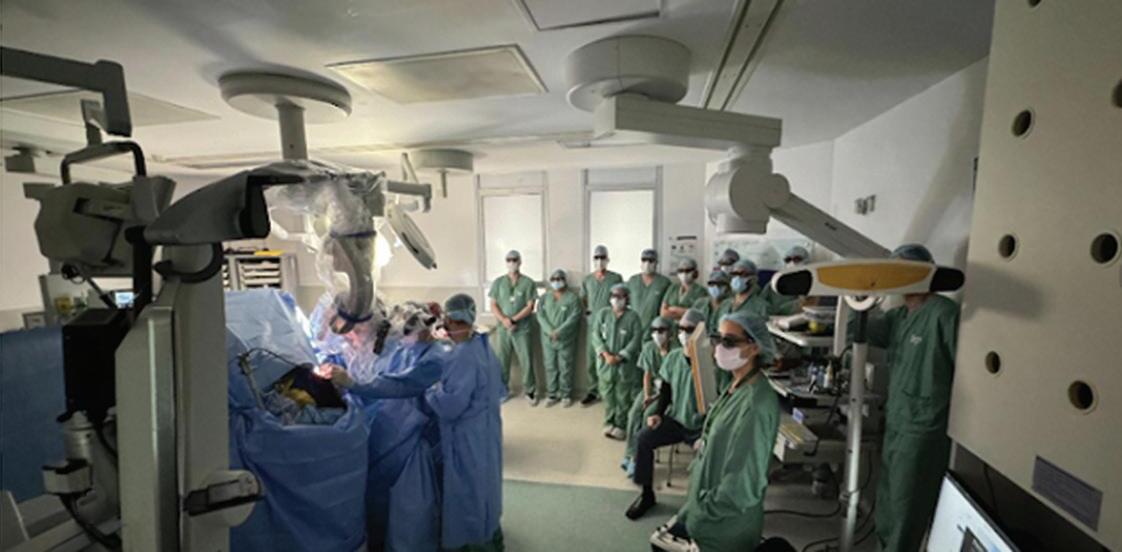
Fig. 1-29. (a) Treinamento de Fellows em neurocirurgia vascular em laboratório. (b) Os mesmos assistindo ao vivo com óculos 3D uma cirurgia de MAV podendo associar a teoria, o treinamento em laboratório e a observação de um expert operando para sua formação.
treinamento
arteríolas e as pretas as veias e vênulas.
Tratamento por Embolização Endovascular
Além de ser utilizada como terapia adjuvante pré-cirúrgica, como nas MAVs grandes ou com drenagem venosa profunda (C2, ela pode ser indicada como embolização paliativa nos casos de MAVs sintomáticas incuráveis com o objetivo de minimizar ou interromper a progressão dos sintomas ou podem também ser indicadas para embolização curativa primária em pacientes cuidadosamente selecionados.45 Alguns estudos relatam que a embolização está associada a complicações hemorrágicas em 2-5% dos pacientes, novos déficits neurológicos em 10-14% dos pacientes, déficits permanentes em 2-5% dos pacientes e morte em aproximadamente 1% dos pacientes; sendo que essas complicações devem ser levadas em consideração juntamente com as taxas de complicações do tratamento radiocirúrgico ou microcirúrgico associado.49,51,58
O objetivo do tratamento endovascular é obliterar os vasos localizados na profundidade da MAV (Fig. 1-31), reduzindo o fluxo sanguíneo no seu interior e facilitando a ressecção cirúrgica subsequente. Esse procedimento é realizado com a injeção de agentes embolizantes que podem ser líquidos, partículas ou molas. Como agentes embolizantes líquidos podem ser utilizados substâncias como cola, Onyx e Squid. Já os agentes embolizantes tipo partículas são representados por pequenas esferas projetadas para bloquear o fluxo sanguíneo e os agentes embolizantes tipo molas são utilizados para interromper a comunicação entre as artérias e veias.49,51,58

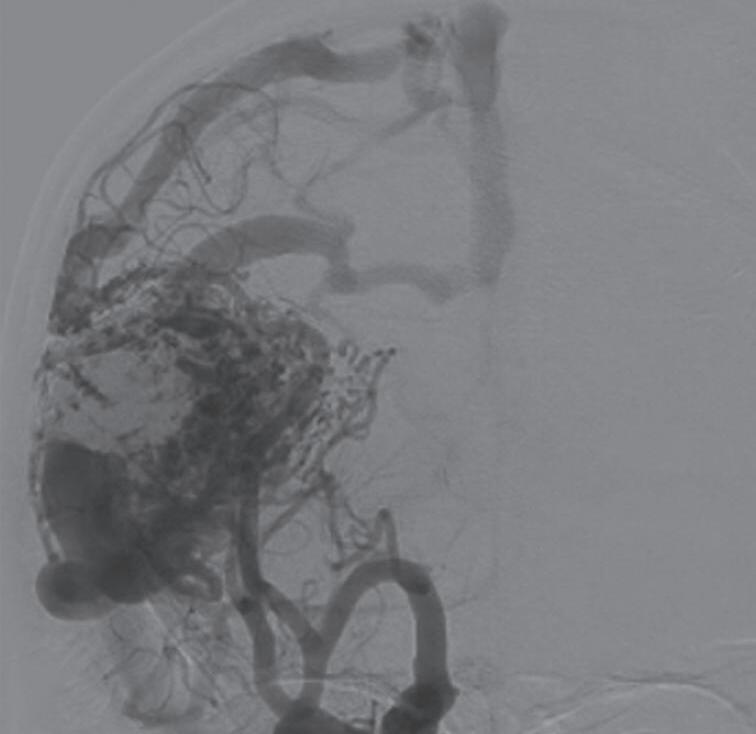

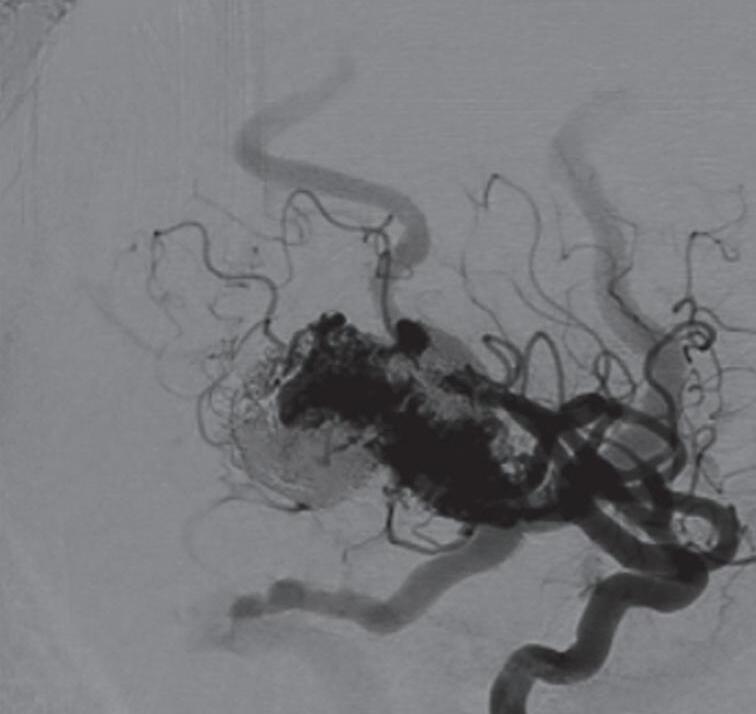
Fig. 1-31. (a,c) MAV adequadamente embolizada para ressecção cirúrgica com oclusão de sua parte profunda (cruz verde). (b,d) Embolização superficial da MAV, deixando a irrigação profunda sem embolizar, o que dificulta a ressecção cirúrgica (cruz vermelha).
Tratamento por Radiocirurgia
Esta modalidade de tratamento utiliza a radiação focal de alta dose. O mecanismo de ação proposto é a lesão controlada das paredes vasculares da MAV, o que acabará por levar à esclerose do nidus e dos vasos de alimentação e drenagem. Tradicionalmente, tem sido reservado para pacientes com alta morbidade cirúrgica ou para pequenas, profundas e localizadas em áreas eloquentes e para aquelas consideradas impossíveis de serem ressecadas. Ela é útil para lesões com diâmetro inferior a 3,5 cm, com taxas de obliteração relatadas de até 80% após 2 anos.59
Embora seja uma opção não invasiva, apresenta uma latência de aproximadamente 2 anos para alcançar a obliteração da lesão, expondo o paciente a um risco de hemorragia nesse período e podendo apresentar como complicação tardia (geralmente 3 anos após o tratamento), a radionecrose (2,2-9% dos casos).59,60
Associação de Modalidades de Tratamentos
A abordagem multimodal no tratamento das MAVs tem ganhado destaque por possibilitar a associação de diferentes modalidades terapêuticas, cada uma com vantagens específicas, para otimizar os resultados clínicos e reduzir riscos, estratégia muito utilizada no nosso serviço.24
Embora não exista uma conduta única e uniformizada para o tratamento das MAVs, principalmente em áreas eloquentes, a microcirurgia em centros de referência, se realizada por equipes especializadas, continua sendo o padrão-ouro para muitas situações. A escolha da estratégia ideal deve considerar os benefícios para o paciente, os riscos associados e a complexidade da lesão.28,49,50
O diagnóstico e o tratamento da MAV cerebral são feitos com uma equipe multiprofissional composta por um neurocirurgião,
neurologista e um radiologista intervencionista. O manejo das MAVs cerebrais depende do tamanho, da localização, da idade do paciente e do status da MAV (alto risco de ruptura). Embora a cirurgia seja o tratamento principal, a embolização é outra opção. Os desfechos desses pacientes dependem do tamanho da MAV, da presença de sintomas, da localização, da comorbidade do paciente e do estado mental. O fator de risco mais significativo para óbito é a ruptura da MAV.27-30
1. Luschka, H. Cavernöse Blutgeschwulst des Gehirns. Archiv f. Pathol. Anat. 1854;6:458-470.
2. Al-Shahi R, Warlow C. A systematic review of the frequency and prognosis of arteriovenous malformations of the brain in adults. Brain. 2001;124:1900-1926.
3. Lasjaunias P. Classification of brain arteriovenous malformations. J Neuroradiol. 1993;20(3):205-221.
4. Dandy WE. Arteriovenous aneurysm of the brain. Arch Surg 1928;17(2):190-243.
5. Smith JL, Garg B. Treatment of arteriovenous malformations of the brain. Curr Neurol Neurosci Rep. 2002;2:44-49.
6. Thomas JM, Surendran S, Abraham M et al. Genetic and epigenetic mechanisms in the development of arteriovenous malformations in the brain [published correction appears in: Clin Epigenetics. Clin Epigenetics. 2016;8:78. 2018;10(1):124.
7. Lasjaunias PL, Landrieu P, Rodesch G et al. Cerebral proliferative angiopathy: clinical and angiographic description of an entity different from cerebral AVMs. Stroke. 2008;39(3):878-885.
8. Florian IA, Beni L, Moisoiu V et al. ‘De Novo’ Brain AVMs-Hypotheses for Development and a Systematic Review of Reported Cases. Medicina (Kaunas). 2021;57(3):201.
9. Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg. 1982;69(3):412-422.
10. Moftakhar P, Hauptmann JS, Malkasian D, Martin NA. Cerebral arteriovenous malformations. Part 1: cellular and molecular biology. Neurosurg Focus. 2009;26(5):E10.
11. Moftakhar P, Hauptmann JS, Malkasian D, Martin NA. Cerebral arteriovenous malformations. Part 2: physiology. J Neurosurg. 2009;26(5):E11.
12. Ozpinar A, Mendez G, Abla AA. Epidemiology, genetics, pathophysiology, and prognostic classifications of cerebral arteriovenous malformations. Handb Clin Neurol. 2017;143:5-13.
13. Chen CJ, Ding D, Derdeyn CP et al. Brain arteriovenous malformations: A review of natural history, pathobiology, and interventions. Neurology. 2020;95(20):917-927.
14. Novakovic RL, Lazzaro M, Castonguay C, Zaidat OO. The Diagnosis and Management of Brain Arteriovenous Malformations. Neurol Clin [Internet]; [cited 2014 Dec 26]. 2013;31(3):749-63.
15. Ondra SL, Troupp H, George ED, Schwab K. The natural history of symptomatic arteriovenous malformations of the brain: a 24-year follow-up assessment. J Neurosurg [Internet]; [cited 2014 Dec 29]. 1990;73(3):387-91.
16. Ramey WL, Martirosyan NL, Zabramski JM et al. A hierarchical model for the development of cerebral arteriovenous malformations. Clin Neurol Neurosurg. 2014;126:126-129.
17. Nikolaev SI, Vetiska S, Bonilla X et al. Somatic Activating KRAS Mutations in Arteriovenous Malformations of the Brain. N Engl J Med. 2018;378(3):250-261.
18. Fraissenon A, Bayard C, Morin G et al. Sotorasib for Vascular Malformations Associated with KRAS G12C Mutation. N Engl J Med. 2024;391(4):334-342.
19. Osbun JW, Reynolds MR, Barrow DL. Arteriovenous malformations: epidemiology, clinical presentation, and diagnostic evaluation. Handb Clin Neurol. 2017;143:25-29.
20. Laakso A, Hernesniemi J. Arteriovenous malformations: epidemiology and clinical presentation. Neurosurg Clin N Am. 2012;23(1):1-6.
21. Fleetwood IG, Steinberg GK. Arteriovenous malformations. Lancet. 2002;359(9309):863-873.
22. Chang Mulato JE, Kus WP, Biondi Soares LG et al. Microsurgical Treatment for Arteriovenous Malformation in Eloquent Area: A 2-Dimensional Surgical Video and Step-by-Step Practical Guide. World Neurosurg. 2022;161:4.
23. Lawton MT, Rutledge WC, Kim H et al. Brain arteriovenous malformations. Nat Rev Dis Primers. 2015;1:15008.
24. Apaza-Tintaya RA, Biondi-Soares LG, Canache Jiménez LÁ et al. Combined Endovascular-Microsurgical Treatment for a Parietal Brain Arteriovenous Malformation and Neuropsychological Implications: An Operative 2-Dimensional Video Case: 2-Dimensional Operative Video. Oper Neurosurg (Hagerstown). 2025;28(4):575-576.
25. Batista UC, Pereira BJA, Joaquim AF et al. Correlation between angioarchitectural characteristics of brain arteriovenous malformations and clinical presentation of 183 patients. Arq Neuropsiquiatr. 2022;80(1):3-12.
26. Greenberg MS. Manual de Neurocirurgia. 8. ed. Rio de Janeiro: Editora Thieme Revinter; 218. p. 1238-1242.
27. Spetzler RF, Martin NA. A proposed grading system for arteriovenous malformations. J Neurosurg. 1986;65(4):476-483.
28. Lawton MT, Kim H, McCulloch CE et al. A supplementary grading scale for selecting patients with brain arteriovenous malformations for surgery. Neurosurgery. 2010;66(4):702-713.
29. de Oliveira E, Tedeschi H, Raso J. Multidisciplinary approach to arteriovenous malformations. Neurol Med Chir (Tokyo). 1998;38:177-85.
30. Zuurbier SM, Al-Shahi SR. Interventions for treating brain arteriovenous malformations in adults. Cochrane Database of Systematic Reviews 2019(9).
31. Mohr JP, Moskowitz AJ, Stapf C et al. The ARUBA trial: current status, future hopes. Stroke. 2010;41(8):e537-40.
32. Nascimento VS, Coelho DS, Chang-Mulato JÉ et al. Cerebral arteriovenous malformation and foreign accent syndrome: a case report. Br J Neurosurg. 2022;38(6):1435-1439.
33. de Souza CD, Santos B FO, Silva da Costa MD et al. Cognitive performance in patients with cerebral arteriovenous malformation. J Neurosurg. 2019;132(5):1548-1555.
34. Mohr JP, et al. Medical management with or without interventional therapy for unruptured brain arteriovenous malformations (ARUBA): a multicentre, non-blinded, randomised trial. Lancet. 2014;383(9917):614-621.
35. Asif K, Leschke J, Lazzaro MA. Cerebral arteriovenous malformation diagnosis and management. Semin Neurol. 2013;33(5):468-475.
36. Turjman F, Massoud TF, Viñuela F et al. Correlation of the angioarchitectural features of cerebral arteriovenous malformations with clinical presentation of hemorrhage. Neurosurgery. 1995;37(5):856-862.
37. Stabell KE, Nornes H. Prospective neuropsychological investigation of patients with supratentorial arteriovenous malformations. Acta Neurochir (Wien). 1994;131(1-2):32-44.
38. Can A, Gross BA, Du R. The natural history of cerebral arteriovenous malformations. Handb Clin Neurol. 2017;143:15-24.
39. Kandai S, Abdullah MS, Naing NN. Angioarchitecture of brain arteriovenous malformations and the risk of bleeding: an analysis of patients in northeastern malaysia. Malays J Med Sci. 2010;17(1):44-48.
40. Lantz ER, Meyers PM. Neuropsychological effects of brain arteriovenous malformations. Neuropsychol Rev. 2008;18(2):167-177.
41. Brown Jr RD, Wiebers DO, Torner JC, O´Fallon WM. Frequency of intracranial hemorrhage as a presenting symptom and subtype analysis: a population-based study of intracranial vascular malformations in Olmsted County, Minnesota. J Neurosurg. 1996;85:29-32.
42. Rousseau PN, La Piana R, Chai XJ et al. Brain functional organization and structure in patients with arteriovenous malformations. Neuroradiology. 2019;61(9):1047-1054.
43. Brown RD Jr, Wiebers DO, Torner JC, O´Fallon WM. Frequency of intracranial hemorrhage as a presenting symptom and subtype analysis: a population-based study of intracranial vascular malformations in Olmsted County, Minnesota. J Neurosurg. 1996;85:29-32.
44. Tranvinh E, Heit JJ, Hacein-Bey L et al. Contemporary Imaging of Cerebral Arteriovenous Malformations. AJR Am J Roentgenol. 2017;208(6):1320-1330.
45. Cravo I, Palma T, Conceição C, Evangelista P. Aplicações pré-cirúrgicas do mapeamento cortical por Ressonância Magnética Funcional [Preoperative applications of cortical mapping with functional magnetic resonance]. Acta Med Port. 2001;14(1):21-25.
46. Alkadhi H, Kollias SS, Crelier GR et al. Plasticity of the human motor cortex in patients with arteriovenous malformations: a functional MR imaging study. AJNR Am J Neuroradiol. 2000;21(8):1423-1433.
47. Ferra CF, Pereira HG, Manaças P et al. Structural connectivity of the brain: differences between a normal brain and a brain with pathology. Saúde & Tecnologia. 2014:29-38.
48. Bokhari MR, Bokhari SRA. Arteriovenous Malformation of the Brain. [Updated 2023 Apr 24]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; [Internet]. 2025.
49. Starke RM, Komotar RJ, Hwang BY et al. Treatment guidelines for cerebral arteriovenous malformation microsurgery. Br J Neurosurg. 2009;23(4):376-386.
50. Hernández MM, Dória-Neto HL, Campos Filho JM et al. Microsurgical Resection of Tonsillar Arteriovenous Malformation: Operative Video. World Neurosurg. 2023;174:139.
51. Narayanan M, Atwal GS, Nakaji P. Multimodality management of cerebral arteriovenous malformations. Handb Clin Neurol. 2017;143:85-96.
52. Rodríguez RG, Agyemang K, Arias SAM et al. Importance of Arachnoid Dissection in Arteriovenous Malformation Microsurgery: A Technical Note. World Neurosurg. 2023;173:12.
53. Da Costa MDS, Santos BFO, Guardini BAF, Chaddad-Neto F. Microsurgical treatment for arteriovenous malformation of the corpus callosum and choroidal fissure. Neurosurg Focus. 2017;43 (VideoSuppl1):V12.
54. Effgen EA, Jiménez LÁC, Trindade ÉSGG et al. Application of the Technique of Inferior Temporal Gyrus Resection for Microsurgical Treatment of Arteriovenous Malformation of the Fusiform Gyrus. World Neurosurg. 2025;194:123535.
55. Raabe A, Beck J, Gerlach R et al. Intraoperative indocyanine green videoangiography: a new method for intraoperative vascular flow analysis. Neurosurgery. 2003;52(1):132-139.
56. Wang AT, Pillai P, Guran E et al. Anesthetic Management of Awake Craniotomy for Resection of the Language and Motor Cortex Vascular Malformations. World Neurosurgery. 2020;143:e136-e148.
57. Jiménez LÁC, Salvagni FP, Biondi-Soares LG et al. Model of Arteriovenous Malformation Created in Human Placenta for Training in Vascular Microneurosurgery. Oper Neurosurg (Hagerstown). 2025;28(3):418-426.
58. Vollherbst DF, Chapot R, Bendszus M, Möhlenbruch MA. Glue, Onyx, Squid or PHIL? Liquid Embolic Agents for the Embolization of Cerebral Arteriovenous Malformations and Dural Arteriovenous Fistulas. Clin Neuroradiol. 2022;32(1):25-38.
59. Awad AJ, Walcott BP, Stapleton CJ et al. Repeat radiosurgery for cerebral arteriovenous malformations. J Clin Neurosci. 2015;22(6):945-950.
60. Serrato-Avila JL, da Costa MDS, Stávale JN et al. Microsurgical Resection of a Left Supramarginal Gyrus AVM Causing Radionecrosis. World Neurosurg. 2020;138:317.
Um guia prático, passo a passo, para o domínio da anatomia aplicada e das técnicas microcirúrgicas avançadas.
Atlas de Anatomia Aplicada à Cirurgia da Malformação Ar teriovenosa Cerebral é uma obra singular que une, de forma didática e prática, o rigor da anatomia à ar te da microcirurgia.
Apresenta, passo a passo, os fundamentos necessários para compreender e abordar as MAVs cerebrais: anatomia de super fície, ar terial e venosa, pontos craniométricos, análise detalhada de imagens — incluindo ressonância magnética, trac tografia e angiografia digital — e, por fim, a aplicação de técnicas microcirúrgicas avançadas.
Mais do que um simples compêndio, este Atlas transmite a experiência acumulada de trajetórias dedicadas à assistência, ao ensino e à pesquisa no campo da neurocirurgia. Sua proposta é clara: oferecer ao leitor um guia prático e inspirador para levar ao domínio da anatomia aplicada e ao aprimoramento da precisão de técnicas microcirúrgicas.
Destinado a neurocirurgiões em formação e especialistas, esta obra representa uma contribuição inovadora para aqueles que buscam excelência no tratamento das malformações ar teriovenosas cerebrais.
Acesse o conteúdo complementar online através dos QR codes específicos no texto
ISBN 978-65-5572-376-2
www.Thieme.com.br