





= N(X)
N(X) = n(X)NA
m(X) = n(X)M(X)
= V(X)
V(X) = Vm(X)n(X)
n(X) = m(X) M(X) M(X) = m(X) n(X) M(X),
M(X) = D(X/Y) M(Y)
Vm(X) = V(X) n(X)
,
Vm(X) = V(X) n(X) D(X/Y) = M(X) M(Y) M(Y) = M(X) D(X/Y) M(Y), г
D(X/Y)
завдання і вправи, що дають змогу застосувати здобуті
в ситуаціях, пов’язаних зі здоров’ям, безпекою, добробутом тощо.
— інтерактивна вправа для здійснення самоконтролю.
Вітаю тебе 4
Цікава подорож світом хімії триває! ......................................... 5
ТЕМА 1.
Досліджуємо хімічні реакції
1. Розпізнаємо хімічні реакції 12
2. [Пере]Відкриваємо закони збереження ........... 18
3. Моделюємо хімічні реакції.
Схема хімічної реакції. Хімічні рівняння 25
4. Моль — одиниця кількості речовини. Молярна маса речовини ............................
5. Молярний об’єм газу. Закон Авогадро ................. 39
6. Відносна густина газів 48
7. Умови виникнення,
безпечне використання
горіння і повільного
окиснення, керування ними ................. 59
8. Реакції сполучення. Поняття про оксиди, сульфіди.
Реакції розкладу 67
9. Керування хімічними реакціями.
Використання продуктів
й енергетичного ефекту хімічних реакцій .... 73
ТЕМА 2.
Досліджуємо й упорядковуємо хімічні елементи
10. Групуємо. Класифікуємо. Систематизуємо ................ 79
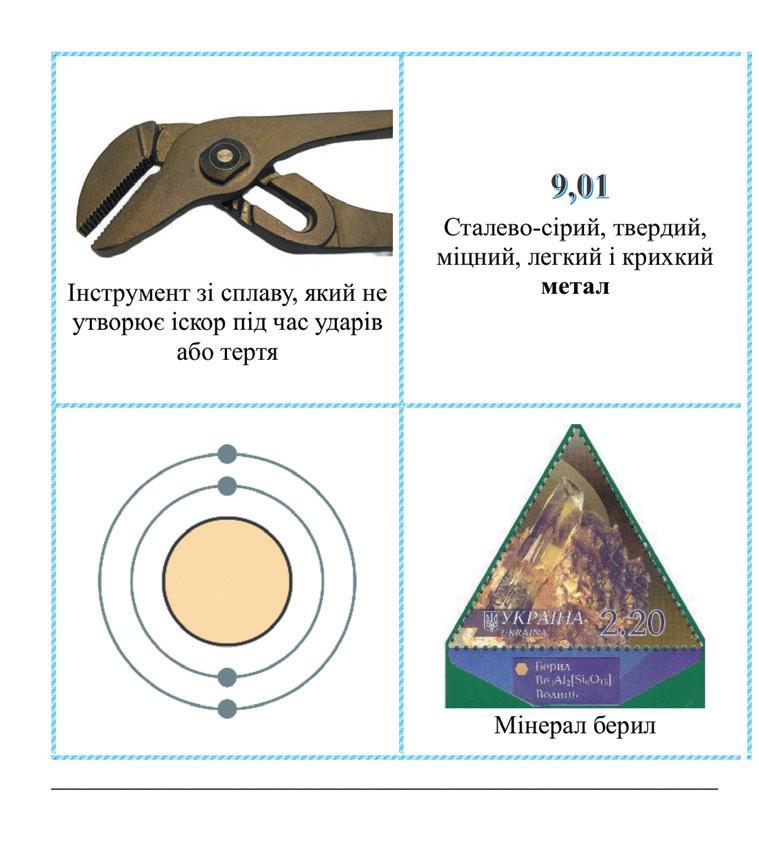
11. Лужні, солеродні, благородні… зовні. А що всередині? 85
12. Таємниці періодичної таблиці ............................... 96
ТЕМА 3.
Досліджуємо зв’язки між атомами, молекулами, йонами
13. Ковалентний зв’язок вивчи оперативно кооперативно 111
14. Йонний зв’язок. Ступінь окиснення .......... 119
15. Таємниці водневого
гального розвитку; •поділимося результатами досліджень
й оцінимо здобутки, сплануємо нові дослідження;
•виявимо й усунемо прогалини в знаннях і вміннях;
•дослідимо хімічні реакції;
•упорядкуємо хімічні елементи;
•дізнаємося про зв’язки між атомами, молекулами, йонами;
•проаналізуємо будову, властивості, застосування металів і сплавів.
Підручник створений, щоб допомогти тобі розвинутися і вдосконалитися, глибше зрозуміти хімію, відчути її важливість і практичну значущість. Ця навчальна книжка містить матеріал для повторення найважливішого з вивченого в 7 класі, а також до чотирьох тем, поділених на підтеми, що мають наскрізну нумерацію (див. Зміст). У вступній частині підручника Цікава подорож світом хімії триває! разом із новими персонажами й персонажками зактуалізуєш знання про кроки експериментального методу, застосуєш уміння аналізувати й оцінювати інформацію, змоделюєш молекули, пригадаєш символи хімічних елементів і витлумачиш хімічні формули, порівняєш хімічний склад і молекулярні маси речовин тощо. Виконання вправи-криголама в рубриці дасть змогу підготуватися до опанування нового матеріалу в групах (за методом «Перевернутий клас», співпрацюючи наживо і/або використовуючи технічні засоби комунікації). У рубриках , які починаються зі слів експериментуй, досліджуй, моделюй, обчислюй, аналізуй, прогнозуй тощо, ти знайдеш ідеї та поради для групової роботи. Інформація, яка знадобиться тобі для досягнення запланованих результатів навчально-пізнавальної діяльності, міститься в рубриці ОПРАЦЮЙ ІНФОРМАЦІЮ,
інформації в додаткових джерелах чи моделювання
в інтернеті…» та позначених піктограмою .
в підручнику ілюстрації, інфографіка, схеми, приклади зі щодення тощо. Також зможеш скористатися Тлумачним словничком, предметним й іменним покажчиками, розміщеними наприкінці підручника.
На сторінках інтерактивного додатку завдяки світлинам, малюнкам, відео, 3D-сценам, іншому інтерактивному контенту поринеш у цікавий і розмаїтий світ хімії. Ти матимеш змогу розв’язати (індивідуально
Орест і Квітана — звичайнісінькі підлітки, яким довелося переїхати до іншого міста й змінити школу. Схожі історії трапилися ще з декількома їхніми ровесниками й ровесницями. Так усі вони потрапили до одного 8 класу. І клас, і щойно прибулі сприйняли одне одного доброзичливо. Не минуло й місяця, як вони стали класною (з усякого погляду!) командою (мал. 1).









Завдання

комунікації: стисло сформулюй два правдиві й одне неправдиве твердження про себе, безпечне дослідження природи, вивчене з хімії торік. Запропонуй оцінити правдивість твоїх тверджень й оціни твердження інших. Візьми участь у формулюванні спільних висновків за результатами обговорення. Приклад виконання завдання подано за QR-кодом.
пані Олени.
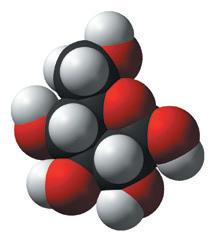
Твердження 1. У школі я
а вдома перевтілююся в кішку-алхімікиню й експериментую. Зокрема, дистилюю з водяною парою подрібнену котячу м’яту (Nepeta cataria), щоб видобути з неї якомога більше запашної речовини. Ця духмяна сировина містить непеталактон — складник котячого філософського каменю.
Твердження 2. У моєму дослідженні незалежною змінною може бути температура дистиляції (її змінюю й аналізую результат), залежною (вимірюваною) — маса непеталактону, який водяною парою
екстрагую з подрібненої сировини. Я контролюю сталість об’єму води, ступінь подрібнення м’яти тощо.
Твердження 3. Маса молекули непеталактону більша за масу молекули актинідину, який міститься у валеріані лікарській (Valeriana officinalis). Восьмикласники
від
Натомість цілком вірогідним видалося те, що з подрібненої рослинної сировини дистиляцією з водяною парою екстрагують запашну речовину, а кількість корисного продукту залежить від температури дистиляції. Адже зависока температура може призвести до руйнування непеталактону, а занизька
рослинної сировини. А чи справді в котячій м’яті міститься непеталактон?
наявності непеталактону
підтвердили результатами пошуку в додаткових джерелах, зокрема в інтернеті за ключовими словами nepetalactone, chemical, behind, catnip’s, effect. Цифрову 3D-модель молекули непеталактону створили
визнають як таке, що має значну вагу та вплив у певній сфері.
Надійне джерело інформації постійно надає точну, перевірену інформацію, яку фахова спільнота вважає вірогідною.
Перевіряй факти!
сунку https://molview.org/.

во, скориставшись онлайн-версією
енциклопедії України https://www.pharmencyclopedia.com.ua/,
перевірити, чи справді
стосунку https://molview.org/
C10Н13 є в обох формулах (мал. 2). Отже, маса молекули непеталактону більша
Ar (H) = 1 Ar (C) = 12 Ar (N) = 14 Ar (O) = 16
Mr (C10Н13HO2) = (10 ∙ 12 + 13
Mr (C10Н13 N) = (10 ∙ 12 + 13 ∙ 1) + 1 ∙ 14 = 123 + 14
Mr (C10Н13 HO2) > Mr (C10Н13N)
2
3
4 Поясни, фізичними чи хімічними змінами є явища, описані в поетичних рядках, створених штучним інтелектом (ШІ): «Залізний велетень у білій тиші ржавіє, Лід зухвало вправно трощив він, Чи є порятунок від швидкоплинного часу?»; «Ранкова роса, На сонці тане швидко, Парою стає».
Виконай інтерактивну вправу за QR-кодом.
5
Порівняй, не вдаючись до точних обчислень, якісний і кількісний склад непеталактону
привабливість для котових рослини Actinidia polygama може зумовлювати її здатність відлякувати комарів. Піддослідних котів, оброблених ззовні непеталактолом, комарі кусали вдвічі рідше, ніж котів, яких не обробляли цим ом.
Під час пресконференції в Університеті Івате (Iwate) 19 січня 2021 року професор Міядзакі (Masao Miyazaki)
повідомив, що в дослідженні використали 25 котів. Також він додав, що співчував котикам, тому врешті-решт використав у дослідженні свої руки, помістивши їх приблизно на 30 хвилин у контейнери з комарами. Руку, яку не змащували непеталактолом, комарі кусали, а оброблену ним — майже ніколи. Професор уважає, що реакція на Actinidia polygamа пов’язана з поведінкою котових, які полюють, ховаючись у кущах, де багато комах. Результати дослідження опубліковано в американському науковому журналі «Science Advances»2 .
Котикам було некомфортно
в контейнерах із комарами,
коти зазнали страждань.
Це негуманний неетичний
експеримент. Згадай
лишень, як сверблять місця
комариних укусів. Не можна
випробовувати ефективність
хімічних засобів на тваринах.
А як уважаєш ти?



Треба ретельно зважувати
ймовірну користь і можливий ризик
або шкоду для дослідників / дослідниць і піддослідних, зокрема
Професор співчував піддослідним, тож зрештою вирішив
віддати на поталу комарам свої

А як уважаєш ти?
8 Дізнайся з додаткових джерел інформації:
• про альтернативні
котів.
А сайт інтернет-магазину,
як-от Google Scholar, SpringerLink
12
стого портфоліо досягнень.
13 Виконай додаткові вправи. https://drive.google.com/drive/folders/1aQcVlyjL_I6lYq6gQyhoBKjVMdaaHd4Y?us p=sharing
https://docs.google.com/document/d/1yRjjccgts4yCJtHx9WyJOf93F12Gb9Xr/ edit?usp=sharing&ouid=111733460487814469435&rtpof=true&sd=true
https://docs.google.com/document/d/1jxUfCv0qL2CFxBsn18yYgpHgmFUtrDaJ/ edit?usp=sharing&ouid=111733460487814469435&rtpof=true&sd=true








1.

пані Олени.
Твердження 1. Відбулися хімічні
це свідчить утворення бульбашок в окропі під час нагрівання води до температури кипіння за нормального атмосферного тиску.
Твердження 2. Відбулися хімічні зміни — перетворення речовини на інші (мал. 1.2). Про це свідчить утворення бульбашок у воді, крізь яку пропустили електричний струм.
Твердження 3. Відбулися хімічні зміни — перетворення речовин на інші речовини (мал. 1.3). Про це свідчить поява бульбашок у воді навколо зеленої рослини в



Мал. 1.2. Звідки у воді стільки бульбашок? Вона кипить?
ЕКСПЕРИМЕНТУЙ у групі

Мал. 1.3. Який газ поступово заповнив пробірку, витіснивши з неї воду?
Візьми участь в обговоренні, плануванні, виконанні досліджень для підтвердження чи спростування природи змін (утворення бульбашок) у дослідах, про які повідомила пані Олена.
Як відбулося обговорення? Чи було воно толерантним, а наведені аргументи — переконливими? Чи раціональним виявився складений план? Оціни за шкалою 1–5. Підтверджено чи спростовано гіпотези? Наскільки вдалою була вибрана стратегія?
уваги для наступних
у повітря. Після досягнення точки кипіння води формуються бульбашки водяної пари. Наблизившись до поверхні рідини бульбашки розширюються і лопаються. Адже біля поверхні тиск нижчий, ніж у товщі води. Потрапивши
ня просте: утворення бульбашок у воді внаслідок проходження крізь неї електричного струму зумовлене перетворенням води на два гази. Це кисень і водень.
Отже, ця зміна хімічна, бо з однієї речовини утворилося дві. Експериментально доведено, що внаслідок електролізу води молекул водню утворюється вдвічі більше, ніж молекул кисню. Відстані між молекулами газів набагато більші за самі молекули. Тож розмірами молекул можна знехтувати. Саме
шиться тим самим: V(H2 ) : V(O2) = 2 : 1.
Зрозуміти суть і природу перетворення допоможе моделювання (мал. 1. 4).





Розкладання води на кисень і водень потребує надходження енергії (електричної) від зовнішнього джерела. Водень із киснем утворює вибухонебезпечну суміш, тому зібраний водень перевіряють на чистоту





Мал.


















водопровідною водою. Закривши наконечник пальцем однієї руки, пальцями другої спочатку сильно потягла, потім відпустила поршень. Ці дії дівчинка повторила тричі. За результатами спостережень Квітана дійшла висновку (вибери правильний), що: А вода щоразу сильніше закипала, бо внаслідок тертя поршня об внутрішні стінки шприца нагрілася
усій товщі води внаслідок різкого зниження тиску утворилася велика кількість дрібних
4
1
2
— 2000 г;
3) хімічні формули газів X і Y, якщо розчинність у воді газу X за нормального атмосферного тиску й температури 50 °С приблизно така сама, як розчинність газу Y за температури 6 °С і такого ж тиску.
5 Поміркуй, які з описаних вище хімічних перетворень можуть бути використані на міжнародних космічних станціях
6



Твердження 1. Маса реактантів (парафіну й
масі продуктів реакції (вуглекислого газу й води). Тобто загальна маса реагентів (парафіну, кисню, вуглекислого
нюється.
Твердження 2. Під час горіння свічки хімічна
ється на світлову і теплову.
Твердження 3. Закони збереження маси та енергії під час хіміч-
про фізичні зміни і хімічні перетворення, які відбуваються цієї
Свічки почали виготовляти тисячі років тому, однак темою наукового дослідження
Горіння свічки — це складний процес, під час якого відбуваються і фізичні, і хімічні зміни. Парафін — суміш речовин, молекули яких містять атоми Карбону й Гідрогену. Коли запалюють свічку, парафін біля ґнота плавиться і перетворюється на рідину. Розплавлений парафін підіймається ґнотом, випаровується і реагує з киснем повітря. Утворюються вуглекислий газ і вода. Унаслідок реакції виділяються світло і тепло. Теплова енергія витрачається на плавлення і випаровування парафіну, нагрівання його випарів до температури займання. Реакція закінчується, якщо закінчується паливо (парафін) або немає доступу
кисню.
Атоми Карбону, які були в молекулах складників парафіну, унаслідок повного згоряння стали складниками молекул вугле-
кислого газу, атоми Гідрогену — складниками молекул води.
Атоми Оксигену, які були в молекулах кисню, стали складниками і молекул вуглекислого газу, і молекул води. Загальна кількість атомів Карбону, Гідрогену, Оксигену в молекулах
продуктів реакції (CO2, H2O) така сама, як у молекулах реактантів (наприклад C25H52, O2).
Закони збереження маси та енергії під час хімічних реакцій є фундаментальними законами природи й діють у будь-якій точці Всесвіту незалежно від того, де відбувається хімічна реакція — на Землі чи поза нею. Багато космічних місій та експериментів у космосі підтверджують це. Наприклад, хімічні реакції, що відбуваються в ракетних двигунах або в експериментах на Міжнародній космічній станції (МКС) підтверджують універсальність цих законів збереження.
Підсумуй, заповнивши пропуски у формулюванні:
Атоми під час хімічних змін …. Тому
реактантів … масі продуктів реакції. Зберігається й …, яка переходить з однієї форми в іншу, поглинається або ….
варіанті)?
Після обговорення наполягатимеш
зробити для перевірки гіпотез?
Як змінюється склад








4. Поміркуй,
2.2: а) наочніший; б) безпечніший.


Мал. 2.2. Оцінюй ризики! Експериментуй безпечно!
5. Запропонуй дизайн досліду для підтвердження того, що світлова енергія може перетворитися на хімічну, а сума
реактантів і продуктів реакції не зміниться.
1. Загальна маса розчину дорівнює
солі, що підтверджує закон збереження маси.
2. Унаслідок горіння свічки її
свічки перетворюється на енергію.
3. Унаслідок випаровування води її маса зникає разом з енергією, витраченою на випаровування.
4. Під час фотосинтезу в рослинах енергія світла перетворюється на хімічну енергію, яка зберігається в молекулах глюкози. Це підтверджує закон збереження енергії в хімічних реакціях.
Перевір відповідь, виконавши інтерактивну вправу за QR-кодом.
2 На терезах зрівноважено дві закорковані посудини (мал. 2.3). Нахиливши таку посудину можна змішати рідини, які були в її різних колінах. Спрогнозуй, чи порушиться рівновага терезів, якщо змішали рідини:
удома.
формі (на вибір — подкаст, малюнки, фото, відео тощо). 6 Зістав результати свого дослідження за методикою, описаною на с. 20 (дослідження 2), із поданими на
суперечать
ним? Опиши ймовірний дизайн дослідження, результати якого
Я вважаю, що маса
спеченого хліба дорівнює
масі інгредієнтів, узятих
для приготування тіста —
борошна, води, дріжджів, цукру тощо. Закон
збереження маси працює
в усіх сферах життя!



Я вважаю, що на Місяці
закон збереження маси
виконується лише в одному
випадку із шести, адже
вага тіл на Місяці вшестеро менша ніж на Землі.
Не знаю, що й сказати.
Зважувати треба... І зважати

Ти ще скажи, що ймовірність натрапити на єдинорога біля своєї домівки 50 % — або натрапиш, або ні . Не плутай масу з вагою. Вага залежить від сили тяжіння, а маса — ні.
Закон збереження маси діє
хімічних елементів. Поясни, які навички тобі вдалося вдосконалити під час виконання завдання. Порівняй свої думки з висновками однокласників й однокласниць.
12




3.

Твердження 1. Найзручніший спосіб інформування про суть хімічної реакції між воднем і киснем наведено на першому фрагменті колажу (мал. 3.1, 1). Будь-хто з хімічної спільноти (і не лише!) у будь-якому куточку світу



Твердження 2. За допомогою хімічних формул, коефіцієнтів, математичних символів плюс (+), мінус (–), дорівнює (=) тощо можна створити знакову модель хімічної реакції.
Твердження 3. Створюючи знакову модель хімічної реакції, не можна змінювати індекси в хімічних формулах.
речовин.
1)





2) словесний опис: «У двох молекулах водню (проста речовина) чотири атоми Гідрогену. Молекула кисню (проста речовина) складається з
атомів Оксигену. Дві молекули водню і молекула кисню перетворюються на дві молекули води (складна речовина). Кожна молекула води складається з атома Оксигену й
Гідрогену»; 3) опис за допомогою хімічних формул і математичних символів: 2Н2 + О2 → 2Н2О.
Саме цей опис найкомпактніший. Замість стрілки
поставити знак дорівнює
рівнянні вказують
і в математичному.
добираючи коефіцієнти, а змінюючи індекси в хімічних формулах реактантів і продуктів реакції. Звісно ні, бо індекси позначають кількість атомів кожного елемента в молекулі, а зміна індексів призведе до зміни формули речовини. Правильний спосіб скласти хімічне рівняння — записати
розкладається



але неправильного способу перетворення схеми реакції
кисню. Це помилка! Адже символом О позначають окремий атом
1






2
H2 + Cl2 → HCl; N2 + О2 → NО; С + О2 → СО2; СО + О2 → СО2;













SО2 + О2 → SО3; P4 + О2 → P2О3; Mg + О2 → MgO; Ca + P → Ca3P2.
3

Уміння аналізувати і синтезувати інформацію, потрібне для складання хімічних
а) 2H2 + Br2 = 2HBr; Ca + О2 = 2CaO; H2S + 3О2 = SО2 + H2O; 2Al + 3О2 =Al2O3; в) N2 + 3H2 = 2NH3; Al + 3O2 = Al2O3; C + O2 = 2CO; 2SO2 + O2 = 2SO3; д) Fe + 3Br2 = FeBr3; 2H2O2 = 2H2O + O2; Al + 3HCl = AlCl3 + H2; 2KClO3 = 2KCl + 3O2;

б) Mg + 2HCl = MgCl2 + 2H2; 2P4 + 5О2 = 4P2О5; CaCO3 = CaO + 3CO2; 3Ca + N2 = Ca3N2.
г) 2Li + Cl2 = 2LiCl; 2Na + 2H2O = 2NaOH + H2; Zn + 2HCl = ZnCl2 + H2; Cu + 2S = Cu2S;
е) Ca + 2H2O = Ca(OH)2 + H2; Ag + O2 = Ag2O; Ca + 3N2 = Ca3N2; CH4 = C + 4H2.
6

Долучися до розроблення: а) правил і виготовлення


Підготуйся

Твердження 1. Про перебіг хімічних реакцій можна зробити висновок за деякими змінами, які спостерігають на макрорівні. Це поява чи зміна кольору, запаху. Такі зміни людина може побачити чи відчути безпосередньо. Або ж виявити, скориставшись спеціальними технічними засобами, сенсорами наприклад (мал. 4.1).
Твердження 2. Якщо уважно придивитися, особливо скориставшись збільшувальним
склом, можна побачити руйнування молекул реактантів, перегрупування атомів з утворенням молекул продуктів реакції (мал. 4.2).
Твердження 3. Маса речовини прямо пропорційна масі її молекули, атома чи іншої структурної частинки.

Мал. 4.1. «Розумний» прилад, який виявляє молекули чадного
газу в повітрі й сигналізує про перевищення їхнього
гранично допустимого вмісту

Мал. 4.2. А якщо придивитися? Невже побачиш молекули та атоми?
сорною системою людини. Наприклад,
ли кисню замало (мал. 4.3), щоб побачити утворення водяної пари, відчути на дотик сконденсовану
Відшукай в інтернеті за ключовою фразою Hydrogen and Oxygen make Water відео й переглянь його.





що реагує чи
стають, користуючись фізичною величиною
енергія (теплова, світлова, звукова, механічна)
речовини скорочено позначають буквою латинської абетки n (вимовляємо
величина кількість речовини має свою одиницю.
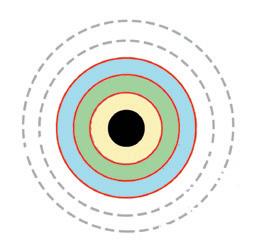
Кількість речовини (n) — фізична величина, яка прямо пропорційна кількості (N) структурних одиниць (молекул, атомів тощо) речовини в її порції. Моль — одиниця кількості речовини.
будь-якій речовині кількістю
Це величезне число (602 214 076 000 000 000 000 000) є точним значенням сталої Авогадро (NA), якою характеризують кількість структурних частинок у речовині кількістю 1 моль:
Числове значення молярної маси (М) приблизно дорівнює числовому значенню відносної молекулярної (формульної) маси речовини (Mr). Приклади наведено в таблиці 4.1.
Назва речовини Маса речовини відносна
Вуглекислий газ
r(CO2) = 44 M(CO2) = 44 г моль
Залежність маси від кількості речовини прямо
1 Розподіли твердження на
1. Моль — одиниця кількості речовини.
2. Моль — одиниця сталої Авогадро.
3. Порція води кількістю речовини 1
602 000 000 молекул води.
4. Маса порції води кількістю речовини 0,1 моль становить 1,8 г.
5. Маса речовини дорівнює добутку кількості речовини й молярної маси.
6. Кількість речовини
QR-кодом.
2 Розглянь діаграму
N(X) : NA = = m(X) : M(X) ?

становить 2,51 моль
Б масова частка води в організмі Тимофія близько 65 %. Маса хлопчика 55 кг. Відповідно кількість речовини (моль) води в Тимофієвому організмі близько 1000 моль
В норма споживання гарячої води, якщо лічильник не встановлено, дорівнює 166 667 моль на особу Г середня витрата води на миття у ванні — 150 л. Витрата води під час миття під душем близько 15 л/хв. Густина води 1 кг/м3. Якщо миття


Інгредієнти: кефір — 900 мл; борошно пшеничне — 700 г; яйце куряче — 1 шт.; цукор-пісок (C12H22O11) — 0,585 моль; сода харчова (NaHCO3) — 0,086 моль; ванілін (C8H8O3) — 0,00004 моль; сіль кухонна (NaCl) — 0,5 г; олія для смаження — 30 г.
до чарівних алхімічних скриньок: кількість речовини (моль), зазначена на скриньці, відповідає масі речовини (г), зазначеній на ключі.



9
Обчисли:







12 Розв'яжи кросворд,
додатковими джерелами інформації. Перевір за QR-кодом відповідь, виконавши інтерактивну вправу.
Горизонтально:
1. Наука, яку Авогадро вивчав самотужки.
3. Фах, який здобув Авогадро в університеті.
5. Місто, в університеті якого навчався і викладав Авогадро.
6. Одиниця кількості речовини.
8. 12294 Авогадро – це ....
9. Розділ фізики, з яким пов'язаний початок
наукової діяльності Авогадро.
11. Ім'я Авогадро.
Вертикально:
2. Маса речовини кількістю 1 моль.
4. Країна, у якій народився Авогадро.
7. Мінерал складу (K,Cs)BF4
10. Відношення кількості молекул речовини до кількості речовини – ... Авогадро.
12. ... речовини дорівнює добутку кількості
речовини на її молярну масу.
13

Твердження 2. Гази мають малу густину, тому утворюють щільний шар у верхній частині контейнера, у якому містяться.
Твердження 3. Ідеальний газ — це теоретична модель, яку використовують для спрощення обчислень, якщо взаємодія між молекулами газу та їхній
зможеш пригадати, що характерною
речовини є те, що
ні


1 2 3


волюційним
розумінні природи газів і хімічних реакцій між ними, сприяв розвитку уявлень про молекули.
Мал. 5.2. Срібна медаль, присвячена пам’яті Амедео Авогадро За однакових умов (тиск і температура) гази однакового об’єму містять однакову кількість молекул.
Молярний об’єм Vm — об’єм речовини кількістю 1 моль. Як відміряти кількість газу? У хімічних розрахунках замість мас газуватих реактантів і продуктів зручніше використовувати їхні об’єми. Щоб відрахувати певну кількість структурних одиниць газуватої речовини, треба знати, як пов’язані кількість речовини, кількість структурних одиниць (атомів, молекул тощо) у ній та її об’єм. Cпочатку з’ясуймо, що таке молярний об’єм.
Тобто молярний об’єм — це відношення об’єму V речовини X до її кількості n: Vm (X) = V(X) n(X) .
Аналізуючи формулу, за якою обчислюють молярний об’єм, легко
ρ(X) = m(X) V(X) . Для речовини кількістю 1 моль ρ(X) = M(X) Vm(X) .
Відповідно Vm(X) = M(X) ρ(X) . Обчислімо молярний об’єм води за різних умов: • за температури +4 °С й нормального атмосферного тиску густина води в рідкому стані сягає 1 г см3 , тож її
Vm(H2O) = M(H2O) ρ(H2O) ;
Vm(H2O) = 18 г/моль 1 г/см3 ; Vm(H2O) = 18 см3 моль ;
Vm(H2O) = M(H2O) ρ(H2O) ; Vm(H2O) = 18 г/моль 0,9 г/см3 ;
Vm(H2O)




розташування і швидкості руху структурних частинок речовини в газуватому, рідкому, твердому стані; б) суть молярного об’єму й зілюструвати пряму пропорційну залежність
моделей із-поміж презентованих
групою. Які переваги й недоліки вибраних більшістю голосів
n(H2) : n(N2) : n(NH3) = 3 : 1 : ?; V(H2) : V(N2) : V(NH3) = ? : 1 : ?.


















А у кубику з ребром 1,9 см
Г у воді об’ємом 18 мл
об’ємом 22,4 л
Перевір
мом 0,07 л (н. у.). Обчисли
9
Завдання

Твердження 1. Щоб надувна
Твердження 2. Відношення числових значень густин газів дорівнює відношенню числових значень їхніх молярних мас. Твердження 3. Густину
через густину іншого. Які твердження правильні? Яке
участь в обговоренні, плануванні, виконанні дослідження, яке влітку
міжнародного наукового табору правильно дібрати
таких: колір, безпечність, розчинність, смак, ціна, запах. Яку стратегію виконання завдання
Які з відомих вам газів (азот, кисень, вуглекислий газ, метан, водень, гелій тощо) відповідають дібраним критеріям? Скористайтеся додатковими джерелами інформації і сформулюйте висновок. Зіставте його з висновками, яких дійшли інші групи. Після обговорення ухваліть разом остаточне рішення.
Під керівництвом досвідчених науковців і науковиць юні дослідники й дослідниці порівняли деякі властивості кількох газів. Результати обговорили, застосувавши мозковий штурм.
Скористайтеся і ви цим методом, виконуючи завдання.
1 Розгляньте малюнок 6.2. Сформулюйте й


1 2







ρ(X) = Mr(X) : Vm(X) ρ(X) = Vm(X) : Mr(X)
(X) = Vm(X) : M(X) ρ(X) = M(X) : Vm(X)
•
характеристику газів?
• Як змінюються густини газів зі збільшенням
• Що дає підставу стверджувати, що
величинами?
• Що є коефіцієнтом пропорційності
густини від молярної маси газу?
Назва Хімічна формула

тиск, вологість повітря, швидкість вітру тощо. Без цих відомостей швидкі (за декілька годин) точні прогнози погоди були б неможливі.
Від ХІХ ст. Собачу печеру (італ. Grotta del Cane) часто описували в підручниках, щоби продемонструвати чималу густину й неабияку небезпечність вуглекислого газу. Ілюстрували явища, що відбувалися в печері, науковою демонстрацією (мал. 6.2) з такою самою назвою, але без жертв серед тварин. Більше про Собачу
печеру й ризики неправильного поводження з вуглекислим газом
джерел інформації. Які параметри впливають
(мал. 6.5)?
1. Нижня межа вибуховості (Lower Explosive Limit, LEL): мінімальна об’ємна частка
2. Верхня межа вибуховості (Upper Explosive Limit, UEL): максимальна об’ємна
3.
вдихати його ризиковано — унаслідок різкого зниження рівня кисню в організмі людина може знепритомніти й навіть померти. Запаси Гелію на Землі обмежені, а без нього припиниться виробництво чипів, не працюватимуть медичні томографи, адронний колайдер тощо. Тому, використовуючи в повітроплаванні, наукових дослідженнях знання про підіймальну
віддавати перевагу поширенішому
його
тину. Густину D газуватої речовини
речовиною Y позначають D(X/Y). Густина D газуватої речовини X за газуватою речовиною Y дорівнює відношенню числових
густин
цих газів, виміряних за однакових умов: D(X/Y) = ρ(X) ρ(Y) . Густина речовини
об’єм V: ρ(X) = m(X) V(X) ; ρ(Y) = m(Y) V(Y) .
ρ(X) = M(X) Vm(X) ; ρ(Y) = M(Y) Vm(Y) .
Отже, M(X) / Vm(X) M(Y) / Vm(Y) .
Для газуватих речовин за однакових умов Vm(X) = Vm(Y), тому
D(X/Y) = M(X) M(Y) .
вигляду:
Отже, густина газуватої речовини X за газуватою речовиною Y дорівнює відношенню молярних мас М цих газів. Цей зв’язок відображено на схемі (мал. 6.7). Мал. 6.7.
Vm(X) = V(X) n(X) D(X/Y) = M(X) M(Y) M(Y) = M(X) D(X/Y) M(Y), г моль M(X), г моль
M(X) = D(X/Y) M(Y) D(X/Y)
Тобто що більша відносна молекулярна (формульна) маса газу, то більша його густина. Очевидно, що густина одного газу за іншим не має одиниць (так само, як і відносна молекулярна чи формульна маса).
Найчастіше визначають густину газу за воднем Н2, киснем О2 й повітрям. Наприклад, формула обчислення відносної густини газу X за воднем має такий загальний вигляд:
D(X/Н2) = Mr(X) Mr(Н2) ; D(X/Н2) = Mr(X) 2 .
Середня молекулярна маса повітря дорівнює 29. Тому надувна кулька, заповнена вуглекислим газом, відносна молекулярна маса якого 44, лежатиме на підлозі. А така сама кулька з воднем, відносна молекулярна маса якого 2, полине у височінь. Аналізуючи схему на малюнку 6.7, легко дійти висновку, що за експериментально визначеною відносною густиною невідомого газу X за відомим газом Y можна обчислити молярну (а отже, і відносну молекулярну) масу невідомого газу X:
М(X) = D(X/Y)М(Y); Mr(X) = D(X/Y)Mr(Y). Зроби висновок, чи правильними були твердження 2 і 3
Олени, подані у вправі «Криголам». 1 Доповни текст, скориставшись довідкою.
Довідка: Не / СО2 / N2 / H2 / О2; густину меншу
/ має приємний запах / незаймистий / підтримує горіння / має найбільшу підіймальну силу; банер / контейнер / із рекламним логотипом / із вимірювальною апаратурою; температура / тиск / швидкість вітру / вологість; клімат / атмосфера; фізика / хімія / безпека; початок / кінець.
2 Поясни:
а) який газ, на твою думку, найдоцільніше використати для наповнення метеозонда;
б) які результати дослідів й опрацювання інформації дали змогу тобі й іншим юним дослідникам і дослідницям правильно дібрати газ для метеозонда;
в) у якій кульці (мал. 6.8) метан (СН4), а в якій — сірчистий газ SО2. Обчисли густину метану за сірчистим газом; Перевір відповідь, виконавши інтерактивну

скляні прозорі хімічні
стакан Г-подібною скляною трубкою повільно надходить водень;
б) на шальки терезів поставили два однакові скляні прозорі хімічні стакани догори отвором. Терези перебувають у рівновазі.
4 Проаналізуй діаграму
Г Температура самозаймання
Перевір свій результат, виконавши інтерактивну вправу.
А Що більша молярна маса газу, то більша його підіймальна сила.
Б Що більша відносна молекулярна маса газу, то менша його густина.
В Що більша густина газу, то більша його
Г Що більша густина газу за повітрям, то менша маса молекули газу.
6 Порівняй рекламні повідомлення. Це
чи наукова фантастика? Неточності через необізнаність чи свідомі перебільшення? Аргументуй свою думку, скориставшись додатковими джерелами інформації. Зістав свій висновок із поданим за QR-кодом.
Чи погоджуєшся з ним? Чому? Що вважаєш за потрібне додати до нього?
ВІДЧУЙ МАГІЮ СТРАТОСФЕРИ З НАШОЮ ВОДНЕВОЮ КАПСУЛОЮ!
Мрієш побачити Землю з висоти, що перевищує висоту пташиного польоту? Запрошуємо тебе в незабутню подорож у стратосферу нашою мегакомфортабельною водневою капсулою! Дістань неймовірний досвід високого польоту з нейтральним викидом.
відкрий нові горизонти з нами! ВІДЧУЙ МАГІЮ КОСМОСУ З НАШОЮ ВОДНЕВОЮ КАПСУЛОЮ!
Хочеш відчути, як це — перетнути невидиму межу між атмосферою і космосом? Запрошуємо тебе в незабутню подорож у стратосферу нашою





NH3 He CH4
N2O
C3H8 CO2




тового містечка.
Твердження 2. Пожежа
могла статися внаслідок
ня, а не підпалу. Твердження 3.
Візьми участь у плануванні й
дослідження, результати якого дадуть змогу підтвердити або спростувати твердження про те, що скляні уламки можуть призвести до лісової пожежі.
Оцініть ризики дослідження, сформулюйте й обговоріть правила, яких треба дотримуватися
дослідів (мал. 7.1). Доберіть з-поміж зображеного на малюнку








Мал. 7.2. 1 Збільшувальна лінза. 2

скла. 3 Хмиз, ломаччя.
4 Кольчужна рукавичка для запобігання порізам.
Умови виникнення і припинення горіння цікавили людину із часів її першого знайомства з вогнем. Що саме потрібно для виникнення горіння? Насамперед — реактанти: речовина, яка горить (паливо), і кисень (або інший окисник). Паливо й кисень мають тісно контактувати, однак цього зазвичай замало. Дрова в грубці не спалахують самі, хоча навколо них повітря, яке приблизно на 1/5 складається з кисню. Щоб запалити
треба
до такої, щоб почалася хімічна взаємодія з киснем.







Мал. 7.4. Доповни твердження: 1 Можлива причина займання
2
3 Забудькуватість
Що об’єднує всі ці способи? Те, що для нагрівання палива до температури займання потрібна енергія.
У реакції горіння енергія активації забезпечує подолання енергетичного бар’єра між реактантами (наприклад, целюлозою і киснем) і продуктами реакції (вуглекислим газом і водою). Енергія ΔЕ, що вивільняється внаслідок руйнування старих й утворення нових зв’язків між частинками речовини (мал. 7.5), виділяється у вигляді тепла і світла. Для початку горіння потрібне зовнішнє джерело енергії, наприклад, запалений сірник або інше джерело. Енергія із цього джерела

— тонкої дерев’яної палички, — треба ввести її кінчик у полум’я пальника. У цьому місці деревина нагріється до потрібної температури й займеться. Найближча до
вогню ділянка нагріється від тепла, що виділяється внаслідок горіння. Процес поширюватиметься, захоплюючи нові й
нові ділянки скіпки.
Інколи речовина, що горить, є порошком (вугільний пил у шахтах) або дрібними розпорошеними

краплями (аерозоль гасу, бензину). Унаслідок підпалювання таких сумішей речовин із







палити, а такий самий із водою
решти однакових умов не займеться; б) Орест прогнозує: вичавлену зі свіжих апельсинових шкірок на вогнетривку керамічну плитку калюжку запашної есенції важко підпалити сірником. А
полум’я свічки дрібнесенькі розпорошені
цієї ж есенції згорять миттєво.
5 Змоделюй: а) на гладкій горизонтальній поверхні за допомогою
змоделюй плями нафти й нафтопродуктів. Скористайся водою (запалювати нічого не треба!), щоб пояснити, чому цей засіб не підходить для гасіння нафти, бензину, гасу, які горять. Запропонуй ефективні способи гасіння розлитих нафтопродуктів у побуті. Поясни свій вибір
огляду на умови виникнення і припинення горіння. Зваж, що користування деякими засобами гасіння вогню потребує спеціальних навичок (поясни чому), оціни ризики користування ними; б) гніздо смітної курки й досліди
із часом. Вислови припущення
тримувати сталу температуру
торі. Перевір свою гіпотезу експериментально або відшукай інформацію в інтернеті й підготуй повідомлення для учнів й учениць молодших класів.
6 Порівняй із

тощо. Добери приклади на підтвердження своєї думки.
«Зерно є одним із найнебезпечніших продуктів сільського господарства з погляду вибухо- й пожежонебезпечності». Зерносховища — зони підвищеної пожежної небезпеки
9 Виконай інтерактивні вправи.
1. Вибери формули газів, які підтримують



Твердження
Твердження 2. Утворення водню і
електролізу води є реакцією розкладу.
Твердження 3. Горіння метану
лучення, і реакцією розкладу.
Які твердження правильні? Яке — неправдиве?
МОДЕЛЮЙ у групі
1. Долучися в групі до створення сценарію однієї
яка дасть змогу змоделювати або реакцію згоряння водню в кисні, або реакцію електролізу води. Розподіліть ролі, розробіть атрибутику з підручних матеріалів, придумайте
створеної моделі. Оцініть за результатами моделювання правильність тверджень 1–2 пані Олени.
2. Обговоріть і доповніть визначення реакцій сполучення і розкладу, заповнивши пропуски у формулюваннях:
на
молекули обох речовин складаються з
двох хімічних елементів, одним з яких є Оксиген. Такі речовини називають оксидами. Подібним до води за якісним, але відмінним від неї за кількісним складом є гідроген пероксид Н2О2 (мал. 8.1, в). То гідроген пероксид теж належить до оксидів? Ні! В оксидах немає атомів Оксигену, сполучених між собою. Натомість такі атоми Оксигену є в пероксидах, наприклад у гідроген пероксиді Н2О2. Натомість чадний газ СО (мал. 8.1, г) — продукт неповного згоряння парафіну, метану тощо — є оксидом. У формулах оксидів символ Оксигену
заведено записувати другим1.





Оксиди утворюються внаслідок реакцій різних типів. Наприклад, сірка, формула якої S8 (мал. 8.2, а), згоряє в кисні блакитним полум’ям. Продукт цієї реакції сірчистий газ — оксид, у молекулі якого атом Сульфуру й два атоми Оксигену (мал. 8.2, б). Зв’язки і між атомами Сульфуру в молекулі сірки, і між атомами Оксигену в молекулі кисню
Також оксиди утворюються внаслідок розкладання деяких оксигеновмісних речовин. Мінерал малахіт, формула якого Cu2(OH)2CO3, широко використовують для виготовлення декоративних виробів (мал. 8.3, а). А внаслідок прожарювання зеленого порошку малахіту (мал. 8.3, б) утворюються чорний порошок оксиду Купруму (мал. 8.3, в), водяна пара й вуглекислий газ. Скористайтеся законом збереження маси речовини й визначте формулу одного
оксидів Купруму, проаналізувавши хімічне рівняння розкладання малахіту: Cu2(OH)2CO3 = 2 … + СО2↑ +



Кальцій оксид, який у побуті називають
вапном, добувають випалюванням вапняку (СаСО3). Формулу кальцій оксиду також визнач самотужки, проаналізувавши хімічне рівняння: СаСО3 = … + СО2↑.
Сульфіди, так само як оксиди, є бінарними сполуками. Тож формули сульфідів записують за допомогою






Сульфіди можуть утворюватися внаслідок реакцій сполучення. Рівняння цих реакцій ти легко доповниш формулами, скориставшись законом збереження маси:
8… + S8 = 8H2S; 8Fe + … = 8FeS; 8Zn + S8 = 8….
Більше про бінарні сполуки та їхні назви зможеш дізнатися, зісканувавши QR-код.
ЕКСПЕРИМЕНТУЙ у групі
Візьми участь у плануванні дослідження, яке передбачає добування купрум оксиду (CuO) в інший спосіб, ніж розкладання малахіту. Обговоріть, оцініть доступність і безпечність запропонованих способів, виберіть оптимальний. Порівняйте його зі способами, які запропонували інші групи. Ухваліть спільно остаточне рішення і перевірте його доцільність на практиці. Розробіть дизайн досліду (реального чи мисленнєвого), за допомогою якого можна довести, що речовина, яку добудете, ідентична тій, що утворюється внаслідок розкладання малахіту. Наведіть приклад вимірювань й обчислень, на основі яких можна дійти висновку
формулу добутого продукту.

























формації.
6 Перетвори схеми хімічних реакцій на хімічні рівняння. Розподіли номери схем реакцій за колонками таблиці:
1) N2 + H2 → NH3;
2) Na + Cl2 → NaCl;
3) HgO → Hg + O2;
7
5) KClO3 → KCl + O2;
6) CaO + H2O → Ca(OH)2;
7) Cl2 + KI → KCl + I2; 4) BaCl2 + H2SO4 → BaSO4 + HCl; 8) H2S + O2 → SO2 + H2O.
реакцій сполучення
формули Na2S; SiO2; SO2; SO3; CaS; Fe2S3; TiO2; Mn2O7; SeO2 за колонками: загальна
8
Завдання

правильність твоїх тверджень й оціни твердження
Твердження 1.
хімічна реакція.
пані Олени.
Твердження 2. Якщо знизити енергію активації, швидкість реакції підвищиться без зміни кінцевого результату.
Твердження 3. Швидкість природних хімічних процесів стала, людина може впливати лише на швидкість виробничих процесів, у яких використовують хімічні реакції.
Які твердження правильні? Яке — неправдиве?
ЕКСПЕРИМЕНТУЙ у групі
Візьми участь у плануванні й виконанні дослідження впливу на швидкість розкладання гідроген пероксиду1: а) його масової частки в розчині; б) температури; в) ферментів, які містяться в сирих овочах, м’ясі. Запропонуйте безпечний дизайн дослідів, зазначте його переваги. Виберіть і зреалізуйте оптимальний варіант. Оціни ефективність своєї
пришвидшує хімічну реакцію, знижуючи енергетичний бар’єр (енергію активації), але не впливає на
продукт. Розподіліть ролі, доберіть чи сконструюйте обладнання з підручних матеріалів, придумайте гасло для створеної моделі.
Апробуйте руханку на уроці фізичної культури й поясніть її хімічний зміст учителю чи вчительці.
Попросіть учителя чи вчительку фізкультури оцінити за п’ятибальною шкалою зрозумілість ваших пояснень впливу температури і/або каталізатора на швидкість хімічної реакції.
Запропонуйте інший спосіб моделювання, оцініть переваги й недоліки руханки, порівнюючи її з іншими моделями. Заповніть пропуски у формулюванні: … — це речовина, яка пришвидшує хімічну реакцію, залишаючись
енергію активації.
з різною швидкістю (наведи приклади).
століттями? Відповідь на це
керувати швидкістю




















здатності.







Мал. 9.5. Керуй хімічними реакціями вправно,
1
Швидкість природних хімічних процесів також може змінюватися під впливом діяльності людини. Наприклад, через спалювання вуглеводневого палива збільшується вміст вуглекислого газу в атмосфері. Це може призводити до того, що вода у Світовому океані стає кислішою, тому швидше руйнуються коралові рифи. Адже головним складником скелета коралів є кальцій карбонат. Ця речовина також міститься в мушлях, перлинах, шкаралупі пташиних яєць, мармурі, вапняку, крейді тощо. Також це може призвести до пришвидшення розчинення сталактитів у карстових печерах: СаСО3 + СО2 + Н2О = Са(НСО3)2
у воді вапняк розчинна у воді сполука Кальцію


1
2
3


«Найважливішою ланкою логістичного ланцюжка
4
5
6 Підготуй
перебігу яких світлова енергія: а) виділяється; б) поглинається.
7 Збери інформацію про:
а) використання каталізаторів в енергозбереженні; б) побутові пристрої,
11
кросворд. Перевір за QR-кодом відповідь, виконавши інтерактивну вправу.
Горизонтально:
1. Хімічне перетворення речовини.
5. Іржавіння заліза – це приклад повільного ....
8. Суміш вуглеводнів, яку не можна гасити водою – це ....
9. Порошковий ... повинен бути в кожній автівці.
Вертикально:
2. ... – це ефективний засіб гасіння бензину, що зайнявся.
3. Доступ кисню – це одна з трьох необхідних умов ....
4. ... пришвидшує хімічну реакцію, залишаючись після неї в хімічно незмінному стані.
6. З одного реактанту утворюється кілька продуктів – це реакція ....
7. З кількох реактантів утворюється
10. Необережне ... з вогнем – причина пожеж.
11. Щоб запалити речовину, треба нагріти
Навчайся хімії з Pi-stacja UA Швидкість хімічної





































рубрик, за якими можна розподілити фото.
запропонованих іншими учнями й ученицями
групі. Виберіть гуртом оптимальну рубрикацію
використання Універсальність рубрик
Креативність










ром (мал. 10.2): червоні (яблука, вишні), жовті (банани, лимони), зелені (ківі, лайм).
● Запропонуй інший підхід до групування фруктів, зображених на ма-
люнку 10.2.
Класифікування — складніший
процес, ніж групування. Адже передбачає не лише об’єднання об’єктів, подібних за якоюсь ознакою, а й упорядкування і систематизу-




вання їх за категоріями або класами на основі певної ієрархії чи
значених критеріїв. Класифікуючи, дослідники й дослідниці виявляють відносини
більш організовану структуру.
● Наведи приклади класифікації
природна
родній класифікації
між об’єктами, а штучну створюють
й спрощення подання і сприйняття інформації. У штучній класифікації не можна взяти до уваги всі природні











а систематизування
цілісну систему, у якій усе впорядковане й узаємопов’язане. Уміння систематизувати й користуватися системами допомагає краще зрозуміти навколишній світ. ● Наведи приклад систематизування в біології. ЕКСПЕРИМЕНТУЙ у групі
Візьми участь у плануванні й виконанні дослідження, результатом якого має стати класифікація простих речовин, наприклад, зображених на малюнку 10.4. Скористайтеся навчальними колекціями зі зразками чи імітаціями простих речовин. Подайте результат дослідження як ієрархічне дерево або візуалізуйте в інший спосіб. Порівняйте свій продукт із візуалізаціями, створеними іншими групами. Дійдіть спільного висновку щодо класифікації простих речовин.
Оцініть досконалість розробленої класифікації, сформулювавши критерії оцінювання самостійно або скориставшись поданими за QR-кодом. Визначте, штучною чи природною є ця класифікація.




















(В) за зростанням організованості результату. 2




















нович). 5. ...де все те сховане — браслет, і ..., і смарагди, і ... (Астрід Ліндґрен). 6. ...оболонку своїх дирижаблів не ..., а газом ... (Микола Трублаїні). 7. Живиця, ..., нефть кипіла (Іван Котляревський).
8. ...збільшеним тиском кров починає розчиняти ... з повітря, що його вдихає водолаз (Микола Трублаїні). 9. ...воду крізь зябра, молюск забирає з неї ... (Анатолій Давидов). 10. З морської солі, до якої входить хлористий натрій, Сайрес Сміт легко добув ... і ... (Жуль Верн). 11. ...казанах плавили ... і ... для покрівель (Павло Загребельний). 12. Земля вдихне глибинно і жагучо на вишняках настояний ... (Ліна Костенко). 13. ... проспектів. Туга ліхтарів (Василь Стус). 14. ...листя в осокорів з одного боку матово-срібне, як ... (Олесь Донченко). 15. ... згорів і наш вогонь тьмяніє (Антуан де Сент-Екзюпері).
6 Зіграй у гру «Третій зайвий»: добери ознаку й визнач зайвий об’єкт. Скільки відповідей у кожного підпункту цього завдання? Чому? Склади подібне завдання з хімії











1. Упорядкуйте, згрупуйте, систематизуйте картки з інформацією про хімічні елементи (ті, які підготували до уроку, або зображені в додатку 1 до блоку 11). З’ясовувати достеменно, що саме відображає модель у лівому нижньому квадранті картки наразі не обов’язково, проте порівняти ці моделі на картках різних хімічних елементів доцільно.
Порада: спочатку спробуйте розташувати картки в рядок за збільшенням / посиленням певної властивості / кількісної характеристики. Чи виникла проблема під час упорядкування? Порівняйте дібраний вами спосіб упорядкування із запропонованим у завданні, яке подано за QR-кодом.
Після цього спробуйте згрупувати картки (об’єднайте в кластери за певною ознакою / сукупністю ознак хімічних елементів і/або речовин, які вони утворюють). Чи вдалими були спроби?
Всебічно проаналізуйте інформацію на картках і відшукайте ту, що об’єднує хімічні елементи, але водночас дає змогу побачити різницю між ними. Поясніть, яка інформація про хімічні елементи, наведена на картках, дала змогу чітко й однозначно систематизувати їх, а










Оцінка
Чи вдалося впорядкувати й
Чи вдалося виявити істотну ознаку й систематизувати хімічні
елементи?
Чи була ефективною ваша
стратегія досягнення мети?
На якому рівні було організовано
співпрацю в групі?
ОПРАЦЮЙ ІНФОРМАЦІЮ, ПОЯСНИ ЗАКОНОМІРНОСТІ
У давнину грецькі філософи Емпедокл й Аристотель уважали, що всі речовини складаються із чотирьох первнів-стихій: землі, води, повітря і вогню. Це були радше філософські, а не наукові уявлення, але вони стали основою для майбутніх досліджень у цій галузі.
У період панування алхімії науковці, шукаючи філософський
мінь й еліксир безсмертя, відкрили чимало нових речовин. Проте єдиного підходу до систематизації
на той час так і не виробили. У XVII—XVIII століттях дослідники
кувати речовини. Поняття хімічного
ський хімік і
1661 року. Роберт Бойль піддав сумніву класичні уявлення про чотири стихії, що панували з античних часів. Він підтримував погляд на елементи як неподільні складники матеріальних тіл й обґрунтував різницю між сумішами й сполуками. Водночас припускав, що елементи в кінцевому підсумку складаються із частинок різного роду й розміру, на які вони, однак, не можуть бути розділені жодним відомим






























Reaction of Sodium and Water, Reaction of Potassium and Water відео й переглянь їх.
Природна родина благородних елементів — Гелій, Неон, Аргон, Криптон, Ксенон і Радон. Відповідні прості речовини — благородні гази — вирізняються тим, що мають дуже низьку реакційну здатність. Дізнайся більше про них із додаткових джерел інформації. Та всі згадані спроби класифікації хімічних елементів були недосконалими, бо не мали єдиної основи. Тож науковий пошук тривав...
Першу спробу класифікації хімічних елементів за атомними масами здійснив 1829 року німецький хімік Йоганн Вольфганг Деберейнер. Під час вивчення властивостей брому виявив, що він посідає проміжне місце між хлором і йодом. Зокрема з’ясував, що в ряду простих речовин хлор — бром — йод поступово змінюється колір й зменшується реакційна здатність. І поступово збільшується маса атомів відповідних хімічних елементів. Пізніше Деберейнер помітив цікаву закономірність для деяких груп елементів (мал. 11.4). Якщо розташувати за збільшенням атомних мас три хімічно подібні елементи, то атомна маса середнього члена трійки приблизно дорівнює полови-
ні суми атомних мас її крайніх членів. Проте намагання науковця відшукати інші подібні групи з трьох хімічних елементів виявили-
ся марними. Про інші спроби класифікації хімічних елементів (гвинтовий графік Шанкуртуа й октави Ньюлендса, таблиці Лотара Маєра й Дмитра Менделєєва) зможеш дізнатися більше з додаткових джерел інформації. Зокрема пересвідчишся, що врешті-решт 1864 року Лотар Маєр скласифікував 28 хімічних елементів, розташувавши їх у таблиці. А Дмитро Менделєєв 1869 року
ментів,










ву і Маєру.
всі хімічні елементи розташовані в сучасній періодичній таблиці за збільшенням атомних мас? У тебе була нагода пересвідчитися, що ні. Причину цього науковці зрозуміли лише тоді, коли дослідили будову атома. Зокрема 1911 року голландський фізик А. Ван ден Брук припустив, що атомний номер елемента збігається з величиною позитивного заряду ядра атома. Цю гіпотезу 1920 року експериментально підтвердив англійський фізик Дж. Чедвік. Так розкрили фізичний зміст порядкового номера елемента в періодичній таблиці й запропонували сучасне формулювання періодичного закону. Заповни пропуски в цьому формулюванні: Властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у … залежності від величин зарядів … атомів.
Тобто відкриття складної будови атома дало змогу виявити, що фундаментальною характеристикою кожного елемента є величина заряду ядра атома, а не атомна маса. До речі, а чому атомні маси, на відміну від зарядів ядер атомів, не цілі числа?
Зазирнімо всередину атома. Ти вже знаєш, що атом є електронейтральною системою (поясни чому). Він складається з позитивно зарядженого ядра, що практично визначає його масу (понад 99,9 %), й електронів навколо ядра. Розмір електронної оболонки визначає розміри атома. Позитивний заряд ядра зумовлений протонами в ньому. Окрім протонів
Протонне число Z в атомах хімічного елемента завжди










Проаналізувавши схему (мал. 11.5), заповни
Через різну кількості нейтронів ізотопи хімічного елемента різняться нуклонними (масовими) числами A. Нуклонне число дорівнює кількості нуклонів (протонів і нейтронів у ядрі атома): A(Е) = N(Е) + Z(Е),
де А(Е) — масове (нуклонне) число атома хімічного елемента Е, N(Е) і Z(Е) — його нуклонне і протонне числа відповідно (мал. 11.6).


● Поміркуй, що означає число 12 у запису Карбон-12.
● Поясни, чому масове (нуклонне) число
те саме. Мал. 11.6. Нуклідний
Проаналізувавши схему (мал. 11.6), заповни пропуски у визначенні.
Нуклідний символ — символ нукліда елемента, біля якого зазначено масове число як передній надрядковий (верхній)
індекс й атомний номер як … підрядковий (…) індекс.










А(В) = 10 ∙ 20 + 11 ∙ 80 20 + 80 ;
А(В) = 10 ∙ 20 + 11 ∙ 80 100 ; А(В) = 10,8.
● Поміркуй, за якої умови середнє арифметичне зважене дорівнюватиме середньому арифметичному. Ядра атомів деяких хімічних елементів нестабільні й можуть розпадатися, вивільняючи частинки або електромагнітні хвилі. Цей процес може тривати від часток секунди до мільйонів років залежно від нукліда. У довкіллі трапляються здебільшого стабільні ізотопи хімічних елементів, оскільки нестабільні врешті-решт розпадаються. Радіоактивний розпад відіграє важливу роль у природних процесах, його використовують у ядерній енергетиці, медицині й інших галузях. Дізнайся більше про використання і небезпеку радіоактивних ізотопів з додаткових





















Я потер гребінець об волосся, і думаю, що він набув позитивного заряду, тому що частина протонів із












14
сьомого листопада, у день народження … в багатьох країнах, зокрема й в Україні, відзначають день захисту від …. Густина цього газу приблизно в 7,5 раза … за густину повітря. Він потрапляє в будівлі, просочуючись із ґрунтів.
розчиненим у воді, наприклад, артезіанській,
16 Склади кросворд із прізвищ науковців































Підготуйся в групі з трьох осіб до уроку: розподіліть між собою картки (мал. 12.1) з інформацією про хімічні елементи, відповідні прості і складні речовини. Відгадайте назви хімічних елементів, скориставшись, якщо треба, додатковими джерелами інформації. Перевірте відповідь за QR-кодом. Поясніть, що об’єднує ці хімічні елементи. Зазначте їхні назви, хіміч-









































































проаналізували.
● Що мало б бути
свою думку.
● Опишіть закономірності в розташуванні карток, дібравши потрібні слова: рядок, стовпець; кількість, якість; колір, форма, розмір; суттєва, несуттєва; послідовно, стрибкоподібно, однакова, різна; зменшується, збільшується, змінюється, не змінюється.
● Поміркуйте, що нагадує вам система карток (мал. 12.2), назвіть виявлені аналогії та відмінності.
● Оцініть процес і результат співпраці, свій поступ за самостійно дібраними критеріями.
періодичного закону. Нині в
118 хімічних елементів.
лиці є періоди і групи хімічних елементів. Періодом називають фрагмент природного ряду хімічних елементів, у якому вони розташовані
зростанням протонних (атомних) чисел. Кожен період починається лужним і завершується благородним (інертним) елементом.
Перший період містить лише два елементи: Гідроген (H) і Гелій (He). Відповідні прості речовини водень (Н2) і гелій (Не) за звичайних умов є газами. Натомість шостий і сьомий періоди такі довгі, що багато їхніх елементів для зручності розміщено під основною частиною таблиці. Групами
однієї групи мають подібні властивості. Наприклад, усі металічні елементи першої групи утворюють прості речовини — хімічно дуже активні метали. Натомість
Місце в періодичній














тебе вже була нагода пересвідчитися, що місце
блиці, подібність і відмінність властивостей хімічних елементів зумовлено будовою атомів (додаток 1). Зокрема складом електронної оболонки — кількістю і відстанню від ядра електронів у ній. Перевір відповідність моделей на малюнках поданим твердженням. Електрони в атомі розташовані навколо ядра в областях, які називають енергетичними рівнями
як перетин 2










з номером періоду (рядка в періодичній таблиці).
Розуміння того, як електрони заповнюють енергетичні рівні, дає змогу збагнути, чому саме стільки
тичного рівня
внішнього енергетичного рівня. Що більше енергетичних рівнів
зі
збільшенням протонного числа
збільшується кількість










електрон?


Так, атоми можуть утрачати й приєднувати електрони. Цей процес називають йонізацією (мал. 12.7).
Приєднання електронів: коли атом приймає додаткові електрони, він стає негативно зарядженим йоном (аніоном). Наприклад, атом хлору (Cl) легко приєднує електрон і перетворюється на аніон Хлору (Cl–).
Втрачання електронів: коли атом
віддає один або кілька електронів, він стає позитивно зарядженим йоном (катіоном). Наприклад, атом
натрію (Na) легко віддає один електрон, перетворюючись на катіон Натрію (Na+).
найближчого в періодичній таблиці інертного елемента (мал. 12.8).
18 1 2 13 15 16 17 He










Відповідно радіус аніона, на який перетворюється
(мал. 12.9, б). Неметали переважно










шенням радіуса атомів у періодах.
збільшенням заряду ядер і розмірів атома електронегативність зменшується. У цьому ти пересвідчишся, проаналізувавши графіки на малюнку










Reactivity of Alkali Metals with Water; Halogen reactions with iron wool; Comparing the four halogens

























5
Б благородним В металічним










виділено клітинки хімічних
елементів з однаковим значенням енергії йонізації.
) F0 + e– → F–; в) Ca0 – e– → Ca2+; г) Al0 – e– → Al3+; д) N + 3e– → N –; е) Rb0 – e– → Rb . І. Однаковим кольором
Однаковим кольором
виділено клітинки хімічних
елементів, які стали відомі людству в певний історичний проміжок часу.
мів. А Натрій Б Калій В Оксиген Г Флуор 14 Вибери формулу
а) O0 + e– → O2–;





















QR-кодом.





































23
стислу інформацію


























кооперативно

Підготуйся
•
•





• розробіть план характеристики
елементи, зазначивши, зокрема,
стих речовин;
• запропонуйте й узгодьте
(матеріали, відносні розміри тощо) моделей, у яких рухомими деталями є електрони зовнішнього енергетичного рівня атомів;
• долучіться
Як вам завдання
з моделювання? Це ж
матеріал попередньої теми.
І чому моделі динамічні?



Підозрюю, що не такі вже й доступні… Раджу поміркувати й підрахувати.
Пропоную не марнувати часу. Бачила в інтернет-магазині готові: магнітна основа, рухомі деталі, доступні ціни...
Поки ви міркуєте й рахуєте, я вже маю ідею: хитро, мудро й недорогим коштом. Обговорімо?

Ne — 1, H — 8, N — 3, O — 3, F — 3.





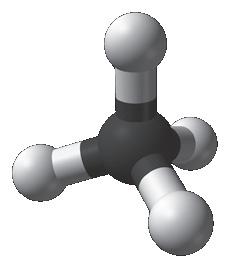
2. Змоделюйте молекули водню (Н2), фтору (F2), кисню (O2), азоту (N2). Візьміть до уваги принципи взаємодії одно- і різнойменних зарядів. Унаочніть цей принцип, скориставшись маленькими
тами.
Дайте відповіді на запитання.
● Скільки спільних пар електронів
Нітрогену?
● Став завершеним чи залишився незавершеним
атомів
водню, фтору, кисню, азоту?
● На однаковій чи різній відстані
електронні пари в молекулах, які ви змоделювали? Чому?
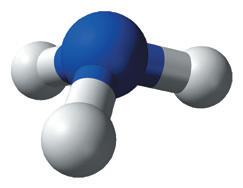
3. Змоделюйте молекули гідроген фториду (HF), води (H2O), амоніаку (NH3), узявши до уваги принципи взаємодії одно- і різнойменних зарядів і відносну електронегативність атомів.
Дайте відповіді на запитання.
● Чи став завершеним зовнішній енергетичний рівень атомів у молекулі?
● На однаковій чи різній відстані від ядер атомів перебувають спільні електронні пари в молекулах, які ви змоделювали? Чому?
● Як уважаєте, що більше: сума енергій
тримаються купи внаслідок електростатичних взаємодій між різнойменно
нами й електронами. Електростатичне притягання між протилежно





утворення
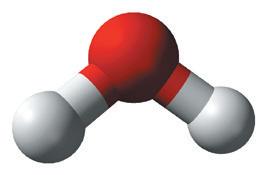
двох атомів була нижчою за енергію окремих атомів. Розгляньмо це на прикладі утворення хімічного зв’язку в молекулі водню (мал. 13.3). Спочатку два атоми Гідрогену перебувають на великій відстані й не
впливають один на одного. Під час їхнього зближення починають діяти сили відштовхування






потужне відштовхування між однойменно зарядженими ядрами атомів і загальна енергія системи почне стрімко зростати. Це енергетично невигідно системі, тому відстань
водню
хімічного зв’язку становить 0,000 000 000 74 м, або 0,74
Зв’язок між атомами, які усуспільнили одну чи кілька пар електронів і
Ковалентний зв’язок зображують за допомогою електронних і графічних формул молекул. Електрони позначають крапками або хрестиками поруч із символами елементів. Одна крапка (хрестик) символізує один електрон (мал. 13.5). Якщо двоатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.





рівня. Гідроген одновалентний. У більшості речовин
бон — чотиривалентний. Кiлькiсною мiрою валентностi атома є кількість атомiв іншого елемента з відомою валентністю, які він здатний приєднати. Валентність зазначають римськими цифрами над символами хімічних елементів (мал. 13.7). Мал. 13.6.








3

/ внутрішнього, стійку / нестійку, трьох / вісьмох





8
А трьома електронами
Б чотирма електронами
В сімома електронами
Г вісьмома електронами
придумайте гасло для створеної моделі. Апробуйте руханку







Психолог: Ну, Неоне, є щось, що тебе бентежить?
Неон: Ні, усе гаразд, дякую! Адже маю вісім електронів на …
енергетичному рівні.
Психолог: Чудово, Неоне. Ти один із благородних елементів, у яких … енергетичний рівень …, тому тобі не треба утворювати
зв’язки з іншими ….
Неон: Так, я цілком самодостатній!
Психологиня: Отже, Гідрогене, що тебе непокоїть?
Гідроген: Маю лише … електрон і почуваюся невпевнено, а мені хочеться стабільності, як у ….
Психологиня: Тобі потрібен ще електрон, щоб заповнити …
енергетичний рівень. Може, знайдеш інший атом, з яким усуспільниш електрони?
Гідроген: Це привабливо! Спробую утворити ковалентний … зв’язок з іншим атомом






Підготуйся
3, 7–9, 11–13, 15–17, 19, 20, 35, 53; • скористайтеся малюнком 12.8, якщо треба, й, узгодивши матеріали та відносні розміри, виготовте
йонів (по 10 однакових для кожного елемента) за зразками на малюнку
14.1.
3, 7–9, 11–13, 15–17, 19, 20, 35, 53.
2.
3.
4.










кох електронів. Якщо атом приєднує електрони, то перетворюється на негативний йон — аніон. Унаслідок цього енергія виділяється. Натомість катіон — позитивний йон — утворюється внаслідок втрачання електронейтральною частинкою електронів. Під час цього процесу енергія поглинається. Протилежно заряджені йони притягуються, між ними виникає хімічний зв’язок.
Йонний зв’язок — це зв’язок між катіонами та аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика, спільні електронні пари майже повністю зміщуються до атома електронегативнішого елемента. За цих умов атоми перетворюються на йони. Між катіонами та аніонами діють електростатичні сили притягання, які, наприклад, утримують натрій-катіони Na+ й хлорид-аніони Cl– у кристалі натрій хлориду (мал. 14.2).




Зверни увагу: у кристалі галіту натрій-катіон з усіх боків оточений хлорид-аніонами і навпаки. Енергетично найвигідніше, коли навколо кожного йона кількість йонів із протилежним
зарядом найбільша. Однак через відштовхування однойменних йонів один від одного система набуває стійкості лише за певного розташування катіонів





ковалентним полярним. Якщо різниця значень електронегативності понад 2,0, то зв’язок уважають йонним. Ступінь окиснення. Ступінь окиснення елемента — це чисельна величина електричного заряду, який приписують атому в молекулі, припустивши, що електронні пари, які забезпечують зв’язок, повністю зміщені в бік електронегативніших атомів. Проаналізуй дані таблиці 14.1 й дізнайся більше
елементів.
Ступені окиснення позначають
окиснення може мати не лише додатне чи від’ємне значення. У простих речовинах ступінь окиснення
атомів дорівнює нулю
Ступінь окиснення Гідрогену в сполуках
з неметалічними елементами зазвичай
дорівнює +1, а з металічними — –1
Флуор в усіх сполуках з іншими
елементами має ступінь окиснення –1
Оксиген має ступінь окиснення –2 в усіх сполуках з іншими елементами, окрім Флуору й тих, де атоми Оксигену
сполучені між собою
Сума ступенів
14.1. Ступені окиснення





дій
Напиши хімічну формулу сполуки N2O5 H2SO4
Визнач ступені окиснення елементів за стандартними правилами: Гідроген (H) у більшості
сполук має ступінь окиснення +1; Оксиген (O) зазвичай має ступінь
окиснення –2 (крім пероксидів, де він має ступінь окиснення –1).
Ступінь окиснення лужних елементів завжди +1, а елементів
другої групи +2
Познач x невідомий ступінь
окиснення елемента
Склади рівняння для суми ступенів окиснення всіх елементів у сполуці, узявши до уваги кількість атомів кожного елемента





у
проаналізувавши дані, наведені в таблиці 14.4.
Валентність — кількість хімічних зв’язків, утворених атомом.
Ступінь окиснення визначають, умовно вважаючи всі полярні зв’язки повністю йонними.
Таблиця 14.4. Визначення ступенів окиснення хімічних елементів за формулами речовин


Гідрогену й Хлору становлять +0,17 і –0,17 (а ступені окиснення
заряди на атомах Цинку й Сульфуру дорівнюють +0,86





4
б) ступінь окиснення Гідрогену –1; Н2S; СаН2; LiН; NН3; АlН3; НСl
в) ступені окиснення елементів дорівнюють 0; СО; Сl2; Mg; CO2; Lі
г) однаковий ступінь окиснення Флуору; ОF2; F2; MgF2; KF; SF6
д) Сульфур виявляє ступінь окиснення +4; SF4; SО2; Н2SO3; BaSO4
Визнач ступені окиснення хімічних елементів у речовинах, формули яких НClО; НClО3; NaOН; НСlО4; С2Н6; С2Н2
5 Склади формули оксидів Хрому (Cr), у яких він виявляє ступінь окиснення +2, +3, +4, +6.
6 Порівняй: а) ковалентний полярний і йонний зв’язки; б) ступінь окиснення і валентність. Результати порівняння подай як
7 Долучися в
блоку
(мал. 14.3) й склади подібний з іншими персонажами й сюжетом. Добери потрібні
й терміни з-поміж таких: Натрій, Хлор, Оксиген, Магній, Алюміній, Нітроген; катіон, аніон; 2, 3, 7, 8, 11, 13, 17; двох, трьох, чотирьох; ковалентний, йонний, водневий; різні, однакові; молекула, йонна сполука.
Театралізуйте один із діалогів для шкільного (а може й міжшкільного ) конкурсу
на містерія». О, чарівна

Мал. 14.3











Завдання

















1. Розподіліть роботу, проаналізуйте
досліджень і гіпотези ваших однолітків. Експериментуйте, щоб підтвердити чи спростувати їхні гіпотези. Скористайтеся термінами притягання, відштовхування; зілляються, віддаляться; більшу краплю, дві калюжки; опуклу, увігнуту й іншими доречними.
Мета дослідження: виявити ... між молекулами води.
Дослід 1. Краплі води на гладкій поверхні
Матеріали: скляна або пластикова поверхня, крапельниця, вода.
Послідовність дій
Піпеткою обережно помісти на гладеньку скляну пластинку
впритул одна до одної дві краплі води.
Очікуваний результат: краплі ..., щойно їхні краї торкнуться, утворивши .... Дослід 2. Монети в склянці з водою
Матеріали: склянка з водою, монети.
Послідовність дій
Наповни склянку водою майже по вінця. Обережно клади плазом
монети у воду одну за одною, спостерігаючи, як вода утворює ...
півсферу відносно краю посудини.
Очікуваний результат: з кожною новою монетою вода ..., аж
поки ....
Дослід 3. Цівка води й …
Матеріали: цівка води з крана, ..., вовняна тканина.
Послідовність дій Натри ... об вовняну тканину, щоб створити статичний заряд.
Піднеси заряджений предмет до цівки води, але не торкайся її. Очікуваний результат: цівка води .... 2. Обговоріть і поясніть результати дослідів, скориставшись заздалегідь підготовленими моделями молекул води, візьміть до уваги форму молекули й розподілення в ній електронної густини (мал. 15.1).





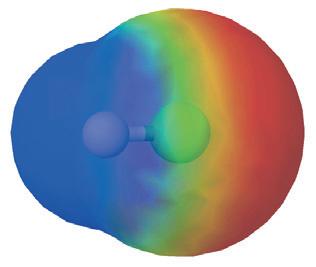





За допомогою простого досліду можна пересвідчитись у тому, що молекули води полярні: тонка водяна цівка притягується до пластмасових чи гумових виробів, наелектризованих тертям (мал. 15.3).
Під впливом диполів води на
поверхні речовин, занурених у

неї, міжатомні й міжмолекулярні сили слабшають приблизно у 80 разів. З усіх відомих речовин така висока діелектрична проникність властива лише воді. Цим пояснюють
















6 Долучися в групі до створення сценарію руханки,
опускання; б) походження відсортованих кам’яних
Норвегії. Світлину кілець знайди за пошуковим запитом Zeipelodden, Svalbard, Arctic; скористайся, якщо треба, додатковими джерелами інформації.
8 Долучися до діалогу.
Мій дідусь-агроном
промерзання на 30 см углиб, можна


відмовитися від основного обробітку землі. Таке промерзання ефективніше за оранку. Згодна, але моя сестрафермерка вважає, що це може зашкодити озимим посівам і дає позитивний ефект на полях, які нічим не засіяно.





Завдання

аморфних речовин.
Прочитайте тексти й поясніть, який, на вашу думку, містить достовірну, а який — антинаукову інформацію про кристали. Після обговорення скористайтеся запитаннями, поданими за QR-кодом. Чи так само ви міркували?
Кристали мають упорядковану атомну або молекулярну структуру, що





Кристалічному стану речовини властиве впорядковане розташування структурних одиниць (атомів, молекул, йонів) у всьому кристалічному тілі незалежно від відстані між частинками. Структурні частинки кристалічних тіл утворюють у просторі правильні кристалічні просторові ґратки. Поверхня кристала обмежена площинами — гранями, лінії перетину яких є ребрами, а точки перетину ребер — вершинами. Кристали можуть мати різну форму (мал. 16.1).
В аморфних (безформних) тіл, на відміну від кристалічних, немає чіткого порядку в розташуванні атомів і молекул. Лише найближчі атоми розташовуються в деякому порядку. Але строгої повторюваності в усіх напрямках того самого елемента структури, яка характерна для кристалів, в аморфних тілах немає (мал. 16.2). Та сама речовина може перебувати й у кристалічному, і в аморфному стані. Якщо розплавлений цукор охолоджувати повільно, утворюються кристалики. Якщо розплав охолоджувати дуже швидко — склоподібна маса — льодяник. Через кілька місяців поверхня льодяника вкриється пухкою







нів. Алмаз не
стійка форма існування Карбону, за нагрівання без доступу повітря вище від температури 1200 °С вона переходить у графіт. Кристалічна структура графіту зовсім не схожа на структуру алмазу. Атоми Карбону в графіті розташовані
від алмазу, графіт
ли. Відмінність






температура плавлення кварцу 1725 °С. Такі речовини майже нерозчинні в будь-яких розчинниках, мають низьку реакційну здатність. Молекулярні кристалічні ґратки побудовані з молекул речовини. Зазвичай у таких речовин низькі температури плавлення і кипіння, адже молекули слабко зв’язані між собою. Молекулярні ґратки мають у твердому стані водень (Н2), азот (N2), кисень (O2), галогени (F2, Cl2, Br2, I2), чимало органічних речовин. На малюнку 16.6 зображено кристалічні ґратки йоду, у вузлах яких містяться молекули І2. Атоми йоду в молекулі сполучені досить міцними ковалентними зв’язками, а між молекулами діють слабкі сили притягання. Тому вже за незначного нагрівання йод, не плавлячись, переходить із кристалічного стану в газуватий (сублімується), а за охолодження пара йоду кристалізується.
Відшукай в інтернеті за ключовою
The Iodine Myth відео й переглянь його.
твердому карбон діоксиді CO2) зазвичай утворюють кристали
носно низькою міцністю через слабкі міжмолекулярні сили притягання. Тому сухий лід сублімується за звичайної температури (мал. 16.7, а). Молекули складнішої будови, наприклад ваніліну (мал. 16.7, б), можуть утворювати кристали, у яких міжмолекулярні взаємодії сильніші. Однак притягання між молекулами не таке сильне, щоб запобігти дифузії. Коли молекули ваніліну відокремлюються від кристалів і зі струменем повітря потрапляють у носову порожнину, ти відчуваєш пахощі, визнані найприємнішими у світі.












(801
натрій хлорид, 2627 °С — кальцій оксид тощо). Зазвичай
кристали тверді, але крихкі. Їхню крихкість зумовлено тим, що навіть за невеликої деформації кристала катіони й
зсуваються так, що сили відштовхування між однойменними йонами починають переважати над силами притягання
1. Скористайтеся підручними матеріалами й змоделюйте
кристалічної й аморфної речовин, порівняйте їх.
2. Порівняйте за малюнком 16.9 2D-моделі кварцу й кварцового скла. Однаковий чи різний хімічний склад і будову мають кварц і кварцове скло? Поясніть відмінність фізичних властивостей кварцу й кварцового скла. Скористайтеся, якщо треба, додатковими джерелами інформації.
Мал. 16.9. Кварц А VS кварцове скло





ДОСЛІДЖУЙ у групі
Неухильно дотримуйтеся правил безпеки під час роботи в кабінеті хімії!
Завдання. Вам видано кухонну сіль, графіт, кварцовий пісок, шматочки льоду, цукор, ванілін, ментол. Сформулюйте гіпотезу щодо типу кристалічних ґраток цих речовин. Шукайте докази на підтвердження гіпотези: розгляньте речовини, скориставшись, якщо треба, збільшувальними приладами; з’ясуйте, чи однакової форми їхні кристали, чи легко їх подрібнити, наскільки вони легко- або тугоплавкі, термостійкі, чи мають запах. Перевірте, які з речовин розчинні у воді, які — ні, чи електропровідні речовини й розчини, що утворилися.
Чи вдалося вам правильно визначити тип кристалічних ґраток, ґрунтуючись на фізичних властивостях досліджуваних речовин? Перевірте свої висновки за додатковими джерелами інформації.
1 Склади й заповни аркуш самоконтролю
і застосування: а) камфора (компонент мазей, крапель та інших лікарських форм) — безбарвні леткі кристали з характерним запахом;
б) бор нітрид BN (боразон) за твердістю наближається до алмазу, водночас стійкіший до високих температур, використовують для виготовлення надтвердих абразивних матеріалів;
в) речовина Х розчиняється у воді, тверда, але крихка, має високу температуру плавлення, розплав і розчин проводять електричний струм, харчова добавка Е509.
3 Доповніть друге речення так, щоб воно стало правильним твердженням: «Білий фосфор (Р4) — безбарвна воскувата речовина,





в наш край (Овідій). Хіба не здавалося, що алмаз, ця сльоза кристалізованого чистого вуглецю — субстанція первісна й неподільна? (Оноре де Бальзак). …кварц і аметист, малахіт і берил загадково прозирали крізь скляний саркофаг… (Павло Загребельний). Повсюди були розіслані гінці, щоб сіль принесли (Божена Немцова). Мов тихий дзвін гірського кришталю, несказане лишилось несказанним (Ліна Костенко).
6 Підготуй цікаві повідомлення для учнів й учениць
а) будову молекули















1. Доберіть приладдя і засоби індивідуального захисту
дослідження і порівняння розчинності, електропровідності, крихкості, пластичності натрій хлориду (NaCl), сахарози (С12Н22О11), кварцу (SiO2) й алюмінію (Al), цинку (Zn), міді (Cu), заліза (Fe). Сформулюйте гіпотезу й шукайте докази на підтвердження її. Проаналізуйте результати експериментів і поясніть загальні властивості металів, скориставшись моделями.
2. Порівняйте властивості металів і сплавів, скориставшись на-


ни. Унаслідок їхньої втрати утворюється стійка електронна конфігурація атома Криптону.
Що менше електронів на зовнішньому енергетичному
більший радіус атома, то легше атом металічного елемента перетворюється на катіон.
Які частинки в кристалічних ґратках металів? Метал складається з атомів, катіонів і вільних електронів. Розгляньмо, наприклад, будову натрію. Валентні електрони в металі безладно рухаються, однаково часто переходять від атомів до катіонів і навпаки (мал. 17.1). Унаслідок цього
які унаслідок цього перетворюються на катіони. Тобто електрони, рухаючись між катіонами металів, можуть





металевий предмет, треба подолати ці сили тяжіння. Що сильніше притягання, то міцніший металічний зв’язок і важче зруйнувати метал. Більший заряд катіона (і, відповідно, більша кількість делокалізованих електронів) зумовлює сильніше притягання і міцніший металічний зв’язок.
Що менші йони металічного елемента, то сили притягання сильніші, бо менша відстань між позитивним зарядом (ядро катіона) і негативним зарядом (делокалізовані електрони). Наприклад (мал. 17.6), радіус катіонів Натрію (Na+) більший, а заряд менший, ніж у катіонів Алюмінію (Al3+). Тому в зразку натрію притягання між катіонами металу й делокалізованими електронами слабше, ніж
спільні. Завдяки цьому шари атомів / катіонів можуть ковзати один над одним. Тому більшість металів пластичні — їх можна скручувати, витягувати або пресувати без розтріскування чи розривання (мал. 17.7).


хімічних елементів, тип реакцій. Атоми металічних елементів у цих реакціях втрачають чи приєднують електрони? А неметалічних? Видобування металів з оксидних і сульфідних руд ґрунтується на перетворенні катіонів

Сульфідні руди зазвичай випалюють, унаслідок чого утворюються оксиди: ZnS + O2 → ZnO + SO2↑.
метал: ZnO + C → Zn + CO.
● Перетвори схеми реакцій на хімічні рівняння,
ступені
хімічних елементів. Дізнайся визначення реакції заміщення і поясни, чи є така реакція поміж описаних вище перетворень.
Сплави утворюються внаслідок стоплення кількох
металів із неметалами. Як і метали, усі сплави у твердому стані зазвичай мають упорядковану кристалічну будову.
Атоми і катіони різних металічних елементів мають різні розміри. Це порушує однорідність металічних
кристалічних ґраток і запобігає легкому
ковзанню шарів катіонів (мал. 17.8).
Тому сплави зазвичай твердіші й міцніші за чисті метали. Наприклад, сталь — це сплав заліза з вуглецем, який
набагато міцніший за саме залізо.
Використання металів і сплавів









1
2
5
6
+
= 2Fe2O3 ∙ xH2O; 2Cu + H2O + CO2 + O2 = Cu(OH)2 + CuCO3.
швидкість іржавіння заліза.
7 Склади таблицю, у якій порівняй за різними ознаками іржу
8
Поясни:
а) суть відновлення металів із руд;
б) переваги й недоліки використання водню як відновника металів;
в) чи можливе окиснення без відновлення








розвитку.
що
твої досягнення у вивченні
цьогоріч. Перше крило — уміння досліджувати природу, друге — опрацьовувати інформацію
ти закони й закономірності природи
відображати

відним умінням.


силою».
які хочуть підвищити свій рівень
Презентуй свого супергероя чи супергеройку: поділися малюнком із класом і розкажи, чому
тобто є справжньою «суперсилою» .


Продемонструй володіння «суперсилою» : пройди експресвипробування на «хімічному поліграфі».
Після презентування однокласниками й однокласницями всіх «суперсил» поміркуй і визнач, яку з них тобі ще треба розвивати, а якими знаннями і вміннями
поділитися з іншими.

НЕННЯ, як-от: я стала експерткою / став експертом





6,94










39,95 Неметал

16,00


14,01

28,09

30,97
39,10

19,00


32,06


А
Авогадро стала 32, 33
Авогадро число 38, 45
Предметний
Азот 13, 16, 44, 47, 49, 84, 112, 135
Алмаз 36, 134, 137, 138, 149
Алюміній 42, 105, 120, 125, 139, 140, 142
Амоніак 57, 115
Аморфне тіло 133
Аніон 100, 101, 120, 121, 125, 136
Аргентум(+1) бромід 87
Аргон 88, 100
Атмосфера 50, 55
Атом 4, 7, 8, 15, 16, 19, 26, 27, 28, 30, 31, 37, 38, 40, 43, 45, 47, 53, 62, 68, 69, 88–95, 98–103, 105, 107, 118, 121–124, 129, 133–135, 137, 139, 141, 143–145, 150, 151
Б
Багор 64
Бакмінстерфулерен 138
Бар’єр енергетичний 61, 64, 73, 74
Бензин 59, 62, 64, 65, 78
Берил 138, 148
Бор 90, 134
Бром 82, 88, 116
В
Валентність 110, 115, 116, 124
Валентність змінна 116
Валентність стала 115
Валеріана лікарська 6, 8
Ванілін 36, 135, 137
Вапно 24, 69
Вапняк 69, 76
Вибухонебезпечність 51
Викид нейтральний 56
Відновлення 144, 145
Вода 13–16, 18–21, 23–27, 32, 33, 36, 37, 41, 45, 59, 61, 64, 68, 72, 76, 78, 84, 86, 87, 93, 94, 112, 115, 127–131, 135, 137, 145
Водень 14–17, 25–27, 31, 44, 51, 52, 54–57, 67, 72, 112–114, 116, 143, 145
Воднево-киснева суміш 14
Г
Газ 3, 12–17, 39, 40, 42–61, 68–71, 83–88, 94, 97, 132, 141, 144, 149, 150
Газ благородний 88
Газ вуглекислий 13, 15–19, 24, 31, 32, 44, 46, 49, 51, 54, 55, 61, 68, 69, 72, 76, 87, 129
Газ електронний 141
Газ ідеальний 39, 42
Газ сірчистий 55, 68
Газ чадний 30, 57, 58, 68, 72, 144
Газу густина 39, 41, 42, 48, 50, 53, 54–57
Газу густина відносна 48, 50, 52–54, 58
Газу чадного детектор 58
Галоген 86, 87, 91, 105, 109, 135
Галогенід 87
Гас 62, 64
Гелій 49, 52, 84, 88, 97
Германій 134
Гідроген бромід 87, 116
Гідроген галогенід 87
Гідроген йодид 87, 116
Гідроген пероксид 27, 68, 69, 73
Гідроген сульфід 69, 70, 116
Гідроген фторид 87, 112, 115, 129
Гідроген хлорид 87, 124
Гіпотеза 13, 20, 22, 49, 64, 89, 93, 128, 137, 139
Гниття 62
Горіння 18–24, 27, 52, 55, 59–68, 71, 76, 77, 151
Горіння трикутник 62, 63
Графіт 31, 32, 134, 137, 149
Група 97, 99, 101–103, 105,109, 120, 122, 123
Групування 80–83
132–135, 137–138
134, 138
Ґратки кристалічні
135, 138
Д
Дизайн 19–22, 47, 59, 64, 70, 73, 84, 85, 95, 109, 111, 119, 127
Дилогія 72
Диполь 129
Диптих 72
Дистиляція 6, 7
Діамант 134
Дослідження 6, 9, 10, 17, 20, 22, 45, 48, 52, 59, 64, 70, 73, 77, 82, 83, 128, 132
Е
Екосистема 130
Електроліз 13, 14, 67
Електролізер 13
Електрон 8, 89, 90, 92, 93, 98–102, 104, 105, 109–112, 114–118, 121, 122, 125, 126, 137, 139–145
Електронегативність 102, 106, 112, 121, 122, 128
Електрони делокалізовані 140–142
Елемент благородний 85, 88, 116, 118
Елемент інертний 88
Елемент лужний 85, 87, 97, 105, 109, 123
Елемент металічний 86, 97, 98, 101, 104, 121, 122, 139, 143, 144
Елемент неметалічний 69, 98, 104, 105, 114, 116, 120–122, 143
Елемент перехідний 98, 104
Елементи солеродні 85
Енергії мінімуму принцип 113
Енергія активації 61, 62, 64, 70, 73, 74
Енергія звукова 15, 31
Енергія йонізації 102, 103
Енергія механічна 15, 31
Енергія світлова 15, 18, 21, 30, 62, 69, 76, 77, 81
Енергія теплова 15, 18, 19, 61, 62, 66, 68, 76
Енергія хімічна 18, 21
Ефект енергетичний реакції 70, 73, 75
Ефект тепловий реакції 62
З
Займання 19, 60–62
Закон Авогадро 40, 47
Закон збереження енергії 15, 18, 19, 23
Закон збереження маси 15, 18, 19, 21–23, 29, 69, 70
Закон періодичний 88, 89, 91, 95, 97
Зв’язку хімічного довжина 112, 114
Зв’язок водневий 125, 127, 129, 130, 131
Зв’язок йонний 121, 122, 124–126, 138
Зв’язок ковалентний неполярний 114, 117, 118, 122, 134
Зв’язок ковалентний полярний 115, 117, 118, 121, 122, 124, 125, 128, 129
Зв’язок металічний 140–143
Зв’язок хімічний 111, 113, 114
Змінна залежна 6, 36, 148
Змінна контрольована 36
Змінна незалежна 6, 36, 138
Золото 75
Зонд метеорологічний 48, 50, 51, 54, 55, 57
І
Ізотопи 90, 91
Індекс 25, 27, 90, 115, 120
Інкубатор 63, 64
Іржа, ржа 145
Іржавіння, ржавіння 62, 63, 145
Й
Йод 82, 86, 88, 116, 135
Йододефіцит 87
Йон 38, 100, 101, 111, 119, 121, 136, 137, 139, 142, 145
Йонізація 100, 102, 103, 106
К
Камінь дорогоцінний 134
Камінь філософський 6, 86
Капсула воднева 56
Карбон діоксид 72, 135
Карбон моноксид 72
Каталізатор 74, 75, 77
Катіон 100, 105, 106, 120, 121, 125, 136, 140–144
Кварц 34, 42, 135, 136, 138, 139, 151
Кисень 13–15, 27, 46, 49, 60, 62, 84, 135
Кількість речовини 31–33, 36–38, 44, 46
Кластеризація 80, 85
Ковкість 143
Коефіцієнт 25–29, 50
Корал 76
Космос 19, 56
Кратне найменше спільне 27
Крейда 24, 76, 87
Криголам 5, 54
Криптон 88, 140
Кристал 19, 36, 121, 132–137, 151
Кришталь гірський 132, 138
Ксенон 88
Купорос мідний 19
Купруму оксид 69
Курка смітна 63, 64
Л
Лід 9, 41, 49, 130, 135, 137
Лід сухий 49, 135
Лікоподій 62
Лоза срібляста 9
М
М’ята котяча 6, 7, 10, 11
Магній 24, 69, 120, 125, 140, 142–144
Магній оксид 24, 69, 143
Макрорівень 30, 31
Малахіт 24, 69, 70, 138
Маса відносна молекулярна 8, 11, 32, 53, 54, 56
Маса молярна 30–33, 38, 50, 54, 56
Маса формульна 11, 32, 54
Метал 22, 86, 87, 97, 98, 102, 139–147, 149–151
Металоїд 97
Метан 27, 49, 51, 52, 55, 56, 67, 68, 71, 115
Мідь 42, 45, 139, 143, 145
Міжнародна космічна станція (МКС) 19
Мікрорівень 25, 31
Модель 7, 8, 25, 26, 30, 32, 33, 37, 39, 43, 47, 63, 67–71, 74, 85, 87, 93, 94, 98, 100, 105, 111, 115–117, 119, 124, 125, 128, 131, 133, 134, 139
Модель 2D 98,136,139
Модель атома 98, 105, 111
Модель знакова 25, 26, 30
Модель йона 119
Модель матеріальна 25, 26
Модель молекули 7, 8, 26, 31, 67, 71, 87, 115, 116, 127, 128
Моделювання 14, 15, 25, 31, 67, 74, 111
Моль 30–41
Молярний об’єм 39–50
Монополія 72
Монорейка 72
Н
Назва систематична 116, 117
Нафта 63, 64
Нафтопродукти 64
Неметал 86, 97, 101, 102, 104, 143, 149–152
Неон 88, 97, 100, 111, 118, 140
Непеталактол 9
Непеталактон 6–8
Нітроген 8, 28, 105, 111, 112, 115, 116, 125
Номер атомний 89, 90
Нуклід 89–92, 94
О
Оболонка електронна 89, 93, 98, 99, 107, 110, 111
Одиниця формульна 119, 120
Озон 84
Окиснення 66, 145
Окиснення повільне 59, 62, 63, 65
Окиснення ступінь 119, 122–125, 143, 144
Оксиген фторид 68
Оксид 24, 66–72, 116, 117, 120, 125, 135, 136, 143, 144
П
П’єзокристал 132
Парафін 18–20, 65, 68
Патина 145
Період 97, 99, 100–102, 105, 109
Періодичність 88, 97
Пероксид 27, 68, 69, 73, 123
Персульфід 69, 89
Печера карстова 76
Пірит 69, 70
Пірометр 60
Пластичність 143
Платина 75
Притягання електростатичне 112
Продукт реакції 18–27, 30, 31, 40, 61, 64, 65, 67, 68, 70, 73–75, 143
Р
Радіус аніона 101
Радіус атома 99, 101, 102, 110, 140
Радіус катіона 142
Радон 88
Реагент 18, 26
Реактант 18–21, 26, 27, 30, 31, 40, 60–62, 64, 67, 70, 74, 75, 78
Реакція екзотермічна 65
Реакція ендотермічна 66
Реакція заміщення 144
Реакція ланцюгова 62
Реакція розкладання 13, 14, 67, 69–73
Реакція сполучення 67, 68, 70, 71
Реакція хімічна 12, 13, 19, 21, 22, 25, 26, 28, 30, 31, 61, 66, 67, 73–75
Рівень зовнішній енергетичний 98–100, 102, 105, 111, 112, 114–118, 121, 126, 139–141
С
Сахароза 133, 139
Сенсор 14, 30, 51, 54, 55, 57, 58
Силіцій 134
Синтез 15, 25, 26
Синтез води 25, 26
Система 31, 82, 85, 88, 89, 91, 97, 99, 113, 114, 121, 129, 145, 149
Система періодична хімічних
елементів 99
Систематизування 82, 83, 86
Сірка 42, 68, 143, 152
Сірководень 72
Скло 30, 60, 136, 151
Скло кришталеве 132
Сода харчова 36, 187
Спалах 62
Сплав 139, 144–146, 150
Срібна медаль, монета 40, 143
Сталактит 76
Сталь 144, 145
Стратосфера 56
Сульфід 67, 69–72, 116, 124, 143
Сульфур(ІV) оксид 116
Сульфур(VІ) оксид 116
Сфалерит 70
Схема хімічної реакції 25–29, 71, 72, 143, 144, 148
Т
Таблиця періодична хімічних
елементів 23, 88, 91, 92, 96–109, 147
Температура займання, самозаймання 19, 51, 52, 59–62
Температура кипіння 12, 13, 130, 131, 135, 137
Температура плавлення 130, 135–137
Термопара 60
У
Умови звичайні 45, 68, 87, 97
Умови нормальні 42–47
Ф
Фермент 73, 76
Флюорит 150
Формула електронна 114, 115
Формула хімічна 7, 8, 11, 17, 25–27, 71, 72, 117, 123, 124
Фосфор білий 137
Фотосинтез 13, 15, 17, 21
Фтор 112
Х
Хімічний зв’язок металічний 140–142
Хімічної реакції швидкість 73, 74, 76–
78
Хлор 57, 86, 88, 92, 100, 116, 124, 125, 143
Ц
Цинк 42, 139
Ч
Чавун 145
Число масове (нуклонне) 90, 92, 104
Число протонне 89, 90, 96–99, 102, 103, 105, 109, 111, 119
Я
Явища 9, 41, 51, 97, 112, 131, 147
Явища періодичні 97
Явища фізичні 9, 12
Явища хімічні 9, 12
Ядро атома 93, 94, 98, 99, 107, 112
Лавуазьє Антуан Лоран 22
Ліндґрен Астрід 84
88, 89
Божена 83, 138 Ньюлендс Джон Александер 88
Польз Марія-Анна П’єретта 22
Самійленко Володимир 83
Сент-Екзюпері де Антуан 84
Стефанович Олекса 83
Трублаїні Микола 84
Леся 49, 83 Фарадей Майкл 18 Франко
131
89 Шанкуртуа Олександр Еміль 88 Тлумачний словничок
Актинідин — речовина (C10H13N), що приваблює котів, з дією, подібною до дії
непеталактону, активної сполуки, що міститься в котячій м’яті.
Алгоритм — послідовність дій або інструкцій, спрямованих на виконання певного завдання.
Аморфний — матеріал чи стан речовини, який не має чіткої кристалічної структури. Наприклад, скло
обмежує багатогранник.
Дизайн — процес творчого планування і створення об’єктів, що поєднує функціональність й естетичність.
Дилогія — літературний чи художній твір, що складається з двох частин.
Диптих — твір мистецтва або літератури, поділений на дві взаємопов’язані частини.
Дистиляція — метод очищення рідин через випаровування і конденсацію.
Використовують у виробництві спирту, очищенні води.
Екосистема — сукупність організмів і неживих складників, які взаємодіють у певному середовищі.
Електростатика — розділ фізики, що
електричних зарядів.
Змінна
Інтелект
ухвалення рішень.
Йододефіцит — нестача Йоду в організмі, що
щитоподібної залози.
Карст — геологічне явище, пов’язане з розчиненням вапнякових чи гіпсових порід підземними водами, що
«зламати кригу» в стосунках учасників групи.
Кристалохімія — наука, що вивчає зв’язок між хімічним складом речовин і їхньою кристалічною структурою.
Кришталь гірський — прозорий різновид кварцу (SiO2), який використовують для виготовлення прикрас, предметів декору.
Логістика — процес планування, організації, транспортування і зберігання ресурсів для забезпечення ефективності.
Малахіт — поширений мінерал класу карбонатів (Cu2(CO3)(OH)2).
Метод науковий — систематичний підхід
що включає формулювання гіпотез, експерименти й аналіз.
Монополія
Монорейка — залізнична система, де
Непеталактол — хімічна сполука (C10H16O2), яка міститься
Nepeta (котячий
Непеталактон — запашна речовина (C10H14O2), що міститься в котовнику (Nepeta), приваблює котів.
П’єзокристал — кристал,
Пасьянс
ЛАШЕВСЬКА Ганна Анатоліївна ХІМІЯ
Підручник для 8 класу закладів загальної середньої освіти
Формат 84×108/16. Обл.-вид. арк.
Видавництво «Літера ЛТД». Україна, 03057, м. Київ, вул. Нестерова, 3, оф. 508. E-mail: commerce.litera@gmail.com Свідоцтво про реєстрацію ДК № 6901 від 10.09.2019 р. Лашевська Г. А. Хімія :
: Літера ЛТД, 2025. – 160 с. : іл. ISBN 978-966-945-477-5
