Leslie E. Craine David J. Hart
Fondamenti di chimica organica

CHIMICA

INDICE GENERALE
1
IL LEGAME CHIMICO E L’ISOMERIA
GLI ALCANI
E I CICLOALCANI
11 Riepilogo sull’isomeria
Le reazioni degli alcani
A L’ossidazione e la combustione: gli alcani come combustibili
Energia alternativa, i vantaggi dell’idrogeno
B L’alogenazione degli alcani
PER SAPERNE DI PIÙ
Il metano, il gas di palude, e l’esperimento di Miller
13 Il meccanismo radicalico a catena dell’alogenazione
A La stabilità dei radicali
B Le reazioni di alogenazione: reattività e selettività
GLI ALCHENI E GLI ALCHINI
1 Definizione e classificazione
2 La nomenclatura
3 Alcune caratteristiche dei doppi legami 72
4 Il modello orbitalico del doppio legame: il legame pi-greco (π) 73
5 L’isomeria cis–trans negli alcheni 75
6 Le reazioni di addizione e di sostituzione a confronto 76 PER SAPERNE DI PIÙ La chimica della visione 77
7 Le addizioni al doppio legame 78
A L’addizione di alogeni 78
B L’addizione di acqua (idratazione)
C L’addizione di acidi
8 L’addizione di reagenti asimmetrici ad alcheni asimmetrici: la regola di Markovnikov
9 Il meccanismo di addizione elettrofila agli alcheni
10 La spiegazione della regola di Markovnikov
11 L’equilibrio di reazione: che cosa rende possibile una reazione? 86
COMPOSTI AROMATICI
PER SAPERNE DI PIÙ
La vitamina E: tocoferoli e tocotrienoli 126
10 Effetti dei sostituenti nelle sostituzioni elettrofile 127
A I gruppi orto, para-orientanti 128
B I gruppi meta-orientanti 130
11 L’importanza degli effetti orientanti nella sintesi 132
12 Gli idrocarburi policiclici aromatici 132
PER SAPERNE DI PIÙ
Gli idrocarburi policiclici aromatici e il cancro 134
Mappa del capitolo 135 Esercizi 136
LA STEREOISOMERIA
1 La chiralità e gli enantiomeri 140
2 I centri stereogenici e l’atomo di carbonio stereogenico 142
3 La configurazione e la convenzione R-S 145
4 La convenzione E-Z per gli isomeri cis-trans 149
5 La luce polarizzata e l’attività ottica 150
6 Le proprietà degli enantiomeri 153
7 Le proiezioni di Fischer 154
8 I composti con più di un centro stereogenico 156
9 I composti meso 158
10 Riepilogo delle definizioni di stereochimica 159
PER SAPERNE DI PIÙ Enantiomeria e attività biologica 161
11 Il decorso stereochimico delle reazioni 162
12 La risoluzione delle miscele racemiche 163
COMPOSTI ORGANICI
1 La sostituzione nucleofila 170
3 I meccanismi di sostituzione nucleofila 174
4 Il meccanismo SN2 175
5 Il meccanismo SN1 177
6 I meccanismi SN1 ed SN2 a confronto 180
PER SAPERNE DI PIÙ
Le reazioni SN2 in natura: le metilazioni biologiche 181
7 La deidroalogenazione, una reazione di eliminazione. I meccanismi E2 ed E1 182
8 La competizione tra sostituzione ed eliminazione 184
A Gli alogenuri terziari 184
B Gli alogenuri primari 185
C Gli alogenuri secondari 185
9 I composti alifatici polialogenati 186
PER SAPERNE DI PIÙ
I CFC, lo strato di ozono e il mercato
GLI ALCOLI, I FENOLI
E I TIOLI
1 La nomenclatura degli alcoli 193
PER SAPERNE DI PIÙ Gli alcoli prodotti industrialmente 195
2 La classificazione degli alcoli 196
3 La nomenclatura dei fenoli 196
4 Il legame idrogeno negli alcoli e nei fenoli 197
5 Acidità e basicità rivisitate 198
6 L’acidità degli alcoli e dei fenoli 200
7 La basicità degli alcoli e dei fenoli 203
8 La disidratazione degli alcoli ad alcheni 203
9 La reazione degli alcoli con gli acidi alogenidrici 205
10 Altri metodi di preparazione degli alogenuri alchilici a partire dagli alcoli 206
11 Alcoli e fenoli a confronto 207
12 L’ossidazione degli alcoli ad aldeidi, chetoni e acidi carbossilici 208
13 Gli alcoli con più di un ossidrile 209
PER SAPERNE DI PIÙ
Alcoli e fenoli di importanza biologica 210 5 6 7
2 Esempi di sostituzioni nucleofile 171
14 La sostituzione elettrofila aromatica sui fenoli 211
15 L’ossidazione dei fenoli 211
16 I fenoli come antiossidanti 212
17 I tioli, analoghi solforati degli alcoli e dei fenoli 213
PER SAPERNE DI PIÙ
I capelli: ricci o lisci?
GLI ETERI E GLI EPOSSIDI
1 La nomenclatura degli eteri 220
2 Le proprietà fisiche degli eteri 221
3 Gli eteri come solventi 222
4 Il reagente di Grignard: un composto organometallico 222
5 La preparazione degli eteri 225
6 La scissione degli eteri 226
PER SAPERNE DI PIÙ L’etere e l’anestesia
7 Gli epossidi (ossirani) 228
8 Le reazioni degli epossidi
9 Gli eteri ciclici 231 GREEN CHEMISTRY
MTBE: l’etere per la benzina senza piombo 233 Mappa del capitolo
LE ALDEIDI E I CHETONI
1 La nomenclatura delle aldeidi e dei
2 Aldeidi e chetoni comuni
3 I metodi di preparazione delle aldeidi e dei chetoni
4 Le aldeidi e i chetoni in natura 243
5 Il gruppo carbonilico
6 L’addizione nucleofila ai carbonili: considerazioni meccanicistiche 245
7 L’addizione di alcoli: la formazione di emiacetali e di acetali
L’addizione di acqua: l’idratazione di aldeidi e chetoni
L’addizione di reagenti di Grignard e di acetiluri
cianidrico:
L’addizione di nucleofili all’azoto
ACIDI CARBOSSILICI E DERIVATI
nomenclatura degli acidi
Le proprietà fisiche degli acidi
Acidità e costanti di acidità
4 Perché gli acidi carbossilici sono acidi?
5 L’influenza della struttura sull’acidità: l’effetto induttivo rivisitato
6 La trasformazione degli acidi in sali
7 I metodi di preparazione degli acidi
A L’ossidazione degli alcoli primari e delle aldeidi
B L’ossidazione delle catene laterali dei composti aromatici
La reazione dei reagenti di Grignard con diossido di carbonio
L’idrolisi dei cianuri (nitrili)
9 Gli esteri 284
10 La preparazione degli esteri: l’esterificazione di Fischer 285
11 Il meccanismo di esterificazione con catalisi acida: la sostituzione nucleofila acilica 286
12 I lattoni 288
13 La saponificazione degli esteri 288
14 L’ammonolisi degli esteri 289
15 La reazione degli esteri con i reagenti di Grignard 290
16 La riduzione degli esteri 291
17 I composti acilici attivati 291
18 Gli alogenuri acilici 292
19 Le anidridi degli acidi 294
20 Le ammidi 296
CHEMISTRY I tioesteri, le funzioni che attivano i gruppi acilici in natura 296
21 Sommario delle reazioni dei derivati degli acidi carbossilici 298
22 Gli idrogeni in alfa degli esteri: la condensazione di Claisen 301 GREEN CHEMISTRY Chimica verde e ibuprofene: un caso di studio 303
del capitolo 304 Esercizi
LE AMMINE E ALTRI COMPOSTI AZOTATI
1 Classificazione e struttura delle ammine 309
2 La nomenclatura delle ammine 310
3 Le proprietà fisiche e le interazioni intermolecolari delle ammine 312
4 La preparazione delle ammine: l’alchilazione dell’ammoniaca e delle ammine 313
5 La preparazione delle ammine: la riduzione di composti azotati 315
6 La basicità delle ammine 317
7 Il confronto delle basicità e acidità delle ammine e delle ammidi 319
8 La reazione delle ammine con gli acidi forti: i sali delle ammine 320
9 Le ammine chirali nella risoluzione delle miscele racemiche 322
10 L’acilazione delle ammine con i derivati degli acidi 322
11 I composti di ammonio quaternari 324
12 I sali di diazonio aromatici 325
13 La diazocopulazione: i coloranti azoici 328
LA SPETTROSCOPIA
1 I principi della spettroscopia
2 La spettroscopia di risonanza magnetica nucleare (NMR)
La registrazione di uno spettro NMR
Il chemical shift e l’area dei picchi
C La separazione (splitting) spin-spin dei segnali
3 La spettroscopia 13C NMR
SAPERNE
4 La spettroscopia infrarossa
5 La spettroscopia visibile e ultravioletta
6 La spettrometria di massa
I COMPOSTI ETEROCICLICI
1 La piridina, un eterociclo aromatico
2 Le reazioni di sostituzione sulla piridina 362
3 Altri eterocicli a sei termini
4 Gli eterocicli a cinque termini: furano, pirrolo e tiofene
5 Le reazioni di sostituzione elettrofila del furano, del pirrolo e del tiofene 370
PER SAPERNE DI PIÙ
Le porfirine: perché il sangue è rosso e l’erba è verde?
6 Altri eterocicli a cinque termini: gli azoli 372
7 Eterocicli a cinque termini con anelli condensati: gli indoli e le purine 373
PER SAPERNE DI PIÙ
La morfina e altri farmaci azotati 375
Mappa del capitolo
I POLIMERI SINTETICI
1 La classificazione dei polimeri 379
2 La polimerizzazione per addizione radicalica 380
3 La polimerizzazione per addizione cationica 385
4 La polimerizzazione per addizione anionica 386
5 I polimeri stereoregolari: la polimerizzazione di Ziegler–Natta 387
GREEN CHEMISTRY
Le microplastiche 389
PER SAPERNE DI PIÙ
Poliacetilene e polimeri conduttori 390
6 I polimeri dienici: la gomma naturale e la gomma sintetica 390
7 I copolimeri 392
8 La polimerizzazione per condensazione: il Dacron® e il nylon 393
GREEN CHEMISTRY
I polimeri degradabili
PER SAPERNE DI PIÙ Le poliammidi più recenti:le arammidi
9 I poliuretani e altri polimeri di condensazione
del capitolo
I LIPIDI E I DETERGENTI
1 Le caratteristiche dei lipidi
I CARBOIDRATI
Impieghi alternativi dei carboidrati 448
15 I deossi zuccheri 449
16 Gli ammino zuccheri 449
17 L’acido ascorbico (vitamina C) 449
AMMINOACIDI, PEPTIDI
E PROTEINE
1 Gli amminoacidi naturali 455
2 Le proprietà acido–base degli amminoacidi 457
3 Le proprietà acido–base degli amminoacidi con più di un gruppo acido o basico 460
4 L’elettroforesi 462
5 Le reazioni degli amminoacidi 462
6 La reazione della ninidrina 463
7 I peptidi 464
PER SAPERNE DI PIÙ
Alcuni peptididi origine naturale 465
8 Il legame di solfuro 466
9 Le proteine 466
10 La struttura primaria delle proteine 467
A L’analisi degli amminoacidi 467
B La determinazione della sequenza 468
C La scissione selettiva dei legami peptidici 469
11 La logica dell’analisi sequenziale 470
12 La sintesi peptidica 472
13 La struttura secondaria delle proteine 476
A La geometria del legame peptidico 476
B La formazione di legami idrogeno 476
C L’α-elica e il foglietto pieghettato 477
14 La struttura terziaria: proteine fibrose e proteine globulari 478
15 La struttura quaternaria delle proteine 481 PER SAPERNE DI PIÙ
I NUCLEOTIDI
E GLI ACIDI
NUCLEICI
1 La struttura generale degli acidi nucleici 486
2 I componenti dell’acido deossiribonucleico
3 I nucleosidi 487
4 I nucleotidi 489
5 La struttura primaria del DNA 490
6 Il sequenziamento degli acidi nucleici 491
SAPERNE DI PIÙ
7 La sintesi di laboratorio degli acidi nucleici 492
8 La struttura secondaria del DNA: la doppia elica 493
Altri nucleotidi biologicamente importanti
SAPERNE DI PIÙ
LE RISORSE DIGITALI
Al libro è associato un sito contenente numerosi contenuti digitali per comprendere meglio quanto studiato, per approfondire aspetti applicativi della disciplina e per mettersi alla prova con esercizi che aiutano a prepararsi all’esame.
Il sito del libro è raggiungibile digitando questo indirizzo: universita.zanicheli.it/hart-fond
Per accedere alle risorse protette è necessario registrarsi su myzanichelli.it e inserire il codice di attivazione personale che si trova sull’etichetta nella prima pagina del libro. Dal sito del libro è possibile:
• leggere gli approfondimenti Per saperne di più e La storia della scienza ;
• g uardare numerosi video;
• consultare le soluzioni degli esercizi proposti nel libro;
• t rovare il link per accederei a centinaia di test interattivi di autovalutazione;
• esplorare la tavola periodica interattiva ;
• accedere direttamente alla versione Ebook .
All’interno dei capitoli, nel colonnino, è indicato quali approfondimenti e video sono disponibili per comprendere o approfondire l’argomento trattato.


I video, in particolare, spiegano in modo semplice ma approfondito alcuni concetti complessi. Per esempio, alcuni di essi spiegano le strutture delle molecole e la stereoisomeria. Altri invece permettono di approfondire le reazioni chimiche mediante lo svolgimento di esperimenti di laboratorio; altri ancora illustrano l’impatto della disciplina per la vita umana.
Video, test e approfondimenti sono consultabili direttamente anche sullo smartphone scaricando l’app laZ Guarda!
L’app laZ Guarda!
Con l’app laZ Guarda! si può accedere ai contenuti digitali in modo immediato usando un device portatile, come lo smartphone o il tablet. Per visualizzare le risorse disponibili, è sufficiente avviare l'app e inquadrare con lo smartphone le icone presenti nella prima pagina di ogni capitolo.
L’app laZ Guarda! si scarica da App Store (sistemi operativi Apple) e da Google Play (sistemi operativi Android).
Le risorse digitali protette sono disponibili per chi acquista il libro nuovo. L’accesso all’Ebook e alle risorse digitali protette è personale, non condivisibile e non cedibile, né autonomamente né con la cessione del libro cartaceo.


Elenco dei video e degli approfondimenti digitali
Capitolo 1
L a storia della scienza Gilbert Newton Lewis
V ideo Come si forma il legame covalente?
V ideo Qual è l’ibridazione del carbonio?
Capitolo 2
Video Come si riconoscono gli alcani e i cicloalcani?
Per saperne di più Isomeri possibili e isomeri impossibili
Capitolo 3
Video Come vanno nominati gli idrocarburi alifatici?
Video Come si riconoscono gli alcheni?
Video Q ual è l’ibridazione del carbonio?
Capitolo 4
L a storia della scienza Michael Faraday
Video C he cosa sono i composti aromatici?
Per saperne di più Il C60, una sfera aromatica: i fullereni
Video Q uale effetto ha il fumo di tabacco sul nostro corpo?
Capitolo 5
Video C he cos’è la stereoisomeria?
Per saperne di più Gli esperimenti di Pasteur, interpretati da van’t Hoff e Le Bel
Capitolo 7
Video Come si riconoscono gli alcoli?
Video Come si distinguono alcoli primari, secondari e terziari?
Per saperne di più I chinoni e il coleottero bombardiere
Video Come si riconoscono i fenoli?
Capitolo 8
Per saperne di più L’epossido della Lymantria Dispar
Capitolo 9
Video Come si riconoscono aldeidi e chetoni?
Video Come si distinguono aldeidi e chetoni?
L a storia della scienza Stanislao Cannizzaro
Capitolo 10
Video Come si riconoscono gli acidi carbossilici?
Video Come si riconoscono gli esteri?
Per saperne di più La sintesi dell’urea e l’industria dei fertilizzanti
Capitolo 11
Video Come si distinguono le ammine primarie, secondarie e terziarie?
Video Come si riconosconole ammine?
Per saperne di più Gli alcaloidi e le rane delle frecce avvelenate
Capitolo 12
Video Come funziona lo spettrometro di massa?
Capitolo 13
Video Q uale effetto hanno le droghe sul nostro corpo?
Capitolo 14
Per saperne di più Un po’ di storia dei polimeri
L a storia della scienza Giulio Natta
Video Come si ottiene il nylon in laboratorio?
Per saperne di più Le applicazioni dei polimeri in campo medico
Per saperne di più I polimeri biologici
Capitolo 15
Video C he cosa sono i lipidi?
Per saperne di più Prostaglandine, Aspirina® e dolore
Video Come funzionano i contraccettivi ormonali?
Capitolo 16
Video C he cosa sono i carboidrati?
Per saperne di più I surrogati dei grassi da carboidrati
Capitolo 17
Video C he cosa sono le proteine?
L a storia della scienza Linus Pauling
Video C he cosa causa l’anemia falciforme?
Capitolo 18
Video C he cosa sono gli acidi nucleici?
Video Come è stata scoperta la struttura del DNA?
Video Come avviene il sequenziamento del DNA?
Video Come si fa il DNA fingerprinting?
Video Come avviene la replicazione del DNA?
Video Come avviene la trascrizione del DNA?
Video Come avviene la traduzione?
Video Come è stato decriptato il codice genetico?
Video Come avviene la sintesi proteica?
Per saperne di più Gli acidi nucleici e i virus
Video Come è stata scoperta la relazione tra geni ed enzimi?
PRESENTAZIONE
Alla base di ogni forma di vita, la chimica organica permette di spiegare e mettere in relazione i molteplici fenomeni che caratterizzano gli esseri viventi. Dalle reazioni che avvengono all’interno delle cellule, responsabili del metabolismo e della trasmissione dell’informazione genetica, fino alle applicazioni più avanzate della biotecnologia e della chimica farmaceutica, la chimica organica fornisce gli strumenti concettuali e pratici per comprendere la materia vivente. Ogni proteina, lipide, zucchero o acido nucleico che costituisce gli organismi biologici è, in fondo, il risultato dell’incredibile versatilità del carbonio e della sua capacità di formare legami stabili e complessi.
Questo manuale nasce con l’obiettivo di accompagnare studenti e studentesse in un percorso graduale e completo attraverso i principi della chimica del carbonio, offrendo una visione unitaria e integrata della disciplina. L’intento è quello di far emergere come la chimica organica non sia un insieme di regole astratte, ma un linguaggio per descrivere e interpretare il mondo biologico, le applicazioni farmacologiche e le implicazioni per l’ambiente. Attraverso collegamenti costanti con la biologia molecolare, la farmacologia, le scienze dei materiali e le più recenti applicazioni industriali, il testo mostra come le scoperte della ricerca contemporanea stiano cambiando profondamente la nostra quotidianità, dalla medicina personalizzata alle tecnologie verdi.
L’esposizione dei contenuti segue un andamento graduale, senza dare nulla per scontato. Le proprietà e la reattività dei diversi gruppi funzionali e dei principali composti organici – alcani, alcheni, alchini, alcoli, composti aromatici – vengono introdotte in modo chiaro e sistematico, con un’attenzione particolare al modo in cui la struttura delle molecole determina il loro comportamento chimico. Ampio spazio è dedicato alla rappresentazione grafica: disegni, modelli tridimensionali e schemi di reazione permettono di visualizzare con immediatezza i meccanismi attraverso cui gli atomi si riorganizzano e danno origine a nuove sostanze. Numerosi Esercizi svolti, esempi applicativi e domande di verifica guidano nella comprensione dei concetti e nella loro traduzione in pratica. Le Note a margine invitano a soffermarsi su aspetti chiave o su errori comuni da evitare, mentre i box di glossario richiamano definizioni essenziali per fissare il lessico tecnico della disciplina. Questo approccio integrato favorisce un apprendimento attivo, in cui la teoria e la pratica dialogano continuamente.
La disposizione dei quattro gruppi legati a un centro stereogenico si chiama configurazione di quel centro.
N OTA Il modo m igliore per convinc erci che, scambiando le pos iz ioni di due gruppi qual siasi legati a un centro stereogenico, si ot tiene l’enantiomero, è quello di lavorare sui modelli molecolari.
ESERCIZIO SVOLTO 2
Rappresentiamo i due enantiomeri del 3-metilesa no
RISOLUZIONE Si possono rappresentare in vari modi. Ne riportiamo due. Per prima cosa scriviamo il carbonio 3 con i suoi quattro legami tetraedrici:
ESERCIZIO SVOLTO 2
Poi leghiamo i quattro gruppi diversi in ordine casuale:
Rappresentiamo i due enantiomeri del 3-metilesano
RISOLUZIONE Si possono rappresentare in vari modi. Ne riportiamo due. Per prima cosa scriviamo il carbonio 3 con i suoi quattro legami tetraedrici:
Poi leghiamo i quattro gruppi diversi in ordine casuale:
In ne disegniamo l’immagine speculare, oppure scambiamo la posizione di due gruppi qualsiasi:
In ne disegniamo l’immagine speculare, oppure scambiamo la posizione di due gruppi qualsiasi:
NOTA Il modo m igliore per convinc erci che, scambiando le pos iz ioni di due gruppi qual siasi legati a un centro stereogenico, si ottiene l’enantiomero, è quello di lavorare sui modelli molecolari.
Particolare attenzione è riservata ai temi della Green Chemistry, con schede di approfondimento che illustrano come la chimica organica possa contribuire in modo concreto a un futuro più sostenibile. Vengono presentati esempi di processi a basso impatto ambientale, materiali biodegradabili, solventi ecocompatibili e strategie per la riduzione dei rifiuti e delle emissioni. Altre schede, intitolate Per saperne di più, ampliano l’orizzonte della trattazione, collegando gli argomenti del capitolo alle scoperte più recenti o a casi di studio tratti dal mondo reale, come lo sviluppo di nuovi farmaci, i biopolimeri o le fonti rinnovabili di energia.

Per favorire il consolidamento dei contenuti, ogni capitolo si chiude con una mappa concettuale che riassume in modo visuale i punti principali e le relazioni tra i concetti affrontati. Seguono un riepilogo delle reazioni e una sintesi dei meccanismi di reazione che spiegano come e perché le trasformazioni chimiche avvengono, due strumenti indispensabili per lo studio e il ripasso.
Completano il volume una ricca sezione di esercizi – di difficoltà crescente, pensati per l’autovalutazione – e un ampio corredo di risorse digitali. Come spiegato nelle pagine XII e XIII, nel sito del libro sono disponibili le soluzioni degli esercizi, molte schede di approfondimento, diversi video che rendono più facile capire, e molti test interattivi per verificare in tempo reale la propria comprensione. Tutti i materiali digitali sono accessibili anche da smartphone tramite l’app laZ Guarda!
b. 2,3-dimetilbutano 4-etil-2,2-dimetilesano d. 1-etil-1,3-dimetilcicloesano e. f. 1,1,3,3-tetracloropropano
CH CH d. CH CCl CBr e. (CH f. CH CH CHFCH g. MeBr h. CH ClCH Cl Assegnate il nome comune e quello IUPAC ai seguenti composti: CH Br b. CH CH CH Cl

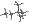
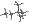
In sintesi, questo manuale non si limita a insegnare la chimica organica: invita a scoprirne la logica interna, la bellezza e le sue innumerevoli applicazioni. È un percorso che unisce rigore scientifico, chiarezza didattica e attenzione ai grandi temi del presente – sostenibilità, salute, innovazione – con l’obiettivo di formare una nuova generazione di professioniste e professionisti consapevoli delle potenzialità della chimica organica e del suo ruolo nel contribuire a costruire un mondo migliore.
PER SAPERNE DI PIÙ Il metano, il gas di palude, e l’esperimento di Miller

Il metano è reperibile in natura ovunque si verifica, ad opera di particolari batteri, la decomposizione di materiale organico in assenza di ossigeno, e dunque nelle paludi, negli acquitrini o nei sedimenti fangosi dei laghi. Da qui deriva il nome comune di gas di palude. In Cina questo gas viene tuttora raccolto dal fango che sta sul fondo degli acquitrini e impiegato per cucinare e per illuminare le case. In modo analogo il metano si forma a opera dei batteri presenti nell’apparato digerente dei ruminanti (per esempio, le mucche).
La quantità di metano prodotta dai batteri è notevole; l’atmosfera terrestre ne contiene in media una parte per milione. Poiché il nostro pianeta è relativamente piccolo e il metano è leggero rispetto alla maggior parte degli altri componenti dell’aria (O2, N2), questo gas in massima parte dovrebbe sfuggire dall’atmosfera terrestre e si è calcolato che la concentrazione all’equilibrio dovrebbe essere molto più bassa di quella in realtà osservata. La concentrazione relativamente elevata di metano è dovuta al fatto che questo gas viene prodotto in continuazione dalla decomposizione batterica di sostanze vegetali e viene così compensata la quantità che sfugge dall’atmosfera.
Nelle città, la quantità di metano nell’atmosfera raggiunge livelli molto più elevati, fino a parecchie parti per milione. Le concentrazioni più alte si osservano al mattino e nel tardo pomeriggio, e sono strettamente collegate al traffico automobilistico. Fortunatamente il metano, che costituisce circa il 50% di tutti gli idrocarburi che inquinano l’atmosfera urbana, sembra non avere effetti dannosi diretti sulla salute umana.
Questo gas a volte si accumula nelle miniere di carbone dove, mescolato con il 5-14% di aria, costituisce un pericolo, essendo la miscela (grisou) altamente esplosiva. Inoltre i minatori possono rimanere asfissiati a causa della mancanza di una quantità sufficiente di ossigeno. Esiste oggi una varietà di dispositivi di sicurezza in grado di rilevare la presenza di concentrazioni pericolose di metano.
L’ idrogeno è l’elemento più comune del sistema solare (costituisce circa l’87% della massa del Sole), ed è ragionevole ritenere che, quando i pianeti si sono formati, gli altri elementi dovessero essere presenti nei loro composti in forma ridotta (invece che ossidata): il carbonio come metano, l’azoto come ammoniaca e l’ossigeno come acqua. Infatti alcuni dei pianeti più lontani, come Saturno e Giove, hanno ancora atmosfere ricche di metano e ammoniaca.
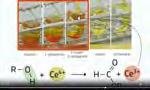
Un esperimento compiuto da Stanley L. Miller (1930-2007) che lavorava nel laboratorio di Harold C. Urey (1893-1981) alla Columbia University, confermerebbe l’ipotesi secondo cui la vita avrebbe avuto origine in un’ atmosfera riducente . Miller scoprì che, quando miscele di metano, ammoniaca, acqua e idrogeno
venivano sottoposte a scariche elettriche (per simulare i lampi), si formavano alcuni composti organici (amminoacidi, per esempio) importanti in biologia e fondamentali per la vita (Figura). Risultati analoghi sono stati ottenuti in seguito usando il calore o la luce ultravioletta al posto delle scariche elettriche (sembra infatti che l’atmosfera primordiale della Terra ricevesse una quantità di radiazioni ultraviolette molto maggiore di quella che riceve ora). Aggiungendo ossigeno a questa atmosfera primordiale simulata, non si ottengono amminoacidi, a conferma del fatto che l’atmosfera originale della Terra non conteneva ossigeno libero. Dai tempi dell’esperimento di Miller le idee sulla chimica dell’origine della vita si sono fatte più precise, grazie a una grande quantità di dati sperimentali e anche grazie all’esplorazione dello spazio. Oggi sappiamo che l’atmosfera primordiale della Terra era costituita prevalentemente da gas emessi dalle sostanze fuse di origine interna, anziché da acquisizioni esterne dal sistema solare. Inoltre sembra probabile che le principali fonti di carbonio in quell’atmosfera fossero CO2 e CO e non il metano, come supposto da Miller, e che l’azoto fosse presente soprattutto come N2 e non come ammoniaca. Ripetendo esperimenti del tipo di quello di Miller, modificati in accordo con questi nuovi orientamenti circa la composizione dell’atmosfera primordiale, si è osservata ancora la produzione di biomolecole.
L’esperimento di Miller fornì il modello per una grande mole di lavoro nel campo della scienza che oggi si chiama evoluzione chimica o chimica prebiotica. Queste ricerche si occupano dello studio degli eventi chimici che probabilmente si verificarono sulla Terra, e in altre parti dell’Universo, e che portarono alla comparsa della prima cellula vivente
Figura
La strumentazione utilizzata da Miller e Urey per studiare l’origine della vita.
Se è presente un eccesso di alogeno, la reazione può proseguire per dare prodotti polialogenati. Dal metano e da un eccesso di cloro si possono ottenere molecole contenenti due, tre o quattro atomi di cloro.
(2.13)
Controllando le condizioni di reazione e il rapporto tra il cloro e il metano è possibile favorire la formazione di uno solo di questi prodotti.
PROBLEMA 19 Scrivete i nomi e le strutture di tutti i prodotti che è possibile ottenere dalla bromurazione del metano.
Nel caso di alcani a catena più lunga si possono ottenere miscele di prodotti fin dal primo passaggio. Per esempio, dal propano:
(2.14)
Quando si alogenano alcani superiori, la miscela di prodotti diventa più complessa e risulta difficile separare e ottenere allo stato puro i singoli isomeri. In questo caso l’alogenazione è poco utile come metodo di sintesi degli alogenuri alchilici. Invece nel caso dei cicloalcani non sostituiti, dove tutti gli idrogeni sono equivalenti, si può ottenere un solo prodotto organico puro:
(2.15)
PROBLEMA 20 Scrivete le strutture di tutti i prodotti di monoclorurazione del pentano. Notate la complessità della miscela di prodotti, in confronto con quella ottenuta dalla corrispondente reazione sul ciclopentano (eq. 2.14).
PROBLEMA 21 Quanti composti organici si possono ottenere dalla monoclorurazione dell’ottano? E del cicloottano?
PROBLEMA 22 Pensate che la clorurazione del 2,2-dimetilpropano possa essere utile come metodo di sintesi? Il meccanismo
Ci si può chiedere quale sia il meccanismo con cui avviene l’alogenazione. Perché sono necessari la luce o il calore? Le equazioni 2.10 e 2.11 rappresentano la reazione complessiva di alogenazione, in quanto riportano le strutture dei reagenti
NOTA Si noti che, come nell’equazione 2.13, a volte per comodità si scrive la formula di uno dei reagenti (in questo caso Cl 2) sopra la freccia. Inoltre, a volte, si trascurano i prodotti inorganici la cui formazione è ovvia (in questo caso HCl).
NOTA Spesso si scrivono equazioni non bilanciate , specialmente quando da un solo reagente organico si può formare più di un prodotto. Al secondo membro dell’equazione sono invece riportate le strutture di tutti i prodotti organici importanti, come nell’equazione 2.14.
Un meccanismo di reazione è una descrizione, passaggio per passaggio, dei processi di rottura e di formazione dei legami che avvengono quando i reagenti reagiscono tra loro per dare i prodotti. Una reazione a catena radicalica comprende uno stadio di inizio, stadi di propagazione della catena e stadi di terminazione della catena
NOTA Si ricordi che, una freccia con una sola aletta (ad amo ) indica il movimento di un solo elettrone; mentre una freccia completa ( ) si riferisce al movimento di una coppia di elettroni.
e dei prodotti, e le condizioni di reazione o i catalizzatori sopra la freccia. Esse però non ci dicono con precisione in che modo i prodotti si formano a partire dai reagenti. Il meccanismo di reazione è una descrizione, passaggio per passaggio, dei processi di rottura e di formazione dei legami che avvengono quando i reagenti si trasformano nei prodotti. Nel caso dell’alogenazione molte evidenze sperimentali indicano che la reazione decorre in vari passaggi e non in un passaggio solo. Essa procede tramite una catena radicalica di reazioni.
Lo stadio di inizio della catena consiste nella rottura della molecola di alogeno in due atomi.
(2.16)
Il legame Cl Cl è più debole sia del legame C H sia del legame C C (si confrontino le energie di legame riportate nell’Appendice in fondo al volume) ed è quello che si rompe più facilmente quando si somministra energia termica. Quando la fonte di energia è la luce, è il cloro molecolare (Cl 2) che assorbe le radiazioni visibili, non l’alcano, ed è sempre il legame Cl Cl quello che si rompe per primo. Gli stadi di propagazione della catena sono:
(2.17)
(2.18)
Gli atomi di cloro sono molto reattivi, perché hanno il guscio di valenza incompleto (sette elettroni anziché gli otto richiesti). Essi possono ricombinarsi per formare di nuovo molecole di cloro (l’inverso dell’equazione 2.16) o, se collidono con una molecola di alcano, possono estrarre un atomo di idrogeno per formare acido cloridrico e un radicale alchilico, R . Abbiamo visto (Capitolo 1, paragrafo 5) che un radicale è un frammento con un numero dispari di elettroni non condivisi. Dai modelli molecolari a spazio pieno della Figura 1 appare evidente che gli alcani sembrano avere un rivestimento di atomi di idrogeno che copre il loro scheletro carbonioso. Per questa ragione è estremamente probabile che un atomo di alogeno, quando collide con una molecola di alcano, colpisca un atomo di idrogeno situato all’estremità di un legame C H.
Come l’atomo di cloro, anche il radicale alchilico che si forma nel primo stadio della catena (eq. 2.17) è molto reattivo (infatti il radicale alchilico, così come il radicale dell’alogeno, ha un ottetto incompleto). Per collisione con una molecola di cloro (Cl 2), può formare una molecola di cloruro alchilico e un atomo di cloro (eq. 2.18). L’atomo di cloro, così formatosi, può a sua volta reagire per ripetere la sequenza. Da notare che, sommando le equazioni 2.17 e 2.18, si ottiene l’equazione complessiva di clorurazione (eq. 2.10). In entrambi gli stadi di propagazione della catena si consuma un radicale (o un atomo), ma si forma anche un altro radicale (o atomo), in grado di propagare la catena. È in questi due stadi che si consuma la massima parte dei reagenti e si forma la massima parte dei prodotti.
GREEN CHEMISTRY
MTBE: l’etere per la benzina senza piombo
Il motore a scoppio è stato inventato nel 1876 dall’ingegnere tedesco Nikolaus August Otto, ma applicato ai veicoli soltanto un decennio dopo, alimentato a benzina. In questi motori la combustione della miscela carburante-aria è innescata da una scintilla, cioè in condizioni di funzionamento corretto l’accensione della miscela avviene dopo l’innesco, in particolare nel momento di massima compressione dei gas. Quando però i gas si trovano a pressione elevata può verificarsi una combustione anomala, cioè la miscela si può auto-accendere per effetto dell’alta pressione: questa autoignizione è detta detonazione
Nei primi motori a scoppio la combustione incontrollata generava il cosiddetto «battito in testa», un malfunzionamento che provocava problemi al motore e un suo indesiderato surriscaldamento. Agli inizi del Novecento, però, non si era ancora capito quale fosse la vera causa della detonazione, tanto che lo si attribuiva a un problema di natura meccanica.
Thomas Midgley, un ingegnere statunitense, fu il primo a capire agli inizi degli anni Venti che la causa della combustione anomala era legata alle caratteristiche della benzina. Ci si rese conto che la benzina era una miscela complessa la cui composizione doveva essere studiata in stretta relazione con il funzionamento del motore. Si iniziarono così ad aggiungere additivi per migliorare il potere antidetonante del carburante.
Come abbiamo visto (scheda «Il petrolio, la benzina e il numero di ottani», pag. 103), il potere antidetonante di una benzina è misurato dal numero di ottani: maggiore è questo numero, maggiore è la resistenza alla detonazione. In questa scala è attribuito valore zero a una molecola di riferimento con pessimo potere antidetonante (n-pentano) e valore 100 a un composto con ottimo potere antidetonante (isoottano).
Dopo aver testato migliaia di sostanze, nel 1921 Midgley trovò un additivo che permetteva di raggiungere le prestazioni desiderate a concentrazioni molto basse: si trattava del piombo tetraetile Pb(CH2 CH3)4. Dopo la sua scoperta, la produzione industriale aumentò esponenzialmente fino ad arrivare, alla fine degli anni Settanta del secolo scorso, a 400 000 tonnellate/anno soltanto negli Stati Uniti.
Già pochi anni dopo il suo utilizzo, ci si accorse che il piombo tetraetile causava seri problemi sanitari a causa della sua tossicità. Che il piombo fosse un metallo nocivo era noto già dall’antichità, soprattutto nelle sue forme di intossicazione acuta, il cosiddetto saturnismo. Il piombo, infatti, è un metallo pesante che si accumula sia nei tessuti minerali (ossa) sia nei tessuti molli (reni, fegato, cervello), causando diverse patologie. Nonostante la sua tossicità, il piombo tetraetile continuò a essere utilizzato fino agli anni Ottanta del secolo scorso provocando seri danni all’ambiente e alla salute pubblica. In seguito, il piombo tetraetile venne progressivamente eliminato dalle benzine e contemporaneamente furono introdotte le marmitte catalitiche. Oltre al suo effetto nocivo, infatti, il piombo impediva l’utilizzo dei filtri per l’abbattimento degli inquinanti perché ne andava a compromettere la funzione catalitica. Per riuscire a mettere sul mercato la benzina senza piombo l’eliminazione del piombo tetraetile venne compensata con l’aggiunta di altri componenti antidetonanti. Vennero introdotti alcuni composti ossigenati (etanolo, metanolo, isobutanolo, eteri) e alcuni idrocarburi ramificati e aromatici (etilbenzene, toluene).

Tra i composti ossigenati più importanti, il terz-butil metil etere (MTBE, Figura) è l’etere che ha dato una svolta allo sviluppo della benzina «verde» senza piombo. Le sue proprietà antidetonanti sono dovute al fatto che il legame tra l’ossigeno e il gruppo terzbutilico si rompe per scissione omolitica generando dei radicali che bloccano l’auto-accensione della miscela benzina-aria.
Come antidetonante l’MTBE presenta diversi vantaggi:
1. ha una t ossicità molto bassa rispetto ad altri composti ottanizzanti come il piombo tetraetile e il benzene; 2. è compatibile con tutti i materiali utilizzati nel motore; 3. si riesce a produrre facilmente a e basso costo; 4. non ha problemi di miscibilità con l’acqua; 5. riduce le emissioni di inquinanti organici presenti nei gas di scarico.
Per queste caratteristiche questo etere è considerato uno dei capostipiti dei composti chimici che, sostituendo componenti inquinanti e nocivi, permettono di «pulire» i carburanti e di ottenere clean fuels. Tuttora l’MTBE e l’ETBE (terz-butil etil etere) sono i principali componenti ottanizzanti della benzina verde, con un contenuto compreso tra il 7% e il 15%.
Tuttavia, anche se l’MTBE ha permesso di sostituire il piombo tetraetile, negli ultimi anni si sta monitorando il suo effetto sull’ambiente. Infatti, a causa della sua elevata solubilità in acqua, l’etere riesce a raggiungere le falde acquifere profonde e vi resta per lungo tempo a causa della sua scarsa degradabilità. Per questo, sono state emanate delle direttive nazionali (Decreto legislativo 152/2006) in cui si stabilisce un limite di 10 ng/L come concentrazione soglia di rischio dell’MTBE nelle acque sotterranee.
Figura
La struttura del terz-butil metil etere (MTBE).
formula generale
R O R′
hanno
nome IUPAC del tipo: gruppi R + etere
R può essere un gruppo alchilico o arilico come in etil metil etere CH3CH2 O CH3 con la regola il gruppo alcossido più piccolo è denominato come sostituente della catena di carbonio più lunga
eteri e gli epossidi
se ciclici sono sono usati come ETERI
epossidi (o ossirani)
basso punto di ebollizione rispetto agli alcoli corrispondenti
perché
non si formano legami idrogeno intermolecolari tra eteri
RIEPILOGO DELLE REAZIONI
1. I composti organometallici
a. Preparazione dei reagenti (o reattivi) di Grignard (par. 4)
b. Preparazione dei composti di organolitio (par. 4)
c. Idrolisi dei reagenti organometallici ad alcani (par. 4)
2. Gli eteri
a. Preparazione per disidratazione degli alcoli (par. 5)
b. Preparazione da alcheni e alcoli (par. 5)
c. Preparazioni da alcoli e alogenuri alchilici (par. 5)
il temine più semplice è
solventi
perché sono utili nella preparazione di composti inerti reagenti di Grignard
se sono grandi anelli sono reagiscono con detti eteri corona che formano complessi con ioni positivi esempio nucleofili
che sono composti organometallici polieteri macrociclici
determinando l’apertura dell’anello
d. Scissione con acidi alogenidrici (par. 6)
e. Scissione con tribromuro di boro (par. 6)
3. Gli epossidi
a. Preparazione dagli alcheni (par. 7)
b. Reazione con acqua e con alcoli (par. 8)
c. Reazione con reagenti organometallici (par. 8)
Eteri ed epossidi: struttura, nomenclatura e proprietà
1. Gli eteri presentano un angolo di legame di:
A 180°
B circa 120°
C circa 109°
D circa 90°
2. Individuate la frase corretta relativa agli eteri.
A Danno legame idrogeno tra loro.
B Hanno bassi punti di ebollizione.
C Sono molto reattivi.
D Hanno idrogeni acidi.
3. Qual è la frase corretta relativa agli eteri a basso peso molecolare?
A Sono solubili in acqua.
B Sono solubili in alcol.
C Danno legami idrogeno con alcoli e acqua.
D Tutte le affermazioni precedenti sono corrette.
4. Qual è l’affermazione sbagliata relativa agli eteri?
A Gli eteri non reagiscono con acidi e basi.
B Se sono presenti perossidi, questi possono essere distrutti per ossidazione con solfato ferroso.
C Solubilizzano tantissimi composti organici.
D A contatto con l’aria possono formare perossidi.
5. Qual è il numero corretto di eteri isomeri aventi formula C5H12O?
A Tre
B Quattro
C Cinque
D Sei
6. Indicate la frase sbagliata riferita agli epossidi.
A Sono molto stabili.
B Si possono ottenere dagli alcheni con i peracidi.
C Industrialmente si ottengono dall’etilene.
D Dall’apertura dell’anello si possono formare i glicoli.
7. Quanti eteri chirali esistono con formula C6H14O?
A Due
B Tre C Quattro D Cinque
8 Perché si dice che gli eteri non hanno «idrogeni acidi»?
9. Spiegate perché gli eteri non possono formare legami idrogeno tra loro ma lo possono fare con acqua o alcoli.
10. Disponete in ordine di temperatura di ebollizione crescente i seguenti eteri spiegando il criterio seguito:
a. etere etilico
b. etere propilico
c. etere isopropilico
d. etere butilico
11. Scrivete le formule di struttura dei seguenti composti:
a. dimetil etere
b. etil isopropil etere
c. 2-metossiesano
d. allil propil etere
e. p-clorofenil metil etere
f. trans-2-etossiciclopentanolo
g. etilen glicole dietil etere
h. 1-metossipropene
i. ossido di propilene
j. p-etossianisolo
12. Assegnate il nome ai seguenti composti:
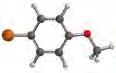

13. La capsaicina, alcaloide responsabile del sapore piccante del peperoncino habanero, trova impiego anche negli spray repellenti per allontanare dai giardini piccoli mammiferi nocivi.
Un intermedio ragionevole per la sintesi della capsaicina potrebbe essere il fenolo mostrato di seguito. Qual è il nome IUPAC di questo fenolo?
14. Gli eteri e gli alcoli possono essere tra loro isomeri. Scrivete le strutture e denominate tutti i possibili isomeri che hanno formula molecolare C4H10O.
15. Scrivete le formule di struttura dei seguenti composti aventi all’incirca lo stesso peso molecolare: 1,2-dimetossietano, etil propil etere, esano e 1-pentanolo.
Preparazione e reazioni dei reagenti di Grignard
16. Indicate la frase sbagliata riferita alla preparazione dei reattivi di Grignard.
A Bisogna operare in ambiente senza idrogeni acidi.
B Si deve utilizzare un alogenuro alchilico o arilico.
C È necessario operare in etere per stabilizzare il reattivo.
D I t rucioli di magnesio vanno sciolti in una base.
17. I reattivi di Grignard, per formare gli alcoli possono reagire con:
A aldeidi
B chetoni
C eteri
D epossidi
E acidi carbossilici
F alogenuri alchilici
18. Per ottenere 1-fenilpropanolo attraverso la sintesi di Grignard occorre utilizzare:
A benzaldeide + bromuro di etilmagnesio
B propanale + bromuro di fenilmagnesio
C propanolo + bromuro di fenilmagnesio
D propanale + bromuro di benzilmagnesio
19. Per reazione del butanone con bromuro di isobutilmagnesio e successiva idrolisi, si ottiene:
A 2,4-dimetil-4-esanolo
B 3,4-dimetil-3-esanolo
C 3,5-dimetil-3-esanolo
D 5-metil-3-eptanolo
20. Che cosa sono, dal punto di vista chimico, i reagenti di Grignard e quali avvertenze occorre applicare per realizzare la loro sintesi?
21. Scrivete la reazione tra il bromuro di fenilmagnesio e l’acqua.
22. Scrivete le equazioni per le reazioni dei seguenti composti con (1) Mg in etere e (2) successiva addizione di D2O alla soluzione ottenuta.
a. CH3CH2CH2CH2I
b. CH3CH2OCH2CH2Br
c. C6H5CH2Br
d. bromuro di allile
La preparazione degli eteri
23. Qual è l’affermazione sbagliata?
A Per sintetizzare eteri asimmetrici è necessaria la sintesi di Williamson.
B Per sintetizzare eteri asimmetrici si utilizza un alogenuro alchilico e un alcolato.
C Per sintetizzare eteri asimmetrici si fa avvenire una reazione SN1.
D Nella sintesi degli eteri, occorre operare in modo da evitare che avvenga anche l’eliminazione.
24. Individuate il completamento sbagliato.
La preparazione degli eteri simmetrici si effettua:
A con una reazione di condensazione.
B con una disidratazione tra due molecole di alcol.
C con alcol e acido solforico a 180°.
D con alcol e acido solforico a 140°.
25. Per sintetizzare il fenil propil etere è opportuno utilizzare:
A cloruro di propile + fenato di sodio
B cloruro di fenile + propilato di sodio
C propanale + fenossido di sodio
D cloruro di propile + benzilato di sodio
26. Che cos’è l’MTBE e come viene prodotto?
27. A quale tipo di reazione appartiene la sintesi di Williamson degli eteri?
28. Se si trattasse con acido solforico una miscela di etanolo e 1-butanolo che cosa si otterrebbe?
Il comportamento degli eteri in acidi e basi
29. Qual è la frase corretta?
A Gli eteri reagiscono con le basi concentrate.
B Gli eteri si scindono con acidi concentrati (HI, HBr) ad alta temperatura.
C Gli eteri si scindono con acidi diluiti a bassa temperatura.
D Gli eteri reagiscono con le basi di Lewis.
30. Quale, tra le seguenti reazioni, non avviene?
A Metil isopropil etere + HI
B Dietil etere + BBr3 seguito da idrolisi
C Tetraidrofurano + NaOH
D Diossano + HBr
31. Per reazione tra etil isopropil etere e acido iodidrico a caldo, si otterrà:
A ioduro di etile + alcol isopropilico
B ioduro di isopropile + etanolo
C ioduro di isopropile + etilene
D etanolo + propene
32. Gli eteri reagiscono sia con gli acidi, sia con le basi?
33. Quali prodotti si ottengono facendo reagire il propil terz-butil etere con HBr concentrato a caldo?
34. Quali prodotti si ottengono trattando con HI concentrato a caldo, l’etil fenil etere?
35. Scrivete le equazioni delle seguenti reazioni. Se la reazione non avviene, spiegatene il motivo.
a. metil propil etere + HBr in eccesso (a caldo) ⟶
b. dibutil etere + NaOH acquosa all’ebollizione ⟶
c. etil etere + H2SO4 concentrato (a freddo) ⟶
d. dipropil etere + Na ⟶
e. etil fenil etere
36. Quando un etere ciclico viene riscaldato in presenza di HBr in eccesso, si ottiene come unico prodotto organico 1,4-dibromobutano.
Scrivete la struttura dell’etere e l’equazione di reazione.
(Suggerimento: vedi il paragrafo 9 del Capitolo 7 e il paragrafo 6 del Capitolo 8.)
Preparazione e reazioni degli epossidi
37. In laboratorio gli epossidi si possono formare tramite le seguenti reazioni:
A a lchene + permanganato di potassio
B a lchene + peracido
C a lchene + ossigeno
D a lchene + acido
38. Indicate, tra le seguenti, la frase corretta.
A L a scissione degli epossidi avviene in ambiente acido.
B L a scissione degli epossidi avviene in ambiente basico.
C L a scissione degli epossidi può avvenire a opera di un reattivo di Grignard.
D Tutte le precedenti affermazioni sono corrette.
39. Che cosa si ottiene dalla reazione tra bromuro di benzilmagnesio e ossido di etilene?
A 1-fenilpropanolo
B 2-fenilpropanolo
C 3-fenilpropanolo
D Non avviene alcuna reazione
40. Sintetizzate l’ossido di propilene e assegnate la nomenclatura IUPAC.
41. Completate la seguente reazione: ossido di stirene + anilina
42. Scrivete le equazioni per le reazioni dell’ossido di etilene con i seguenti reagenti:
a. 1 mole di HCl
b. un eccesso di HCl
c. fenolo + H+
d. bromuro di fenilmagnesio
43. Tramite l’epossidazione di un alchene con un perossiacido e la successiva apertura dell’anello epossidico, progettate una sintesi in due passaggi dell’1,2-butandiolo a partire da 1-butene.
44. Scrivete l’equazione della reazione dell’ammoniaca con l’ossido di etilene. Il prodotto ottenuto è una base organica solubile in acqua, che viene impiegata nella fabbricazione del ghiaccio secco per assorbire e concentrare il CO2.
45. Scrivete tutti i passaggi dei meccanismi delle reazioni dell’equazione 8.20 (pag. 230).
Eteri ciclici
46. Qual è la frase sbagliata riferita al tetraidrofurano?
A Solubilizza molti composti organici.
B È poco reattivo perché stabile.
C Non può dare legami idrogeno.
D È solubile in acqua.
47. Nella nomenclatura degli eteri corona occorre indicare:
A i l numero di atomi di carbonio e il numero di atomi di ossigeno.
B i l numero di atomi totali e il numero di atomi di ossigeno.
C i l numero di atomi totali e il numero di atomi di carbonio.
D Nessuna delle risposte precedenti è esatta.
48. Spiegate che cosa sono gli eteri corona e quali caratteristiche hanno.
49. Che cosa si ottiene trattando il tetraidrofurano con acido iodidrico a caldo?
50. Completate la seguente reazione:
51. Quali prodotti alogenati si ottengono quando l’etere ciclico 1,4-diossano (par. 9, formula a pag. 231) viene riscaldato con un eccesso di HBr?
TEST YOURSELF
52. Write the meaning of: ether, alkoxy group, Grignard reagent, organolithium reagents, organometallic compound, ether cleavage
53. Compare the boiling points and solubilities in water of isomeric ethers and alcohols.

Titolo originale: Organic Chemistry, A Short Course, 13th Edition by Harold Hart, Christopher M. Hadad, Leslie E. Craine, David J. Hart
© 2012, 2007 Cengage Learning, Inc.
© 2025 Zanichelli editore S.p.A., via Irnerio 34, 40126, Bologna [79939]
Revisione e integrazioni: Luca Zoia (basata sulla traduzione di Silvia Cacciari per Chimica organica, ottava edizione, 2019, a sua volta basata sulla traduzione della dodicesima edizione americana di Paolo De Maria per Chimica organica, sesta edizione, 2008)
Le schede Per saperne di più e Green chemistry sono di Fabio Fava, Massimiliano Lanzi, Giulia Pavarelli; gli esercizi integrativi rispetto all’edizione originale sono di Silvia Soresi
Diritti riservati
I diritti di pubblicazione, riproduzione, comunicazione, distribuzione, trascrizione, traduzione, noleggio, prestito, esecuzione, elaborazione in qualsiasi forma o opera, di memorizzazione anche digitale e di adattamento totale o parziale su supporti di qualsiasi tipo e con qualsiasi mezzo (comprese le copie digitali e fotostatiche), sono riservati per tutti i paesi. L’acquisto della presente copia dell’opera non implica il trasferimento dei suddetti diritti né li esaurisce.
Fotocopie e permessi di riproduzione
Le fotocopie per uso personale (cioè privato e individuale, con esclusione quindi di strumenti di uso collettivo) possono essere effettuate, nei limiti del 15% di ciascun volume, dietro pagamento alla S.I.A.E. del compenso previsto dall’art. 68, commi 4 e 5, della legge 22 aprile 1941 n. 633. Tali fotocopie possono essere effettuate negli esercizi commerciali convenzionati S.I.A.E. o con altre modalità indicate da S.I.A.E.
Per le riproduzioni ad uso non personale (ad esempio: professionale, economico, commerciale, strumenti di studio collettivi, come dispense e simili) l’editore potrà concedere a pagamento l’autorizzazione a riprodurre un numero di pagine non superiore al 15% delle pagine del presente volume.
Le richieste vanno inoltrate a: Centro Licenze e Autorizzazioni per le Riproduzioni Editoriali (CLEARedi), Corso di Porta Romana 108, 20122 Milano e-mail: autorizzazioni@clearedi.org e sito web: www.clearedi.org
L’autorizzazione non è concessa per un limitato numero di opere di carattere didattico riprodotte nell’elenco che si trova all’indirizzo www.zanichelli.it/chi-siamo/fotocopie-e-permessi
L’editore, per quanto di propria spettanza, considera rare le opere fuori del proprio catalogo editoriale. La loro fotocopia per i soli esemplari esistenti nelle biblioteche è consentita, anche oltre il limite del 15%, non essendo concorrenziale all’opera. Non possono considerarsi rare le opere di cui esiste, nel catalogo dell’editore, una successiva edizione, né le opere presenti in cataloghi di altri editori o le opere antologiche. Nei contratti di cessione è esclusa, per biblioteche, istituti di istruzione, musei e archivi, la facoltà di cui all’art. 71-ter legge diritto d’autore. Per permessi di riproduzione, diversi dalle fotocopie, rivolgersi a ufficiocontratti@zanichelli.it
Licenze per riassunto, citazione e riproduzione parziale a uso didattico con mezzi digitali La citazione, la riproduzione e il riassunto, se fatti con mezzi digitali, sono consentiti (art. 70 bis legge sul diritto d’autore), limitatamente a brani o parti di opera, a) esclusivamente per finalità illustrative a uso didattico, nei limiti di quanto giustificato dallo scopo non commerciale perseguito. (La finalità illustrativa si consegue con esempi, chiarimenti, commenti, spiegazioni, domande, nel corso di una lezione); b) sotto la responsabilità di un istituto di istruzione, nei suoi locali o in altro luogo o in un ambiente elettronico sicuro, accessibili solo al personale docente di tale istituto e agli alunni o studenti iscritti al corso di studi in cui le parti di opere sono utilizzate; c) a condizione che, per i materiali educativi, non siano disponibili sul mercato licenze volontarie che autorizzano tali usi. Zanichelli offre al mercato due tipi di licenze di durata limitata all’anno accademico in cui le licenze sono concesse: A) licenze gratuite per la riproduzione, citazione o riassunto di una parte di opera non superiore al 5%. Non è consentito superare tale limite del 5% attraverso una pluralità di licenze gratuite, B) licenze a pagamento per la riproduzione, citazione, riassunto parziale ma superiore al 5% e comunque inferiore al 40% dell’opera. Per usufruire di tali licenze occorre seguire le istruzioni su www.zanichelli.it/licenzeeducative
L’autorizzazione è strettamente riservata all’istituto educativo licenziatario e non è trasferibile in alcun modo e a qualsiasi titolo.
Garanzie relative alle risorse digitali
Le risorse digitali di questo volume sono riservate a chi acquista un volume nuovo: vedi anche al sito www.zanichelli.it/contatti/acquisti-e-recesso le voci Informazioni generali su risorse collegate a libri cartacei e Risorse digitali e libri non nuovi Zanichelli garantisce direttamente all’acquirente la piena funzionalità di tali risorse. In caso di malfunzionamento rivolgersi a assistenza@zanichelli.it La garanzia di aggiornamento è limitata alla correzione degli errori e all’eliminazione di malfunzionamenti presenti al momento della creazione dell’opera. Zanichelli garantisce inoltre che le risorse digitali di questo volume sotto il suo controllo saranno accessibili, a partire dall’acquisto, per tutta la durata della normale utilizzazione didattica dell’opera. Passato questo periodo, alcune o tutte le risorse potrebbero non essere più accessibili o disponibili: per maggiori informazioni, leggi my.zanichelli.it/fuoricatalogo
Soluzioni degli esercizi e altri svolgimenti di compiti assegnati
Le soluzioni degli esercizi, compresi i passaggi che portano ai risultati e gli altri svolgimenti di compiti assegnati, sono tutelate dalla legge sul diritto d’autore in quanto elaborazioni di esercizi a loro volta considerati opere creative tutelate, e pertanto non possono essere diffuse, comunicate a terzi e/o utilizzate economicamente, se non a fini esclusivi di attività didattica.
Diritto di TDM
L’estrazione di dati da questa opera o da parti di essa e le attività connesse non sono consentite, salvi i casi di utilizzazioni libere ammessi dalla legge.
L’editore può concedere una licenza. La richiesta va indirizzata a tdm@zanichelli.it
Intelligenza artificiale e copyright Nessuna parte di questo libro, incluse le espansioni digitali, può essere immessa in sistemi di intelligenza artificiale (siano essi chatbot o piattaforme che utilizzano l’IA per la creazione di materiali didattici o di altro tipo) senza il consenso scritto dell’editore.
Ricerca iconografica: Donata Cucchi
Indice analitico: Matilde Soligno
Disegni: Chialab srl, Bologna; Claudia Angela Capelli
Impaginazione: Claudia Angela Capelli
Prima edizione italiana: novembre 2025
Copertina: – Progetto grafico: Falcinelli & Co., Roma – Immagine di copertina: Julia Garan/iStockphoto
Ristampa: prima tiratura 5 4 3 2 1 2025 2026 2027 2028 2029
Realizzare un libro è un’operazione complessa, che richiede numerosi controlli: sul testo, sulle immagini e sulle relazioni che si stabiliscono tra essi. L’esperienza suggerisce che è praticamente impossibile pubblicare un libro privo di errori. Saremo quindi grati ai lettori che vorranno segnalarceli. Per segnalazioni o suggerimenti relativi a questo libro scrivere al seguente indirizzo:
Zanichelli editore S.p.A. Via Irnerio 34 40126 Bologna fax 051293322
e-mail: linea_universitaria@zanichelli.it sito web: www.zanichelli.it
Prima di effettuare una segnalazione è possibile verificare se questa sia già stata inviata in precedenza, identificando il libro interessato all’interno del nostro catalogo online per l’Università. Per comunicazioni di tipo commerciale: universita@zanichelli.it
Stampa:
per conto di Zanichelli editore S.p.A. Via Irnerio 34, 40126 Bologna
Harold Hart Christopher M. Hadad
Leslie E. Craine David J. Hart
Fondamenti di chimica organica
A cura di Luca Zoia
Inquadra e scopri i contenuti
La chimica organica governa ogni aspetto della vita, dai processi cellulari di base alle applicazioni biotecnologiche che stanno rivoluzionando medicina e industria. Partendo dai principi fondamentali della chimica del carbonio, questo manuale propone una visione a tutto tondo della materia, evidenziandone i collegamenti con la biologia, la farmacologia e le scienze ambientali attraverso esempi concreti e riferimenti alle recenti scoperte scientifiche.
Le proprietà e la reattività di alcani, alcheni, alchini, composti aromatici e, in generale, dei gruppi chimici, sono affrontate in modo graduale, senza dare nulla per scontato. Un ampio uso di disegni e schemi rende più semplice e immediato capire i meccanismi di reazione, mentre numerosi Esercizi svolti ed esempi applicativi permettono di comprendere in che modo le molecole organiche si combinino per formare le strutture che so-
Harold Hart è stato professore emerito presso la Michigan State University, East Lansing, MI, Stati Uniti.
Christopher M. Hadad è professore presso l’Ohio State University, Columbus, OH, Stati Uniti.
Leslie E. Craine è professoressa presso la Central Connecticut State University, New Britain, CT, Stati Uniti.
David J. Hart è professore emerito presso l’Ohio State University, Columbus, OH, Stati Uniti.
stengono la vita. A fianco del testo, dei box contenenti voci di glossario richiamano i concetti fondamentali, mentre le Note pongono l’accento su aspetti a cui prestare attenzione.
Le schede Green chemistry e Per saperne di più illustrano come la chimica organica può contribuire a un futuro più sostenibile per l’ambiente, per la salute umana e per lo sviluppo economico.
Per favorire il ripasso e la visione di insieme, al termine di ogni capitolo, una mappa concettuale riassume in modo visuale gli argomenti principali, seguita dal riepilogo delle reazioni e dei meccanismi con cui avvengono. Completano il testo numerosi esercizi, le cui soluzioni sono disponibili nel sito del libro, insieme a video, schede di approfondimento e test interattivi, accessibili anche attraverso lo smartphone con l’app laZ Guarda!
Le risorse digitali universita.zanichelli.it/hart-fond
A questo indirizzo sono disponibili le risorse digitali di complemento al libro.
Per accedere alle risorse protette è necessario registrarsi su my.zanichelli.it inserendo il codice di attivazione personale contenuto nel libro.
Libro con ebook
Chi acquista il libro nuovo può accedere gratuitamente all’Ebook, seguendo le istruzioni presenti nel sito.
L’accesso all’Ebook e alle risorse digitali protette è personale, non condivisibile e non cedibile, né autonomamente né con la cessione del libro cartaceo.
