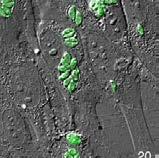
conservadas independientes [6]. Es más sencillo recoger muestras de orina que frotis endocervicacles y, además, son aplicables a ambos sexos. Nuestro objetivo era optimizar un método LAMP empleando cebadores previamente desarrollados [6] para detectar ADN del gen ompA de CT en orina.
Materiales y métodos
Recogida de muestras
Se recogió la primera orina de la mañana de los y las pacientes que acudieron a consulta en las clínicas del NSACP (n=126) y en el Hospital Colombo South Teaching de Kalubowila (Sri Lanka) (n=200) entre el 19 de marzo de 2018 y el 28 de octubre de 2019 (total n=326). Los criterios de inclusión fueron: edad ≥18 años, síntomas de infección urogenital (p.ej. secreción uretral, cervical, o vaginal anómala, elevación de leucocitos en las secreciones, coinfección por Neisseria gonorrhoeae) y pacientes asintomáticos con factores de riesgo (múltiples compañeros sexuales, hombres que practican sexo con hombres, trabajadoras del sexo, clientes de trabajadoras del sexo y personas con contacto con pacientes con cervicitis o uretritis). Se excluyó a los pacientes que hubieran orinado en las dos horas previas al reclutamiento y que hubieran estado tomando antibióticos en las tres últimas semanas. Para el cálculo de la tasa de prevalencia de infección por CT sintomática del 13,9 % y asintomática del 9,2 % [4], se calculó un tamaño muestral de 184 pacientes sintomáticos y 129 asintomáticos, con un margen de error de 0,05 y un intervalo de confianza del 95 % (fórmula estadística http://www. calculator.net/sample-size-calculator.html). Con anterioridad al examen físico de los pacientes, se recogieron 30 mL de la primera orina de la mañana, que se almacenó a 2–8 °C durante un máximo de siete días, para su posterior procesamiento. Se almacenaron alícuotas de orina fresca a −80 °C, con el fin de repetir el análisis durante el proceso de optimización.
Orina de control positivo y negativo
Como control positivo, se utilizó una muestra de orina con resultado positivo tanto mediante PCR anidada [9] como por PCR en tiempo real Artus® C . trachomatis Plus RG (Qiagen, Alemania), como control negativo, se utilizó una muestra de orina negativa en las dos pruebas. Los controles positivo y negativo se dividieron en partes alícuotas y se almacenaron a −20 °C para su uso en todas las pruebas.
Extracción de ADN crudo para la prueba LAMP-SYBR GOLD (método-1)
La extracción de ADN crudo para la prueba LAMP-SYBR GOLD se realizó siguiendo el método descrito por Choopara y col, con algunas modificaciones (método-1) [6]. Se centrifugó la orina (1.5 mL) a 14.000 g durante 30 minutos. Se descartó el sobrenadante y se calentaron 40 µ l del sedimento con 20 µ l de b uffer Tris-HCl 10 m M y EDTA 1 mM (pH 7,5) a 95 °C durante 5 minutos, empleando un Termobloque [6]. Se enfrió con hielo hasta que se aclaró la superficie del líquido. A continuación, se centrifugó a 17.000 g durante un minuto, empleando el sobrenadante para la prueba LAMP-SYBR GOLD. Los extractos de ADN crudos s e prepararon el mismo día en que se realizó la prueba.
Extracción de ADN crudo para la prueba LAMP-SYBR GOLD (método-2)
Modificamos el método-1 para mejorar aún más la sensibilidad de la prueba LAMP-SYBR GOLD. Las alícuotas (1,5 mL) de orina almacenadas, se descongelaron rápidamente en un baño de agua a 37 °C, y se centrifugaron a 14.000 g durante 30 minutos a temperatura ambiente. Se descartó el sobrenadante y se añadieron 200 µl de solución salina tamponada con fosfato (PBS; pH 7,4) para diluir los inhibidores urinarios. Seguidamente, se centrifugó a 14.000 g durante 30 minutos a temperatura ambiente. Tras eliminar el sobrenadante, se disolvió el sedimento en 200 µl de PBS y se calentó a 95 °C durante 5 minutos con 100 µl de buffer Tris-EDTA (pH 7,4). Se enfriaron los tubos en hielo y se centrifugaron a 17.000 g durante 1 minuto. A continuación, se recogió el sobrenadante para realizar la prueba LAMP-SYBR GOLD.
Extracción de ADN de la orina con los kits QIAamp viral RNA
Este kit está recomendado para extraer ADN de bacterias en la orina [8]. La extracción se realizó siguiendo las instrucciones del fabricante para el protocolo de extracción. Se lisaron 140 microlitros de orina, añadiéndolos posteriormente a las columnas de spin, con buffer y centrifugándolos. Se eluyó el ADN en dicho tampón de elución. Finalmente, se almacenaron las alícuotas de ADN a −20 °C para repetir los ensayos.
PCR en tiempo real
Se prepararon plantillas de ADN de la orina de los pacientes con el mini kit QIAmp viral RNA (Qiagen, Alemania).





















Tabla 1. Resultados de las 326 muestras de orina analizadas mediante extracción en crudo LAMP-Sybr Gold (método-1) y PCR en tiempo real.
PCR en tiempo real negativa PCR en tiempo real positiva
LAMP con extracción en crudo (método-1) positivo 20
LAMP con extracción en crudo (método-1) negativo
Tabla 2. Muestras de orina de pacientes sintomáticos y asintomáticos analizadas mediante PCR en tiempo real y LAMP-SYBR GOLD con extracción en crudo, método-1.
Pacientes sintomáticos (n=189)
LAMP + extracción en crudo (método-1) Positivo
LAMP + extracción en crudo (método-1)
Sensibilidad 70.8%
Especificidad 99.4%
Pacientes asintomáticos (n=137)
L AMP + extracción en crudo (método-1) Positivo
L AMP + extracción en crudo (método-1) Negativo
Sensibilidad 75%
Especificidad 100% PCR en tiempo real
patógenos genitales, incluyendo el virus de herpes simple tipo 2, N. gonorrhoeae, M. genitalium, T. vaginalis, y C albicans, tal como indica la ausencia de patrones en escalera en el gel (véase la Figura 6 del Material Suplementario). Cinco de las siete muestras donde se obtuvieron falsos negativos se volvieron a analizar con el método-2 de extracción de ADN crudo. Las cinco muestras se visualizaron levemente positivas bajo luz UV, y la positividad se confirmó con el patrón en escalera observado en la electroforesis en gel (véase Figura 7 del Material Suplementario).
Discusión
Choopara y col (2017) desarrollaron un ensayo LAMP de elevada sensibilidad (91 %) y especifidad (95 %) para detectar CT en frotis endocervicales [6]. Dado que la recogida de muestras de orina es más sencilla, menos invasiva y se puede realizar en ambos sexos, realizamos algunas modificaciones del método de Choopara y col (2017) para poder detectar CT en la orina. Mediante el empleo de cebadores previamente publicados [10], desarrollamos una prueba LAMP-SYBR GOLD para orina. Nuestra LAMP-SYBR GOLD mostró una sensibilidad del 71,4 %, una especifidad del 99,7 % y un LOD de 0,8 copias de ADN de ompA de CT por cada reacción, siendo la tinción Sybr™ Gold el indicador visual utilizado (véase la Figura 6 del Material Suplementario).

de medición en simultáneo















Una de las modificaciones realizadas del protocolo desarrollado por Choopara y col fue el empleo de la polimerasa Bsm [6]. El coste de la polimerasa Bsm es un tercio del precio de la polimerasa Bst, y es más accesible en Sri Lanka. Con el fin de reducir aún más los costes, los cebadores de bucle no se purificaron mediante HPLC. Dichas modificaciones podrán ser las causantes de que el periodo de incubación se prolongara 15 minutos más. Al aplicar a la orina el protocolo de Choopara y col (2017) con las modificaciones anteriormente descritas, el LOD fue de 8,06 × 10 4 copias de ADN de ompA de CT, frente al LOD de 1,8 × 102 copias que se obtuvo con el protocolo original para las muestras endocervicales [6]. Se empleó la prueba LAMP touchdown de aproximación para intentar aumentar la sensibilidad analítica, pero solo logramos aumentar el LOD diez veces (datos no mostrados). Se realizaron algunas modificaciones del método de extracción descrito por Choopara y col (método-1): 1) se centrifugó la orina a 14.000 g durante 30 minutos y se recogió el sedimento para la extracción por calor, 2) tras la extracción por calor, se centrifugó a 17.000 g durante un minuto y se recogió el sobrenadante para el análisis mediante LAMP-SYBR GOLD. Esta modificación de la extracción de ADN crudo aumentó el LOD significativamente. La tinción de gel de ácido nucleico Sybr™ Gold (Invitrogen, EE.UU; Cat.No.S11494) es entre 25 y 100 veces más sensible que el bromuro de etidio y puede ser utilizada a una dilucion alta. La modificación del método de extracción, la elevada sensibilidad de la tinción Sybr™ Gold (Invitrogen, EE.UU; Cat. Nº S11494), y el elevado volumen de plantilla (7 µl), contribuyeron a aumentar el LOD a 8,06 x10−1 (0,8) copias. Se evitó la contaminación del ADN colocando una capa de parafina sobre la mezcla maestra y depositando la plantilla debajo de la capa de cera.
Los factores inhibidores de la orina en la plantilla de ADN genómico crudo podrían explicar la baja sensibilidad clínica, a pesar del LOD de 0,8 copias de ADN de ompA de CT por cada reacción. En segundo lugar, la cantidad de ADN genómico liberado calentando 40 µL de sedimento urinario podría haber sido insuficiente. Es necesario optimizar el volumen de sedimento urinario para la extracción por calor. Los inhibidores urinarios son los responsables de la reducida eficacia de los ensayos LAMP en orina. Edward y col (2014) determinaron que las reacciones
LAMP podrían resistir mayores niveles de urea que los hallados en la orina humana. Jevtuševskaja y col (2016) establecieron que la albúmina sérica bovina, Mg 2+ y la urea a cantidades fisiológicas no afectan al proceso LAMP [11], 12]. En nuestra prueba de sensibilidad analítica, la orina negativa para CT se enriqueció con ADN de CT purificado. Por lo tanto, es improbable que la baja sensibilidad clínica observada en nuestro ensayo LAMP-SYBR GOLD se deba a la urea.
En el método-2 para extracto crudo, con el fin de eliminar la presencia de posibles inhibidores de la orina, se centrifugaron los sedimentos de la orina con PBS (paso de lavado). Este método se aplicó a cinco muestras de pacientes que fueron positivas en la PCR en tiempo real, pero negativas con el método-1 de extracción de ADN crudo. Los resultados vagamente positivos obtenidos en las cinco muestras indican que la eliminación de los inhibidores de orina mediante el método-2 podría mejorar la sensibilidad del ensayo LAMP-SYBR GOLD (Figura 9 del Material Suplementario). Siguiendo la optimización de la cantidad del sedimento urinario, es necesario volver a analizar todas las muestras de los pacientes con el método-2 de extracción para determinar la verdadera sensibilidad clínica de este ensayo LAMP-SYBR GOLD. El
reto a la hora de desarrollar pruebas diagnósticas para los países de recursos limitados es lograr un equilibrio entre el coste y la eficacia de la prueba. Aunque los kits de extracción comerciales mejoran la sensibilidad de las pruebas LAMP, su elevado coste los hace inasumibles para los países pobres. Tal como demuestran diferentes estudios, la extracción de ADN crudo por calentamiento es una forma rápida, económica y adecuada para los ensayos CT LAMP [6], 12].
Desde la introducción del método LAMP por Notomi y col (2000), se han desarrollado escasas pruebas CT LAMP, y las que han surgido, son para muestras endocervicales [6], 8], [13], [14], [15], [16]. La única prueba CT LAMP para orina, desarrollada por Jevtuševskaja y col (2016), precisa tratamiento previo con una mezcla de lisis de péptidos antimicrobianos, mostrando una sensibilidad del 73 % y una especificidad del 100 %, con un LOD de 25 copias de plásmidos por reacción [12]. Con la disponibilidad de kits comerciales de PCR en tiempo real para CT de elevada eficacia, ha disminuido el interés por desarrollar otros métodos diagnósticos más económicos para los países de recursos limitados. Nuestro ensayo LAMP-SYBR GOLD para orina resultó ser sensible y altamente específico para la detección de






NA; JE proporcionó PCR en tiempo real. Todos los autores han aceptado la responsabilidad por el contenido completo de este manuscrito y aprobaron su envío.
Conflicto de intereses: Los autores declaran no tener ningún conflicto de intereses.
Financiación del proyecto: University of Sri Jayewardenepura Grant ASP/RE/2017/74.
Disponibilidad de los datos: Todos los datos generados o analizados durante este estudio se incluyen en este artículo publicado [y sus archivos de información complementaria]. Los datos brutos se pueden obtener previa solicitud del autor correspondiente.
REFERENCIAS BIBLIOGRÁFICAS
1. Utte3-0102. 1. Huai, P, Li, F, Chu, T, Liu, D, Liu, J, Zhang, F. Prevalence of genital Chlamydia trachomatis infeCTion in the general population: a meta-analysis. BMC Infect Dis 2020;20:589. https://doi.org/10.1186/s12879-020-05307-w.Search in Google
ScholarPubMed PubMed Central
2. World Health Organization. Sexually transmitted infections. WHO; 2024. Available from: https://www.who.int/news-room/faCT-sheets/detail/sexually-transmitted-infeCTions-(stis).Search in Google Scholar
3. Gunasekera, HAKM, Silva, KCDP, Prathapan, S, Mananwatte, S, Weerasinghe, G, Abeygunasekera, N. Prevalence of Chlamydia trachomatis in women attending sexually transmitted disease clinics in the Colombo district, Sri Lanka. Indian J Pathol Microbiol 2014:5755–60. https://doi.org/10.4103/0377-4929.130898.Search in Google ScholarPubMed
4. De Silva, RND, Elwitigala, JP, Corea, EM, Attanayake, HAS. Prevalence and associated factors of genital chlamydia infection among central sexually transmitted diseases clinic attendees in Sri Lanka. Sri Lanka J Sex Health HIV Med 2018;4:11–17. https://doi. org/10.4038/joshhm.v4i0.67.Search in Google Scholar
5. Meyer, T. Diagnostic procedures to detect Chlamydia trachomatis infections. Microorganisms 2016;4:25. https://doi.org/10.3390/microorganisms4030025.Search in Google ScholarPubMed PubMed Central
6. Choopara, I, Arunrut, N, Kiatpathomchai, W, Dean, D, Somboonna, N. Rapid and visual Chlamydia trachomatis detection suing loop-mediated isothermal amplification and hydroxynaphthol blue. Lett Appl Microbiol 2017;64:51–6. https://doi.org/10.1111/ lam.12675.Search in Google ScholarPubMed
7. Tang, Y, Yang, X, Duan, L, Zhan, W, Chen, K, Chai, H, et al.. Genetic and clinical characteristics of genital Chlamydia trachomatis infection in Guangzhou, China. Infect Genet EvolInfeCT Genet Evol 2022;101:105285. https://doi.org/10.1016/j.mee-
gid.2022.105285.Search in Google ScholarPubMed
8. Qiagen. QIAamp viral RNA kits. Qiagen; 2013. Available from: https://www.qiagen. com/ko-us/produCTs/diagnostics-and-clinical-research/sample-processing/qiaamp-viral-rna-kits.Search in Google Scholar
9. Somani, J, Bhullar, VB, Workowski, KA, Farshy, CE, Black, CM. Multiple drug–resistant Chlamydia trachomatis associated with clinical treatment failure. J Infect Dis 2000;181:1421–7. https://doi.org/10.1086/315372.Search in Google ScholarPubMed
10. Thermofisher. SYBR gold nucleic Acid gel stain; 2023. https://www.thermofisher. com/order/catalog/produCT/s11494 [Accessed 28th April 2023].Search in Google Scholar
11. Edwards, T, Burke, PA, Smalley, HB, Gillies, L, Hobbsa, G. Loop-mediated isothermal amplification test for detection of Neisseria gonorrhoeae in urine samples and tolerance of the assay to the presence of urea. J Clin Microbiol 2014;52:2163–5. https:// doi.org/10.1128/jcm.00314-14.Search in Google ScholarPubMed PubMed Central
12. Jevtuševskaja, J, Uusna, J, Andresen, L, Krõlov, K, Laanpere, M, Grellier, T, et al.. Combination with antimicrobial peptide lyses improves loop-mediated isothermal amplification based method for Chlamydia trachomatis detection directly in urine sample. BMC Infect Dis 2016;16:329. https://doi.org/10.1186/s12879-016-1674-0.Search in Google ScholarPubMed PubMed Central
13. Chen, X, Zhou, Q, Yuan, W, Shi, Y, Dong, S, Luo, X. Visual and rapid identification of Chlamydia trachomatis and Neisseria gonorrhoeae using multiplex loop-mediated isothermal amplification and a gold nanoparticle-based lateral flow biosensor. Front Cell Infect Microbiol 2023;28:1067554. https://doi.org/10.3389/fcimb.2023.1067554. Search in Google ScholarPubMed PubMed Central
14. Notomi, T, Okayama, H, Masubuchi, H, Yonekawa, T, Watanabe, K, Amino, N, et al.. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res 2000;28:E63. https://doi.org/10.1093/nar/28.12.e63.Search in Google ScholarPubMed PubMed Central
15. Chen, X, Zhou, Q, Tan, Y, Wang, R, Wu, X, Liu, J, et al.. Nanoparticle-based lateral flow biosensor integrated with loop-mediated isothermal amplification for rapid and visual identification of Chlamydia trachomatis for point-of-care use. Front Microbiol 2022;12:914620. https://doi.org/10.3389/fmicb.2022.914620.Search in Google ScholarPubMed PubMed Central
16. Eboigbodin, KE. Application of loop-mediated isothermal amplification assay for the detection of Chlamydia trachomatis and Neisseria gonorrhoeae Methods Mol Biol 2019;2042:19–25. https://doi.org/10.1007/978-1-4939-9694-0_3.Search in Google ScholarPubMed
Este artículo incluye material suplementario (https://doi.org/10.1515/almed-2025-0061).
Received: 2024-07-26 - Accepted: 2025-02-02 - Published Online: 2025-05-29 © 2025 the author(s), published by De Gruyter, Berlin/Boston. This work is licensed under the Creative Commons Attribution 4.0 International License.


Diagnóstico diferencial en el manejo de infecciones respiratorias agudas mediante pruebas rápidas en el punto de atención en un escenario pospandemia en América
Latina: enfoque especial
en
COVID-19, Influenza y Virus Sincicial Respiratorio.
Carlos Arturo Álvarez-Moreno1,2†, Evaldo Stanislau Affonso de Araújo 3,4†, Elsa Baumeister 5,6†, Katya A. Nogales Crespo 7,*†, Alexis M. Kalergis 8,9,10 †, José Esteban Muñoz Medina 11†, Pablo Tsukayama 12,13† y César Ugarte-Gil 12,14†
1 Unidad Infectología, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá 111321, Colombia
2 Clínica Universitaria Colombia, Clínica Colsanitas, Bogotá 111321, Colombia
3 Departamento de Enfermedades Infecciosas del Hospital das Clínicas, Universidad de São Paulo, São Paulo 05403-010, Brasil
4 Inspirali Educação, São Paulo 18683-205, Brasil
5 Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas, Universidad Nacional de La Plata, La Plata B1900, Argentina
6 Facultad de Biotecnología y Nanotecnologías, Universidad Nacional de San Martín, San Martín B1650, Argentina
7 Policy Wisdom LLC, Quebradillas 00678-2705, Puerto Rico
8 Instituto Milenio de Inmunología e Inmunoterapia, Santiago de Chile 8330025, Chile
9 Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile, Santiago de Chile 8331010, Chile
10 Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago de Chile 8331010, Chile
* Autor a quien deberá dirigirse la correspondencia † Estos autores contribuyeron igualmente a este trabajo.
COVID 2024, 4 (2), 221-260; https://doi.org/10.3390/covid4020017
Presentación recibida: 29 de noviembre de 2023 / Revisado: 1 de febrero de 2024 / Aceptado: 5 de febrero de 2024 / Publicado: 10 de febrero de 2024
Resumen
Esta revisión proporciona un resumen exhaustivo de la evidencia para explorar el papel y el valor del diagnóstico diferencial en el manejo de las infecciones respiratorias agudas (IRA) mediante pruebas rápidas en el punto de atención (POC, por sus siglas en inglés) en un escenario pos-pandemia, con especial atención a la enfermedad por coronavirus 2019 (COVID-19), la influenza y el virus sincicial respiratorio (VSR). El documento se basa en una revisión de literatura y políticas, así como en un proceso de validación y retroalimentación por parte de un grupo de siete expertos de Latinoamérica (LATAM). Se recopiló evidencia para comprender las perspectivas científicas y políticas sobre el diagnóstico diferencial de las IRA y las pruebas rápidas en el punto de atención, con un enfoque en siete países: Argentina, Brasil, Chile, Colombia, Costa Rica, México y Perú. La evidencia indica que las pruebas rápidas en el punto de atención pueden contribuir a mejorar la gestión de casos de IRA, la vigilancia epidemiológica, la investigación y la innovación, y la toma de decisiones basada en la evidencia. Con múltiples tipos de pruebas rápidas disponibles para el punto de atención, las decisiones sobre qué prueba utilizar requieren considerar el propósito de la prueba, los recursos disponibles y las características de la prueba en cuanto a precisión, accesibilidad, asequibilidad y tiempo de entrega de resultados. Basado en el entendimiento de la situación actual, este documento proporciona un conjunto de recomendaciones para la implementación de pruebas rápidas POC en LATAM, apoyando la toma de decisiones y guiando los esfuerzos de una amplia gama de partes interesadas.
Palabras clave: infecciones respiratorias agudas, pruebas en el punto de atención, pruebas rápidas, pruebas diagnósticas, COVID-19, influenza, virus respiratorio sincicial, políticas de salud, América Latina
1. Alcance y metodología
Este documento busca explorar y posicionar el rol y el valor del diagnóstico diferencial en el manejo de las Infeccio-
nes Respiratorias Agudas (IRA) a través de pruebas rápidas en el punto de atención (POC) en un escenario pospandémico de la enfermedad por coronavirus 2019 (COVID-19), prestando especial atención a la COVID-19, la influenza y el virus sincicial respiratorio (VSR). El documento proporciona una descripción general de los tipos de pruebas disponibles para las pruebas POC, el valor del diagnóstico diferencial para el manejo de las IRA, las políticas y recomendaciones actuales de las organizaciones internacionales para las pruebas de IRA, y los desafíos y barreras para la implementación de las pruebas rápidas POC. Con base en la evidencia disponible, el documento proporciona un conjunto de soluciones prácticas (recomendaciones) para los desafíos y barreras identificados. Al ilustrar un camino a seguir, las recomendaciones pueden respaldar la toma de decisiones y guiar los esfuerzos de una amplio rango de actores, incluidos los gobiernos, la comunidad académica y las organizaciones internacionales.
La metodología empleada para elaborar este documento se basa en una revisión de literatura y políticas, seguida de un proceso de validación y retroalimentación con un grupo de siete expertos en áreas relevantes. Los expertos fueron seleccionados en función de su mérito académico y experiencia. Sus trayectorias disciplinarias incluyen enfermedades infecciosas, salud pública, diagnóstico y microbiología. Se consideró esencial un conocimiento profundo del diagnóstico, el panorama de políticas sobre IRA y la pandemia de COVID-19.
Se recopiló y analizó evidencia global, regional y nacional de siete países seleccionados (Argentina, Brasil, Chile, Colombia, Costa Rica, México y Perú) entre el 13 de marzo y el 5 de julio de 2023. Los datos y la evidencia provinieron de diversas fuentes, priorizando publicaciones revisadas por pares y fuentes oficiales gubernamentales y de organizaciones internacionales. Las fuentes se seleccionaron y priorizaron para abarcar las siguientes dimensiones:
• Impacto multidimensional de las IRA en la región y países foco.
• Oportunidades y desafíos para el manejo de las IRA en un escenario pospandemia de COVID-19.
• Perspectivas y posiciones científicas sobre el papel y el valor de las pruebas, las pruebas rápidas POC y el diagnóstico diferencial para el manejo de las IRA.
• Las directrices y recomendaciones internacionales actuales respecto de las pruebas para detectar IRA, incluidas las pruebas rápidas en el punto de atención a nivel regional y en los países seleccionados.
• Políticas, marcos y recomendaciones clave para la gestión de las IRA a nivel regional y en los países seleccionados.
La información se sintetizó en un documento de trabajo que posteriormente fue discutido, revisado y validado por todos los expertos durante tres sesiones de panel en línea (2, 6 y 21 de junio de 2023) y rondas de revisión presencial. Todos los expertos participantes aprobaron el documento final.
2. Antecedentes e introducción
El 31 de diciembre de 2019, las autoridades chinas informaron sobre un nuevo coronavirus que causaba un grupo de casos similares a la neumonía. El virus fue identificado posteriormente como el coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2), y la enfermedad causada por este nuevo virus es COVID-19. Para marzo de 2020, solo tres meses después, la Organización Mundial de la Salud (OMS) caracterizó el brote de COVID-19 como una pandemia [1]. En julio y octubre de 2020, la Agencia Europea de Medicamentos (EMA) y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobaron el primer tratamiento para COVID-19 (remdesivir) [2, 3]. Con el objetivo de detener la pandemia, los países de LATAM comenzaron la vacunación durante diciembre de 2020 y enero de 2021 [1]. Finalmente, en mayo de 2023, la OMS declaró el fin de COVID-19 como una emergencia sanitaria mundial [4].
La cronología de las medidas adoptadas y los acontecimientos clave que caracterizaron la pandemia de influenza diez años antes es similar, especialmente en lo que respecta al desarrollo acelerado y la introducción de tecnologías de tratamiento e inmunización ( Figura 1 ). La primera infección humana de la última pandemia registrada del virus de la gripe A (H1N1) se registró en California el 15 de abril de 2009. Sólo unos días después, el 27 de
abril, la FDA emitió la autorización de emergencia de dos inhibidores de la neuraminidasa (zanamivir y fosfato de oseltamivir) para el tratamiento y la profilaxis de la gripe [5]. En junio de 2009, la OMS caracterizó el brote de gripe como una pandemia [6, 7]. En julio del mismo año, comenzaron los ensayos clínicos para desarrollar una vacuna y, en septiembre, tanto la FDA como la EMA anunciaron la aprobación de cuatro vacunas [6, 7, 8]. Desde entonces, y hasta la actualidad, se recomienda la vacunación anual para los grupos de alto riesgo [6, 7]. A medida que el número de casos disminuyó, la OMS declaró el fin de la pandemia el 10 de julio de 2010 [6, 7].
Del mismo modo, el desarrollo e introducción de pruebas para COVID-19 e influenza ocurrieron en el primer mes tras el primer caso registrado [6, 9]. A medida que aumentaron los casos y la demanda creció, los sistemas de salud tuvieron que adaptarse rápidamente para asegurar la disponibilidad de pruebas y la capacidad de los laboratorios para procesar las muestras [10, 11]. Las pandemias de influenza y COVID-19 llevaron a cambios en los algoritmos diagnósticos, priorizando el nuevo virus. Tras la pandemia de influenza, el algoritmo diagnóstico se mantuvo sin cambios significativos de 2009 a 2020, cuando las prioridades de prueba cambiaron rápidamente debido a la llegada de COVID-19 [12, 13, 14]. Mientras el SARS-CoV-2 continúe siendo predominante, las pruebas para este patógeno seguirán siendo una prioridad[15].
En contraste, la cronología de los eventos clave para el VSR muestra un patrón de progreso más lento, atribuido principalmente a vacíos en el conocimiento sobre la protección inmunológica y los resultados poco exitosos en el desarrollo de vacunas inactivadas con formalina para VSR experimentados en 1967 [20]. Sin embargo, en la última década se ha logrado un progreso significativo en el conocimiento de la biología molecular y estructural del VSR y de la respuesta inmune humana, lo que ha dado lugar a varios anticuerpos monoclonales prometedores (mAbs) [34] y vacunas contra el VSR en ensayos clínicos [35]. Estos esfuerzos culminaron en la aprobación por parte de la EMA y la FDA de dos opciones de protección para lactantes: palivizumab (aprobado por la FDA en 1998 y por la EMA en 1999) [32] y nirsevimab (aprobado por la EMA en septiembre de 2022 y por la FDA en julio de 2023) [22, 33], así como las primeras vacunas contra el VRS (Arexvy y Abrysvo) para personas mayores de 60 años, entre abril y mayo de 2023 [23, 24, 27].
Aunque la OMS declaró el fin de la COVID-19 como emergencia de salud pública, esto no significa que la COVID-19
Figura 1. Cronología de eventos clave de IRA. Fuente: Elaboración propia a partir de informes y literatura revisada [1 , 2, 3, 4, 5, 6, 7, 8, 16, 17, 18, 19, 20, 21, 23, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33].

ya no sea una amenaza global; solo que la fase aguda de la pandemia ha terminado [ 4]. La COVID-19 no desaparecerá, pero los países podrán hacer la transición hacia la
integración de medidas relacionadas con la COVID-19 en los servicios y programas de salud de rutina, hasta llegar eventualmente a una etapa endémica [36]. La ende-


micidad no significa necesariamente que una enfermedad sea rara o leve, y que no presente riesgos para la salud pública. Más bien, implica que las tasas de infección permanecen estables, incluso si son altas. Es probable que continúen surgiendo variantes del SARS-CoV-2, algunas de las cuales podrían ser más transmisibles y capaces de evadir la inmunidad [37]. Aunque es cierto que la inmunidad poblacional contra el SARS-CoV-2 sigue acumulándose y puede ayudar a compensar el impacto de tal escenario, la evolución del SARS-CoV-2 es inherentemente impredecible. Es posible que surja un recombinante con alta transmisibilidad vinculada a la biología intrínseca y nuevas propiedades antigénicas [38]. Por lo tanto, mientras los países transitan hacia un escenario pospandémico, los esfuerzos relacionados con COVID-19, incluidas las pruebas y la vigilancia, deben seguir siendo una prioridad.
Endemicidad es un término epidemiológico usado para describir un estado de presencia constante y/o prevalencia usual de una enfermedad o agente infeccioso en una población dentro de un área geográfica [39]. Cuando una infección se vuelve endémica, existen diferentes formas en las que la inmunidad proporciona protección sin eliminar el virus. En el caso del SARS-CoV-2, donde ni la vacunación ni la infección garantizan inmunidad de por vida, es fundamental comprender cómo los diferentes aspectos de la protección (reducción de la susceptibilidad a la infección y reducción de la patología) disminuyen con el tiempo y cómo son potenciados por la infección natural y la vacunación [40, 41]. A medida que el mundo avanza hacia una etapa endémica, los países también enfrentarán el desafío de aumentar las tasas de vacunación rezagadas [42, 43], mientras que al mismo tiempo tienen la oportunidad de mejorar la tecnología y el alcance de las pruebas [44]. En este contexto, el valor de las tecnologías de prueba innovadoras, como las pruebas rápidas (incluyendo las pruebas multiplex), podría hacerse evidente [44].
2.1. Vacunas y tratamientos disponibles y en desarrollo para las IRA
Una visión general de las vacunas y los tratamientos disponibles y en desarrollo para las infecciones respiratorias agudas (IRA) demuestra una considerable inversión en innovación. El desarrollo de nuevas tecnologías podría abrir una oportunidad para cuestionar el papel y el valor del diagnóstico diferencial de las IRA, dado que el diagnóstico podría ser un paso clave para acceder a un tratamiento adecuado.
Actualmente existen tres tipos de vacunas disponibles
contra la COVID-19: vacunas de ARNm, vacunas de subunidades proteicas y vacunas de vectores virales [45]. Hasta mayo de 2023, hay cuatro vacunas en proceso de revisión/ autorización de comercialización en la EMA [46]. El mismo número recibió autorización de uso de emergencia por parte de la FDA [47]. En cuanto a los tratamientos, hay actualmente tres tipos principales disponibles: medicamentos antivirales, moduladores del sistema inmune y anticuerpos monoclonales (mAb). Los medicamentos antivirales se utilizan en casos de COVID-19 leves a moderados para personas con mayor probabilidad de enfermarse gravemente y se pueden administrar por vía oral e infusión intravenosa [48]. Los moduladores del sistema inmune se prescriben para ayudar a suprimir la hiperinflamación cuando la COVID-19 desencadena una reacción hiperactiva del sistema inmunológico. Estos fármacos se utilizan para tratar a adultos y niños hospitalizados que requieren oxígeno suplementario o ventilación mecánica [49]. Los anticuerpos monoclonales son proteínas fabricadas en laboratorio que actúan como los anticuerpos. Los mAb fabricados ayudan a estimular el sistema inmunológico y son un ejemplo destacado de terapéutica personalizada. Aunque tanto la FDA como la EMA han autorizado medicamentos antivirales y moduladores del sistema inmune [3, 49, 50, 51], la FDA aún no ha autorizado mAb para COVID-19 [49]. Hasta octubre de 2022, había 111 tratamientos para COVID-19 en fase de investigación y desarrollo según la EMA, de los cuales 62 son medicamentos antivirales. [51]. De manera similar, según datos de la FDA (hasta enero de 2023), hay 720 programas de desarrollo de fármacos en fase de planificación y se habían revisado 440 ensayos clínicos [47].
Para la influenza, existen múltiples tipos de vacunas disponibles en el mercado, incluidas las vacunas antigripales de dosis estándar, vacunas antigripales basadas en cultivos celulares, vacunas recombinantes, vacunas antigripales de alta dosis, vacunas antigripales con adyuvantes y vacunas intranasales con virus vivos atenuados. La composición de la vacuna contra la influenza se actualiza regularmente de acuerdo con la incidencia de las variantes circulantes del año anterior (que pueden ser o no nuevas)[52]. Con respecto al tratamiento, los medicamentos antivirales para la influenza se pueden usar para prevenir o tratar la infección. Hay dos clases de agentes antivirales que están aprobados y disponibles globalmente: inhibidores de la neuraminidasa (NAI) e inhibidores de M2 (adamantanos) [53, 54]. Dado que los adamantanos no son activos contra las cepas de influenza B y existe una resistencia generalizada entre las cepas de influenza A H1N1 y H3N2 [53, 55], los NAI son los únicos antivirales contra la influenza reco-






mendados actualmente por la OMS [54]. Solo hay un pequeño número de agentes alternativos con efectividad potencial contra cepas resistentes a NAI [56]; por lo tanto, es crucial el desarrollo de nuevos fármacos con un espectro amplio, mejor biodisponibilidad, vías de administración más fáciles y menos efectos adversos. [54, 57]. Hasta el momento, la FDA ha autorizado tres NAI y un adamantano [57, 58], mientras que la EMA ha autorizado dos NAI y ningún adamantano [53]. En el momento de este estudio, hay seis medicamentos antivirales contra la influenza que están en desarrollo y han recibido asesoramiento de la EMA [59].
En relación al VSR, actualmente hay dos vacunas (Arexvy y Abrysvo) recomendadas para adultos mayores recientemente aprobadas por la EMA y la FDA [23, 24, 27, 60], una para mujeres embarazadas y recién nacidos desde el nacimiento hasta los 6 meses a través de protección pasiva (Abrysvo) [60, 61] y una opción preventiva para lactantes de hasta 24 meses (nirsevimab) [22, 33]. En vista del desarrollo global de vacunas contra el VSR, la OMS desarrolló una guía en 2020 para facilitar el desarrollo y la evaluación internacional de candidatas a vacunas contra el VSR [21, 62]. Hasta enero de 2023, hay 12 vacunas y anticuerpos monoclonales en fases 2 y 3 de ensayos clínicos [63].
2.2. Diagnóstico erróneo de las IRA y su impacto en la resistencia a los medicamentos
Si bien la resistencia a los medicamentos antivirales es, a menudo, consecuencia de la evolución del virus —un fenómeno natural—, la evidencia indica una resistencia creciente inducida por la presión selectiva causada por el uso de medicamentos [55, 56, 64]. La resistencia a los antimicrobianos parece acelerarse debido al uso inapropiado de antimicrobianos, así como a su prescripción excesiva [65]. De hecho, con frecuencia se administran antibióticos innecesariamente para las IRA [66, 67], a menudo debido a diagnósticos incorrectos, a la preocupación por las coinfecciones bacterianas, o a la subestimación de los efectos perjudiciales del uso innecesario de antibióticos. [67]. La evidencia indica que hasta la mitad del uso de antibióticos por parte de los pacientes es innecesario o inapropiado [65]. Por lo tanto, es necesario mejorar la gestión del tratamiento del paciente, las pautas de prescripción y el monitoreo de la resistencia [64, 66, 68].
Un mejor y adecuado uso de los tratamientos requiere un diagnóstico preciso y oportuno, para lo cual es particularmente importante el acceso a pruebas diagnósticas sensibles y rápidas [66, 69]. Este beneficio se ha documen-






tado en casos de influenza, donde las pruebas diagnósticas rápidas han ayudado a reducir el uso innecesario de antibióticos en casos positivos y a permitir el tratamiento adecuado de infecciones bacterianas en los casos negativos [70].
3. Impacto de las IRA y la COVID-19 en LATAM
Al 22 de noviembre de 2023, la OMS reportó 772,166,517 casos confirmados de COVID-19, lo que provocó 6,981,263 muertes en todo el mundo [71]. Según el número de muertes acumuladas reportadas, las Américas se perfilan como la región más afectada del mundo, a pesar de representar solo el 8,4% de la población mundial [72]. Las muertes reportadas en la región suman 2,983,561, lo que equivale aproximadamente al 42.7% de las muertes asociadas confirmadas en todo el mundo [71]. Dentro de las Américas, los países de LATAM han sido los más afectados por la pandemia de COVID-19. Mientras que las muertes reportadas por millón de personas son 875.38 a nivel mundial, en las Américas esta cifra aumenta a 2689.55 para América del Norte y América Central, y 3105.43 para América del Sur (al 18 de noviembre de 2023) [73]. Las estimaciones de exceso de mortalidad también confirman el efecto desproporcionado de la COVID-19 en la región. El exceso de
muertes en Latinoamérica (combinando 2020 y 2021) se estima en 2.273.620, lo que representa el 15% del total mundial [74].
Según las muertes acumuladas por millón de habitantes, al 18 de noviembre de 2023, Perú (6511.89) y Brasil (3272.71) se ven afectados desproporcionadamente en comparación con países como Costa Rica (1819.78) y México (2625.69) [73]. De acuerdo al exceso de mortalidad, Perú y México sufren más que otros países de la región, registrando estimaciones de 45.50% y 34.35%, respectivamente [74]. Los datos actuales sobre la carga de enfermedades de COVID-19 deben considerarse con cuidado, ya que algunos países de LATAM dejaron de reportar y/o actualizar casos y muertes por COVID-19 el 31 de mayo de 2023. Esto puede llevar a una percepción artificial de una caída en ambas medidas [75].
En cuanto a las pruebas, según el número de pruebas de COVID-19 realizadas por cada 1000 habitantes, es posible observar que Chile tuvo una estrategia de pruebas más sólida, poniendo las pruebas a disposición de una mayor parte de la población en comparación con otros países de la región (ver columna 6 de la Tabla 1 ) [76, 77]. De manera similar, en lo que respecta a la vacunación, Chile tiene







Tabla 1. Impacto del COVID-19 en los países foco: Argentina, Brasil, Chile, Colombia, Costa Rica, México y Perú.
País/ Región
Argentina
Brazil
Casos acumulados por millón de habitantes (al 18 de noviembre de 2023) [73]
NA: 207,377.11
SA: 157,588.76
Muertes acumulada por millón de habitantes (al 18 de noviembre de 2023) [73]
Exceso de mortalidad (al 31 de diciembre de 2023) a [78]
Pruebas por caso confirmado b [77]
No disponible por región
Pruebas aplicadas por cada 1000 habitantes [76]
No disponible por región
Tipo de pruebas reportadas c [79]
Tasa de vacunación (al 24 de noviembre de 2023) d [71]
Chile
Colombia
220,929.56
3.50
(4 de junio 2022)
(4 de junio 2022)
Costa Rica
México
(22 de junio 2022)
(16 de junio 2022)
2022)
(11 de marzo 2022) 2040.37 (22 de junio 2022) 684.08 (16 de junio 2022) 713.53 (29 de mayo 2022)
(18 de junio 2022)
(18 de junio 2022)
(5 de abril 2022)
(5 de abril 2022) Pruebas
Prueba de Antígeno
Selección de pruebas serológicas
Pruebas PCR
Prueba de Antígeno Selección de pruebas serológicas
Pruebas PCR Prueba de Antígeno
Pruebas PCR
Prueba de Antígeno
Pruebas PCR
Pruebas PCR Prueba de Antígeno
Pruebas PCR
Prueba de Antígeno Pruebas serológicas
Perú a Exceso de mortalidad: La diferencia porcentual entre el número acumulado de muertes desde el 1 de enero de 2020 y el acumulado de muertes proyectadas para el mismo período con base en años anteriores. • Cuántas pruebas realizó un país para encontrar un caso de COVID-19 (con base en el promedio móvil de 7 días), determinado por el número de pruebas dividido por el número de casos confirmados. © Según el tipo de prueba utilizada para reportar los casos como se indica en esta tabla (pruebas PCR, pruebas de antígenos o pruebas serológicas). d Personas vacunadas con serie primaria completa por cada 100 habitantes. e Debido a la disponibilidad de datos, la evidencia se presenta según dos regiones: América del Norte (NA), que incluye a Costa Rica y México, entre otros, y América del Sur (SA), que incluye a Argentina, Brasil, Chile, Colombia y Perú, entre otros. * La información se presenta para el promedio de la región de las Américas de la OMS. Fuente: Elaborado con base en datos disponibles de Our World in Data y la Organización Mundial de la Salud.
la tasa de vacunación más alta entre los países foco, con una tasa de 92,68%, 20 puntos porcentuales por encima de la estimación para LATAM. México, por otro lado, es el único país foco que se desempeñó por debajo de las estimaciones de LATAM, registrando una tasa de vacunación de 63,09% (ver columna 8 de la Tabla 1 ) [71].
No obstante, es esencial mantener una perspectiva crítica y cautelosa al analizar las estadísticas oficiales de COVID-19, ya que las circunstancias podrían ser mucho peores. Los países de la región enfrentaron desafíos con respecto a la detección y el reporte de casos y muertes, lo que puede haber llevado a un subregistro de casos de COVID-19. Esta realidad podría limitar considerablemente los esfuerzos para comparar el impacto entre países. Los países de LATAM utilizan dos sistemas de recopilación y reporte de muertes asociadas a la COVID-19, uno proveniente de los registros civiles (p. ej., Brasil) y otro de los informes del sistema de salud derivados de los sistemas de vigilancia y la síntesis de informes hospitalarios e historias clínicas (p. ej., México) [80, 81]. Si bien los países siguieron las recomendaciones de la Organización Panamericana de la Salud (OPS) para certificar y codificar las muertes [82], las cifras no son plenamente comparables entre países debido a la influencia de los sistemas de reco -
lección y publicación de datos [80]. Además, los datos también están sujetos a cambios y actualizaciones. Por ejemplo, la mayoría de los países consideran dentro de sus protocolos la recodificación de las muertes debido a nuevos resultados de pruebas y cambian en consecuencia en el registro o actualizan los certificados de defunción [83, 84, 85, 86, 87].
En cuanto a la carga de enfermedad de otras IRA, durante la pandemia de COVID-19, la actividad de la influenza y el VSR disminuyó a nivel mundial, especialmente al inicio [12, 88]. Sin embargo, esta disminución también fue heterogénea entre países y trimestres entre marzo de 2020 y septiembre de 2021, según las características demográficas, socioeconómicas, climáticas y de COVID-19[88]. La reducción observada en la prevalencia comunitaria de IRA no asociadas al SARS-CoV-2 durante la pandemia de COVID-19 es innegablemente multifactorial. Muchos autores atribuyen esta reducción a cambios en las circunstancias derivadas de la implementación de medidas de control del SARS-CoV-2, como el uso de intervenciones no farmacéuticas, cambios en los comportamientos de salud, reducciones en la movilidad de las personas (viajes), factores de transmisión específicos del virus, cambios en las prioridades de prueba y sistemas de vigilancia,

y la reasignación de hospitales y centros de prueba [12, 13, 14, 89, 90, 91, 92]. Sin embargo, los cambios en la prevalencia de IRA no-SARS-CoV-2 también podrían estar asociados al desplazamiento de otros virus de IRA a medida que se incorpora un agente novedoso (en este caso SARS-CoV-2). Esto es mejor conocido como la teoría del nicho ecológico de los virus, que se refiere al lugar que cada virus ocupa en el ecosistema, variando dinámicamente según las condiciones climáticas y la presencia de otros patógenos. Según esta teoría, la incorporación de un nuevo virus estacional suele provocar un desplazamiento de otros virus (también podrían observarse interacciones positivas entre virus) [93, 94].
Más allá de la pandemia, la literatura demuestra una brecha en el reporte de infecciones respiratorias en la región. La calidad de los datos y el posible subregistro de la morbilidad y mortalidad por influenza limitan la posibilidad de calcular con precisión la carga de enfermedad [95]. De manera similar, para el VSR, existe una escasez considerable de datos en Latinoamérica [96, 97]. La vigilancia nacional y subnacional es deficiente en la mayor parte del mundo debido a las capacidades limitadas de los Centros Nacionales de Influenza (CNI), fondos insuficientes, falta de coordinación intersectorial y un compromiso variable con la vigilancia por parte de los gobiernos locales [98].
Para investigar los virus en circulación, la OMS estableció el Centro Mundial de Influenza en 1948 y el Sistema Mundial de Vigilancia y Respuesta a la Influenza (GISRS) en 1952 [99]. El GISRS es un mecanismo mundial de vigilancia, preparación y respuesta, que realiza tareas de epidemiología y monitoreo de enfermedades y alertas mundiales para nuevos virus de influenza y otros patógenos respiratorios, y recopila evidencia de los NIC [100]. Los sistemas de vigilancia permitieron a la OMS emitir recomendaciones con respecto a la composición de la vacuna contra la influenza, lo que se ha realizado anualmente desde 1973 y bianualmente desde 1999. Actualmente, la OMS emite dos conjuntos diferentes de recomendaciones cada año: uno para el hemisferio norte en febrero y otro para el hemisferio sur en septiembre [101].
La OMS implementó una estrategia piloto de vigilancia del VSR basada en el SMVRG [102]. El piloto se llevó a cabo en dos fases (la primera abarcó el período 20162018 y la segunda entre 2018 y 2021) [103]. Hoy en día, la mayoría de los países de Latinoamérica utilizan sus
sistemas de Infección Respiratoria Aguda Grave (IRAG) y Enfermedades Similares a la Influenza (ILI) para identificar posibles casos de VSR [104]. Los esfuerzos de datos de vigilancia del VSR tienen como objetivo recopilar evidencia sobre los casos más graves, los tipos de virus, la estacionalidad, los grupos de riesgo y la carga de enfermedad, utilizando esta evidencia para respaldar las medidas de salud pública e informar la política de vacunación contra el VSR [102, 104]. No obstante, la evidencia sugiere un subregistro del VSR, ya que los algoritmos para enfermedades respiratorias solo consideran las pruebas del VSR en escenarios limitados [105, 106].
Según el último informe (2023) de FluNet (una herramienta web global para la vigilancia virológica de la influenza que registra datos de los NICs) [107], la influenza y el SARS-CoV-2 son los dos patógenos virológicos respiratorios más relevantes en las Américas según el porcentaje de casos registrados, representando aproximadamente el 7% y el 13%, respectivamente. Dentro de las Américas, América Central es la subregión con el mayor porcentaje de positividad para SARS-CoV-2 (17,1%) e influenza (14,9%). En particular, aproximadamente el 12% de los casos respiratorios en las Américas corresponden a otros virus respiratorios no identificados, lo que representa el 32% de los casos registrados en América Central. Si bien las IRA se vigilan a través del GISRS y se incluyen en los informes semanales de vigilancia epidemiológica, los datos reportados por los NICs son heterogéneos. Esto a menudo genera una incapacidad para reconocer muchos virus respiratorios diferentes, lo que dificulta la posibilidad de captar la verdadera carga real de las IRA y realizar comparaciones precisas entre países.
Con respecto a los países foco, Brasil registra la mayor carga en términos de prevalencia e incidencia de infecciones respiratorias superiores e inferiores, seguido por Colombia en el caso de las infecciones respiratorias superiores y Perú para las infecciones respiratorias inferiores ( Tabla 2 ) [108]. Según la evidencia sobre la tasa de positividad porcentual acumulada de influenza y VSR (2022), México se perfila como el país más afectado por influenza (34%), y Argentina y Chile por VSR (7%) [109]. Es importante señalar que se puede observar una alta tasa de positividad cuando hay un número elevado de pruebas positivas, pero lo mismo sucedes si el número total de pruebas es demasiado bajo [110]. Al comparar el número de muestras para influenza, México cuenta con 10,314, mientras que Ar-

Tabla 2. Impacto de las infecciones respiratorias, influenza y VSR en los países foco: Argentina, Brasil, Chile, Colombia, Costa Rica, México y Perú.
/ Región
Prevalencia de infecciones de las vías respiratorias inferiores (Tasa; 2019) [108 ]
Prevalencia de infecciones de las vías respiratorias superiores (Tasa; 2019) [108]
Incidencia de infecciones de las vías respiratorias inferiores (tasa; 2019) [108]
Incidencia de infecciones de las vías respiratorias superiores (Tasa; 2019) [108]
Porcentaje acumulado de positividad de influenza (2022) [109]
Porcentaje acumulado de positividad del VRS (2022) [109]
Lutz: 6%
a Brasil no reporta información a nivel nacional sobre casos acumulados de influenza. Fiocruz, Adolfo Lutz y Evandro Chagas son las instituciones que reportan estos indicadores [109]. Fuente: Elaborado con base en datos disponibles de la base de datos de Carga Global de Enfermedad (GBD) del Instituto de Métricas y Evaluación en Salud (IHME) y OurWorld in Data.
gentina tiene más de 20,000 muestras [110].
También es importante considerar las implicaciones directamente asociadas con la COVID prolongada y otras secuelas de la COVID-19 (p. ej., síndrome inflamatorio multisistémico [111]). La prevalencia de la COVID prolongada en Latinoamérica podría alcanzar los 29 millones de casos [112]. Caracterizada por múltiples síntomas como fatiga crónica, daño pulmonar, ansiedad y depresión [113, 114], la COVID prolongada es una discapacidad multidimensional que impacta negativamente la salud física, mental y cognitiva, afectando las actividades diarias y las relaciones sociales, familiares y laborales [113]. A menudo, los pacientes que sufren de COVID prolongada carecen de comprensión de su condición, lo que los lleva a no buscar ayuda o priorizar la recuperación [115]. En Latinoamérica, donde los sistemas de salud a menudo no logran prevenir y controlar adecuadamente las enfermedades crónicas, se espera que el impacto sea mayor [116]. Por lo tanto, existe una necesidad apremiante de diseñar e implementar medidas para abordar esta nueva pandemia [112]. El descubrimiento de la COVID persistente ha acompañado también una mayor comprensión de las secuelas a largo plazo de otras enfermedades respiratorias. Por ejemplo, en la literatura también ha evidenciado que
el VSR está asociadas con un impacto en el desarrollo de la función pulmonar reducida en niños [117, 118].
El impacto duradero de la pandemia de COVID-19 va más allá de la salud y trasciende a las dimensiones sociales y económicas. En LATAM, la pandemia provocó una contracción económica y un retroceso en los indicadores sociales. En 2020, LATAM experimentó una caída del 6,8% en el Producto Interno Bruto (PIB) y un descenso del 7,7% en el PIB per cápita, la mayor disminución anual observada en los 120 años de historia estadística de la región. [119, 120, 121]. Debido al aumento en la tasa de desempleo (3% entre 2019 y 2020) [119, 122] y la disminución de los ingresos, la capacidad de las personas para acceder a los servicios básicos empeoró, lo que llevó a un aumento de la pobreza y la pobreza extrema en la región. Según estimaciones de 2021, aproximadamente 86 millones de personas viven en pobreza extrema y 201 millones de personas viven en pobreza, lo que representa el 13,8% y el 32,1% de la población total de LATAM, respectivamente [119, 120, 121]. La pandemia también aumentó las desigualdades sociales [122]. La COVID-19 no afectó a todos los grupos de población por igual; las mujeres, los niños y los trabajadores esenciales fueron los más impactados [122]. Mientras los países luchaban por ha-


cer frente a la pandemia, la región también fue testigo de un estallido de protestas sociales y un cambio en las tendencias políticas caracterizado por un aumento de las prácticas autoritarias y la corrupción, instituciones democráticas debilitadas, sistemas judiciales politizados y altos niveles de criminalidad violencia [120].
Otras IRA también tienen implicancias socioeconómicas negativas en Latinoamérica. Una revisión de la literatura sobre influenza, por ejemplo, concluyó que existe una carga económica significativa relacionada con la hospitalización, el tratamiento y otros gastos de recursos [95]. En Sudamérica, se ha encontrado que las IRA impactan negativamente la salud y la productividad, representando un costo de USD 834 millones, el 0,024% del PIB combinado de los países [123]. Similar a la repercusión socioeconómica de la pandemia de COVID-19, un estudio sobre el impacto de la pandemia de influenza de 2009 en México encontró que los costos asociados con la atención médica durante la pandemia fueron una fracción menor que los costos asociados con el impacto en otros sectores debido a las medidas tomadas para prevenir la transmisión [124].
Se pueden aprender muchas lecciones valiosas de la pandemia de COVID-19 con respecto a la gestión de emergencias de salud pública y el papel fundamental que desempeña la salud en el desarrollo sostenible y el bienestar. La pandemia exacerbó los desafíos de larga data que enfrentan los sistemas de salud de la región de LATAM, incluida la fragmentación de los servicios, las desigualdades en el acceso y el financiamiento y la escasa capacidad para responder a las emergencias de salud pública [122]. La pandemia puso de manifiesto que son necesarias políticas de salud integrales para mantener la salud en el centro del desarrollo sostenible [125, 126], y reforzó la necesidad urgente de reestructurar los sistemas de salud, priorizando un modelo centrado en las personas basado en la Cobertura Universal de Salud, garantizada a través de un mayor gasto público en salud y sostenibilidad financiera [126, 127, 128].
La interrupción de los servicios de salud en curso, como los programas de cribado e inmunización, causada por la pandemia [122], así como los cambios de comportamiento (por ejemplo, la reticencia a las vacunas), exige medidas dirigidas a restaurar y reforzar los programas de salud [127, 128, 129, 130]. D ichas medidas deben prestar especial atención a la salud mental y a las poblaciones que se han visto desproporcionalmente afectadas [126, 131, 132]. Los esfuerzos de recuperación de la pandemia deben ir acompañados de mecanismos y marcos de cooperación y coordinación mundiales y regionales para responder y prevenir las emergencias de salud pública. Basados en las lecciones aprendidas de la pandemia de COVID-19, los gobiernos de todo el mundo deberían desarrollar un nuevo acuerdo sobre pandemias,
actualizar el Reglamento Sanitario Internacional (RSI) vigente, crear un Fondo Mundial de Salud e implementar estrategias nacionales para la prevención y preparación ante epidemias y pandemias basadas en virus respiratorios utilizando un enfoque integrado [125].
Esta nota continuará en la próxima edición de Revista Bioreview.
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Mundial de la Salud (OMS). Archivado: Cronología de la OMS — COVID-19. 27 de abril de 2020. Disponible en línea: https:// www.who.int/news/item/27-04-2020-who-timeline---covid-19 (consultado el 13 de agosto de 2023).
2. Administración de Alimentos y Medicamentos de EE. UU. (FDA). La FDA aprueba el primer tratamiento para la COVID-19. 2020. Disponible en línea: https://www.fda.gov/news-events/press-announcements/ fda-approves-first-treatment-covid-19 (consultado el 13 de agosto de 2023).
3. Agencia Europea de Medicamentos. Tratamientos de la COVID-19: Autorizados. 2023. Disponible en línea: https://www.ema.europa. eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/treatments-covid-19/covid-19-treatments-authorised (consultado el 3 de mayo de 2023).
4. Naciones Unidas. El director de la OMS declara el fin de la COVID-19 como una emergencia sanitaria mundial. Noticias ONU , 5 de mayo de 2023. Disponible en línea: https://news.un.org/en/ story/2023/05/1136367 (consultado el 13 de agosto de 2023).
5. Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Autorizaciones de uso de emergencia de ciertos medicamentos antivirales: zanamivir y fosfato de oseltamivir; Disponibilidad. 2009. Disponible en línea: https://www. federalregister.gov/documents/2009/08/04/E9-18568/authorizations-of-emergency-use-of-certain-antiviral-drugs-zanamivir-and-oseltamivir-phosphate (consultado el 12 de agosto de 2023).
6. Centros para el Control y la Prevención de Enfermedades (CDC). Cronología histórica de la influenza. 2019. Disponible en línea: https://www.cdc.gov/flu/pandemic-resources/pandemic-timeline-1930-and-beyond.htm (consultado el 10 de agosto de 2023).
7. Centro Europeo para la Prevención y el Control de Enfermedades (ECDC). Cronología de la pandemia (H1N1) 2009. Agosto de 2010. Disponible en línea: https://www.ecdc.europa.eu/en/seasonal-influenza/2009-influenza-h1n1-timeiline (consultado el 10 de agosto de 2023).
8. Yu, Y.; Garg, S.; Yu, PA; Kim, H.-J.; Patel, A.; Merlin, T.; Redd, S.; Uyeki, TM. Uso de peramivir para el tratamiento de pacientes hospitalizados con influenza A(H1N1)Pdm09 bajo autorización de uso de emergencia, octubre de 2009-junio de 2010. Clin. Infect. Dis. 2012 , 55 , 8–15. [Google Académico] [CrossRef] [PubMed]
9. Centro Europeo para la Prevención y el Control de Enfermedades (ECDC). Pandemia de la enfermedad por coronavirus 2019 (COVID-19): Aumento de la transmisión en la UE/EEE y el Reino Unido — Séptima actualización ; ECDC: Estocolmo, Suecia, 2020. Disponible en línea: ht tps://www.ecdc.europa.eu/sites/default/files/documents/ RRA-seventh-update-Outbreak-of-coronavirus-disease-COVID-19. pdf (consultado el 10 de agosto de 2023).
10. Pabbaraju, K.; Wong, AA; Douesnard, M.; Ma, R.; Gill, K.; Dieu, P.; Fonseca, K.; Zelyas, N.; Tipples, GA: Respuesta de un laboratorio de salud pública a la pandemia. J. Clin. Microbiol. 2020 , 58 , e01110-20. [Google Académico] [CrossRef]
11. Centros para el Control y la Prevención de Enfermedades (CDC). Diez años de logros: Una mirada retrospectiva al progreso desde la pandemia de H1N1 de 2009. 2019. Disponible en línea: https://www. cdc.gov/flu/spotlights/2018-2019/decade-since-h1n1-pandemic. html (consultado el 12 de agosto de 2023).
12. Chow, EJ; Uyeki, TM; Chu, HY: Efectos de la pandemia de COVID-19 en la actividad viral respiratoria comunitaria. Nat. Rev. Microbiol. 2022 , 21 , 195-210. [Google Académico] [CrossRef]
13. Bish, DR; Bish, EK; El-Hajj, H.; Aprahamian, H. Un enfoque robusto de pruebas agrupadas para ampliar la capacidad de detección de COVID-19. PLoS ONE 2021 , 16 , e0246285. [Google Académico] [CrossRef] [PubMed]
14. Hills, T.; Kearns, N.; Kearns, C.; Beasley, R. Control de la influenza durante la pandemia de COVID-19. Lancet 2020 , 396 , 1633–1634. [Google Académico] [CrossRef] [PubMed]
15. Organización Panamericana de la Salud (OPS). Guía para la Implementación del Ensayo Multiplex RT-PCR de Influenza y SARS-CoV-2 en la Vigilancia Integrada de Influenza y COVID-19. Mayo de 2021. Disponible en línea: https://www.paho.org/es/documentos/guidance-implementation-influenza-and-sars-cov-2-multiplex-rt-pcr-assay-influenza-and (consultado el 10 de agosto de 2023).
16. Centro Europeo para la Prevención y el Control de Enfermedades (ECDC). Variantes preocupantes del SARS-CoV-2 a 10 de agosto de 2023. Disponible en línea: https://www.ecdc.europa.eu/en/covid-19/ variants-concern (consultado el 10 de agosto de 2023).
17. Comisión Europea. COVID-19: La Comisión insta a los Estados miembros a intensificar su preparación para la próxima fase de la pandemia. 2022. Disponible en línea: https://ec.europa.eu/commission/presscorner/detail/en/ip_22_2646 (consultado el 10 de agosto de 2023).
18. Organización Mundial de la Salud (OMS). Gripe (estacional). 2023. Disponible en línea: https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal) (consultado el 13 de agosto de 2023).
19. Centros para el Control y la Prevención de Enfermedades (CDC). Infección por el virus respiratorio sincitial (VSR). Para profesionales de la salud. 2023. Disponible en línea: https://www.cdc.gov/rsv/clinical/index.html#clinical%20 (consultado el 10 de agosto de 2023).
20. Acosta, PL; Caballero, MT; Polack, FP. Breve historia y caracterización de la enfermedad por virus respiratorio sincitial intensificado. Clin. Vaccine Immunol. 2016 , 23 , 189–195. [Google Académico] [CrossRef]
21. Organización Mundial de la Salud (OMS). Enfermedad por el virus respiratorio sincitial (VRS). Disponible en línea: https://www.who. int/teams/health-product-policy-and-standards/standards-and-specifications/vaccine-standardization/respiratory-syncytial-virus-disease (consultado el 13 de agosto de 2023).
22. Agencia Europea de Medicamentos (EMA). Nuevo medicamento para proteger a bebés y niños pequeños de la infección por el virus respiratorio sincitial (VRS). 2022. Disponible en línea: https://www. ema.europa.eu/en/news/new-medicine-protect-babies-infants-respiratory-syncytial-virus-rsv-infection (consultado el 10 de agosto de 2023).
23. Agencia Europea de Medicamentos (EMA). Primera vacuna para proteger a los adultos mayores de la infección por el virus respiratorio sincitial (VRS). 2023. Disponible en línea: https://www.ema. europa.eu/en/news/first-vaccine-protect-older-adults-respiratory-syncytial-virus-rsv-infection#:~:text=EMA%20has%20recommended%20 a%20marketing,respiratory%20syncytial%20virus%20(RSV) (consultado el 10 de agosto de 2023).
24. Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). La FDA aprueba la primera vacuna contra el virus respiratorio sincitial (VRS). 2023. Disponible en línea: https://www.fda.gov/ news-events/press-announcements/fda-approves-first-respiratory-syncytial-virus-rsv-vaccine (consultado el 12 de agosto de 2023).
25. Administración de Alimentos y Medicamentos de EE. UU. (FDA). La FDA aprueba el primer antiviral oral para el tratamiento de la COVID-19 en adultos. 2023. Disponible en línea: https://www.fda. gov/news-events/press-announcements/fda-approves-first-oral-anti-
viral-treatment-covid-19-adults#:~:text=Today%2C%20the%20U.S.%20 Food%20and,19%2C%20cluding%20hospitalization%20or%20death (consultado el 12 de agosto de 2023).
26. Agencia Europea de Medicamentos (EMA). Paxlovid recibió autorización condicional de comercialización. 2023. Disponible en línea: h ttps://www.ema.europa.eu/en/medicines/human/EPAR/ paxlovid#:~:text=Paxlovid%20received%20a%20conditional%20marketing,authorisation%20on%2024%20February%202023 (consultado el 10 de agosto de 2023).
27. Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Aprobación de la BLA-ABRYSVO. Collegeville. Mayo de 2023. Disponible en línea: https://www.fda.gov/media/168890/download (consultado el 12 de agosto de 2023).
28. Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Preguntas frecuentes sobre la autorización de uso de emergencia de Paxlovid para el tratamiento de la COVID-19. Julio de 2023. Disponible en línea: https://www.fda.gov/media/155052/download (consultado el 12 de agosto de 2023).
29. L aRotta, J.; Escobar, O.; Ávila-Aguero, ML; Torres, JP; Sini de Almeida, R.; del Carmen Morales, G.; Srivastava, A. COVID-19 en América Latina: Una instantánea en el tiempo y el camino por delante. Infect. Dis. Ther. 2023 , 12 , 389–410. [Google Académico] [CrossRef]
30. Salud Pública de Inglaterra. Prueba diagnóstica del nuevo coronavirus de PHE se implementa en todo el Reino Unido. Gobierno del Reino Unido. 2020. Disponible en línea: https://www.gov. uk/government/news/phe-novel-coronavirus-diagnostic-test-rolled-out-across-uk (consultado el 13 de agosto de 2023).
31. Agencia Europea de Medicamentos (EMA). Vacunas contra la gripe pandémica A(H1N1)v autorizadas mediante el procedimiento del expediente central. Nota explicativa sobre las consideraciones científicas relativas a la autorización de vacunas contra la gripe pandémica A(H1N1)v ; EMA: Londres, Reino Unido, 2009. Disponible en línea: https://www.ema.europa.eu/en/documents/medicine-qa/ explanatory-note-scientific-considerations-regarding-licensing-pandemic-ah1n1v-vaccines_en.pdf (consultado el 10 de agosto de 2023).
32. Simoes, EAF; Groothius, JR. Profilaxis del virus respiratorio sincitial: la historia hasta ahora. Respir. Med. 2002 , 96 , S15–S24. [Google Académico] [CrossRef] [PubMed]
33. Administración de Alimentos y Medicamentos de EE. UU. (FDA). La FDA aprueba un nuevo fármaco para prevenir el VSR en bebés y niños pequeños. 2023. Disponible en línea: https://www.fda.gov/ news-events/press-announcements/fda-approves-new-drug-preventrsv-babies-and-toddlers (consultado el 10 de agosto de 2023).
34. Malik, B.; Ghatol, A. Entendiendo cómo funcionan los anticuerpos monoclonales. 2023. Disponible en línea: https://www.ncbi.nlm.nih. gov/books/NBK572118/ (consultado el 13 de agosto de 2023).
35. Mejias, A.; Rodríguez-Fernández, R.; Oliva, S.; Peeples, ME; Ramilo, O. El camino hacia una vacuna contra el virus respiratorio sincitial. Ann. Allergy Asthma Immunol. 2020 , 125 , 36–46. [Google Académico] [CrossRef]
36. Naciones Unidas. COVID-19: Con dosis de refuerzo, pruebas y preparación podríamos poner fin a la pandemia este año. Noticias de la ONU. 2022. Disponible en línea: https://news.un.org/es/ story/2022/09/1515191 (consultado el 13 de agosto de 2023).
37. Klobucista, C.; Ferragamo, M. ¿Cuándo se volverá endémica la COVID-19? Consejo de Relaciones Exteriores. 2023. Disponible en línea: https://www.cfr.org/in-brief/when-will-covid-19-become-endemic (consultado el 10 de agosto de 2023).
38. Carabelli, AM; Peacock, TP; Thorne, LG; Harvey, WT; Hughes, J.; de Silva, TI; Peacock, SJ; Barclay, WS; de Silva, TI; Towers, GJ; et al. Biología de las variantes del SARS-CoV-2: Escape inmunitario, transmisión y aptitud física. Nat. Rev. Microbiol. 2023 , 21 , 162–177. [Google Académico] [CrossRef]
39. Centros para el Control y la Prevención de Enfermedades (CDC). Introducción a la Epidemiología. 2018. Disponible en línea: https:// www.cdc.gov/training/publichealth101/epidemiology.html (consultado el 10 de agosto de 2023).
40. Antia, R.; Halloran, ME. Transición a la endemicidad: Entendiendo la COVID-19. Inmunidad 2021 , 54 , 2172–2176. [Google Académico] [CrossRef]
41. Siggins, MK; Thwaites, RS; Openshaw, PJM. Durabilidad de la inmunidad al SARS-CoV-2 y otros virus respiratorios. Trends Microbiol. 2021 , 29 , 648–662. [Google Académico] [CrossRef]
42. Mendoza, RU; Hartigan-Go, KY; Brillantes, AB; Ruiz, KEV; Baysic, IS; Valenzuela, SA. Las políticas públicas (no el coronavirus) deberían definir el significado de endemia. J. Glob. Health 2022 , 12 , 03050. [Google Scholar] [CrossRef] [PubMed]
43. Biancolella, M.; Colona, V. L.; Mehrian-Shai, R.; Watt, J. L.; Luzzatto, L.; Novelli, G.; Reichardt, J. K. V. Actualización sobre la COVID-19 2022: Transición de la pandemia a la fase endémica. Hum. Genom. 2022 , 16 , 19. [Google Académico] [CrossRef] [PubMed]
44. Potter, S. Cuando la COVID-19 es endémica, ¿cuál es el papel de las pruebas? PBS Wisconsin , 2022. Disponible en línea: https://pbswisconsin.org/news-item/when-covid-19-is-endemic-whats-the-role-of-
testing/ (consultado el 13 de agosto de 2023).
45. Centros para el Control y la Prevención de Enfermedades (CDC). Resumen de las vacunas contra la COVID-19. 2023. Disponible en línea: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/different-vaccines/overview-COVID-19-vaccines.html (consultado el 10 de agosto de 2023).
46. Agencia Europea de Medicamentos (EMA). Medicamentos contra la COVID-19. Disponible en línea: https://www.ema.europa.eu/en/ human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/covid-19-medicines (consultado el 10 de agosto de 2023).
47. Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Programa de Aceleración del Tratamiento del Coronavirus (CTAP). 2023. Disponible en línea: https://www.fda.gov/drugs/ coronavirus-covid-19-drugs/coronavirus-treatment-acceleration-program-ctap (consultado el 12 de agosto de 2023).
48. Administración de Preparación y Respuesta Estratégica (ASPR). ¿Cuáles son las posibles opciones de tratamiento para la COVID-19? Departamento de Salud y Servicios Humanos de EE. UU. Disponible en línea: https://aspr.hhs.gov/COVID-19/Treatments/Pages/Possible-Treatment-Options-for-COVID19.aspx#oral-antivirals (consultado el 13 de agosto de 2023).
49. Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Coronavirus (COVID-19) | Medicamentos. 2023. Disponible en línea: https://www.fda.gov/drugs/emergency-preparedness-drugs/ coronavirus-covid-19-drugs (consultado el 13 de agosto de 2023).
50. Centros para el Control y la Prevención de Enfermedades (CDC). Tratamientos y medicamentos para la COVID-19. 2023. Disponible en línea: https://www.cdc.gov/coronavirus/2019-ncov/your-health/ treatments-for-severe-illness.html (consultado el 13 de agosto de 2023).
51. Agencia Europea de Medicamentos (EMA). Medicamentos contra la COVID-19 en evaluación. Disponible en línea: https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/covid-19-medicines/covid-19-medicines-under-evaluation (consultado el 13 de agosto de 2023).
52. Centros para el Control y la Prevención de Enfermedades (CDC). Vacunas contra la gripe estacional. 2022. Disponible en línea: https://www.cdc.gov/flu/prevent/flushot.htm#:~:text=Several%20different%20brands%20of%20standard,(muscle)%20with%20a%20needle (consultado el 13 de agosto de 2023).
53. Agencia Europea de Medicamentos (EMA). Gripe pandémica. Disponible en línea: https://www.ema.europa.eu/en/human-regulatory/
overview/public-health-threats/pandemic-influenza (consultado el 10 de agosto de 2023).
54. Agencia Europea de Medicamentos (EMA). Medicamentos antivirales para la gripe pandémica. Disponible en línea: https://www.ema. europa.eu/en/human-regulatory/overview/public-health-threats/ pandemic-influenza/antiviral-medicines-pandemic-influenza (consultado el 10 de agosto de 2023).
55. Pizzorno, A.; Padey, B.; Terrier, O.; Rosa-Calatrava, M. Enfoques de reutilización de fármacos para el tratamiento de la infección viral de la gripe: Reactivación de fármacos antiguos para combatir un enemigo longevo. Front. Immunol. 2019 , 10 , 531. [Google Académico] [CrossRef] [PubMed]
56. Sarker, A.; Gu, Z.; Mao, L.; Ge, Y.; Hou, D.; Fang, J.; Wei, Z.; Wang, Z. Fármacos existentes contra la gripe y perspectivas de tratamiento. Eur. J. Med. Chem. 2022 , 232 , 114189. [Google Académico] [CrossRef] [PubMed]
57. Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Medicamentos antivirales contra la gripe e información relacionada. 2022. Disponible en línea: https://www.fda.gov/drugs/information-drug-class/influenza-flu-antiviral-drugs-and-related-information#:~:text=There%20are%20four%20FDA%2Dapproved,against%20 recently%20circulating%20influenza%20viruses.&text=Two%20 older%20drugs%2C%20amantadine%20(generic,of%20influenza%20 A%20virus%20infection (consultado el 12 de agosto de 2023).
58. Centros para el Control y la Prevención de Enfermedades (CDC). Resistencia a los medicamentos antivirales contra la influenza. Disponible en línea: https://www.cdc.gov/flu/treatment/antiviralresistance.htm (consultado el 10 de agosto de 2023).
59. L ampejo, T. Influenza y resistencia a los antivirales: Panorama general. Eur. J. Clin. Microbiol. Infect. Dis. 2020 , 39 , 1201–1208. [Google Académico] [CrossRef] [PubMed]
60. Agencia Europea de Medicamentos (EMA). Abrysvo. 2023. Disponible en línea: https://www.ema.europa.eu/en/medicines/human/summaries-opinion/abrysvo (consultado el 12 de agosto de 2023).
61. Tin, A. La primera vacuna contra el VRS para proteger a los bebés obtiene el respaldo de un panel de la FDA. CBS News , 2023. Disponible en línea: https://www.cbsnews.com/news/fda-rsv-vaccine-to-protect-infants-pfizer/ (consultado el 12 de agosto de 2023).
62. Organización Mundial de la Salud (OMS). Anexo 2: Directrices sobre la calidad, seguridad y eficacia de las vacunas contra el virus respiratorio sincitial. 2020. Disponible en línea: https://cdn.who. int/media/docs/default-source/biologicals/vaccine-standardization/ respiratory-syncytial-virus-(rsv)-vaccines/annex_2_rsv_vaccines_ trs_1024.pdf?sfvrsn=5d7aefa7_3&download=true (consultado el 13 de agosto de 2023).
63. PATH. Resumen de la vacuna y mAb contra el VRS. 2023. Disponible en línea: https://www.path.org/resources/rsv-vaccine-and-mabsnapshot/ (consultado el 13 de agosto de 2023).
64. Smyk, JM; Szydłowska, N.; Szulc, W.; Majewska, A. Evolución de los virus de la influenza: resistencia a los medicamentos, opciones de tratamiento y perspectivas. Int. J. Mol. Ciencia. 2022 , 23 , 12244. [Google Scholar] [CrossRef] [PubMed]
65. Hernández-González, DG; Rodríguez-Muñoz, L.; Solórzano-Santos, F. Impacto del uso de PCR multiplex en el diagnóstico etiológico y el tratamiento de infecciones respiratorias agudas en un hospital privado del norte del país. Gac. Med. Mex. 2021 , 157 , 160–165. [Google Académico] [CrossRef]
66. Havers, FP; Hicks, LA; Chung, JR; Gaglani, M.; Murthy, K.; Zimmerman, RK; Jackson, LA; Petrie, JG; McLean, HQ; Nowalk, MP; et al. Prescripción de antibióticos ambulatorios para infecciones respiratorias agudas durante las temporadas de influenza. JAMA Netw. Open 2018 , 1 , e180243. [Google Académico] [CrossRef]
67. Tonkin-Crine, S.; Yardley, L.; Little, P. Prescripción de antibióticos para infecciones respiratorias agudas en atención primaria: Revisión sistemática y metaetnografía. J. Antimicrob. Chemother. 2011 , 66 , 2215–2223. [Google Académico] [CrossRef]
68. Obolski, U.; Kassem, E.; Na’amnih, W.; Tannous, S.; Kagan, V.; Muhsen, K. Tratamiento antibiótico innecesario en niños hospitalizados con bronquiolitis por virus respiratorio sincitial (VRS): Factores de riesgo y patrones de prescripción. J. Glob. Antimicrob. Resist. 2021 , 27 , 303–308. [Google Académico] [CrossRef]
69. Allen, KE; Beekmann, SE; Polgreen, P.; Poser, S.; St. Pierre, J.; Santibañez, S.; Gerber, SI; Kim, L. Encuesta sobre pruebas diagnósticas del virus respiratorio sincitial (VRS) en adultos: Prácticas de los médicos especialistas en enfermedades infecciosas e implicaciones para las estimaciones de la carga. Diagn. Microbiol. Infect. Dis. 2018 , 92 , 206–209. [Google Académico] [CrossRef] [PubMed]
70. Egilmezer, E.; Walker, G. J.; Bakthavathsalam, P.; Peterson, J. R.; Gooding, J. J.; Rawlinson, W.; Stelzer-Braid, S. Revisión sistemática del impacto de las pruebas de influenza en el punto de atención en los resultados de pacientes con infección respiratoria aguda. Rev. Med. Virol. 2018 , 28 , e1995. [Google Académico] [CrossRef] [PubMed]
71. Organización Mundial de la Salud. Panel de la OMS sobre el coronavirus (COVID-19). 2023. Disponible en línea: https://data.who.int/dashboards/covid19/deaths?n=c (consultado el 22 de noviembre de 2023).
72. Gamba, MR; LeBlanc, TT; Vázquez, D.; dos Santos, EP; Franco, OH.
Capacidad de preparación y respuesta ante emergencias sanitarias en América Latina y el Caribe. Am. J. Public Health 2022 , 112 , S572. [Google Académico] [CrossRef] [PubMed]
73. Nuestro Mundo en Datos. Muertes por coronavirus (COVID-19): Casos confirmados acumulados de COVID-19 por millón de personas. 2023. Disponible en línea: https://ourworldindata.org/covid-deaths#explore-the-global-data-on-confirmed-covid-19-deaths (consultado el 24 de noviembre de 2023).
74. Organización para la Cooperación y el Desarrollo Económicos; Banco Mundial. Panorama de la Salud: América Latina y el Caribe ; Publicaciones de la OCDE: París, Francia, 2023. [Google Académico] [CrossRef]
75. Organización Panamericana de la Salud (OPS). Actualización Epidemiológica Quincenal de la OPS sobre la COVID-19 — 31 de mayo de 2023 ; OPS: Washington, D.C., EE. UU., 2023; Disponible en línea: https://www.paho.org/es/documentos/actualizacion-epidemiologica-quincenal-de-la-ops-sobre-la-covid-19-31-de-mayo-de-2023 (consultado el 13 de agosto de 2023).
76. Nuestro Mundo en Datos. Pruebas acumuladas de COVID-19 por cada 1000 personas. 2023. Disponible en línea: https://ourworldindata.org/covid-deaths#explore-the-global-data-on-confirmed-covid-19-deaths (consultado el 24 de noviembre de 2023).
77. Nuestro Mundo en Datos. Pruebas realizadas por caso confirmado de COVID-19, promedio móvil de 7 días. 2023. Disponible en línea: https://ourworldindata.org/coronavirus-testing (consultado el 24 de noviembre de 2023).
78. Nuestro Mundo en Datos. Exceso de Mortalidad: Muertes acumuladas por todas las causas en comparación con la proyección de años anteriores. 2023. Disponible en línea: https://ourworldindata.org/ covid-deaths#explore-the-global-data-on-confirmed-covid-19-deaths (consultado el 24 de noviembre de 2023).
79. Nuestro Mundo en Datos. Conjunto de Datos de Pruebas de COVID-19 de Nuestro Mundo en Datos: Información de Origen País por País. 2023. Disponible en línea: https://ourworldindata.org/coronavirus-testing (consultado el 24 de noviembre de 2023).
80. García, J.; Torres, C.; Castro, A.; Rousset Yepez, B. El registro de muertes asociadas al COVID-19: ¿quiénes están incluidos en las estadísticas? ALAP (Asociación Latinoamericana de Población): Río de Janeiro, Brasil, 2021; Disponible en línea: https://archined.ined.fr/ view/AX3H6p8-Qw0312HDrH9d (consultado el 13 de agosto de 2023).
81. Binstock, G.; Natán, M.; Pardo, I.; Peláez, E. Desafíos para el avance de la Agenda 2030 en América Latina y el Caribe en el marco de la COVID-19 ; ALAP (Asociación Latinoamericana de Población): Río de Janeiro, Brasil, 2021; Disponible en línea: https://lac.unfpa.org/
es/publications/desaf%C3%ADos-para-el-avance-de-la-agenda-2030en-am%C3%A9rica-latina-y-el-caribe-en-el-marco-de (consultado el 13 de agosto de 2023).
82. Organización Panamericana de la Salud (OPS). Directriz Internacional para la Certificación y Clasificación (Codificación) de COVID-19 como Causa de Muerte, 20 de abril de 2020. (Traducido del español: Orientación Internacional Para La Certificación y Clasificación (Codificación) del COVID-19 Como Causa de Muerte, 20 de Abril de 2020) ; OPS: Washington, DC, EE.UU., 2020; Disponible en línea: https://iris. paho.org/handle/10665.2/52848 (consultado el 13 de agosto de 2023).
83. Instituto Nacional de Salud (INS) Colombia. ABC del Registro de Mortalidad por COVID en Colombia ; Instituto Nacional de Salud (INS) Colombia: Bogotá, Colombia, 2023. Disponible en línea: https:// www.ins.gov.co/BibliotecaDigital/abece-Registro-mortalidad-Covid. pdf (consultado el 12 de agosto de 2023).
84. Ministerio de Salud Argentina. Enfermedad COVID-19. Guía para la Codificación de Causas de Muerte. (Traducido del español: Enfermedad Por COVID-19 Guía para la Codificación de Las Causas de Muerte) ; Ministerio de Salud Argentina: Buenos Aires, Argentina, 2020. Disponible en línea: https://www.argentina.gob.ar/sites/default/files/certifdef_covid19_cace_2.pdf (consultado el 13 de agosto de 2023).
85. Secretaría de Salud México. Guía Estandarizada para la Vigilancia Epidemiológica y de Laboratorio de Enfermedades Respiratorias Virales (Lineamiento Estandarizado Para La Vigilancia Epidemiológica y Por Laboratorio de La Enfermedad Respiratoria Viral) ; Secretaría de Salud de México: Ciudad de México, México, 2022. Disponible en línea: https:// www.gob.mx/cms/uploads/attachment/file/715444/Lineamiento_VE_y_ Lab_Enf_Viral_05042022.pdf (consultado el 13 de agosto de 2023).
86. Consejo Asesor COVID-19 Ministerio de Salud de Chile. Vigilancia, Registro y Certificación de Defunciones Durante la Pandemia de COVID-19; Consejo Asesor COVID-19 Ministerio de Salud de Chile: Santiago, Chile, 2020; Disponible en línea: https://ciperchile. cl/wp-content/uploads/Minuta-Vigilancia-y-registro-de-defunciones-durante-la-pandemia-de-COVID-19_12-Junio.pdf (consultado el 13 de agosto de 2023).
87. Registro Civil de Brasil. Defunciones con Sospecha o Confirmación de COVID-19 por Sexo y Edad (Traducido del portugués: Óbitos com Suspeita ou Confirmação de COVID-19 por Sexo e Faixa etária). Portal de Transparencia Brasil. 2020. Disponible en línea: https://transparencia.registrocivil.org.br/especial-covid (consultado el 13 de agosto de 2023).
88. Bonacina, F.; Boëlle, P.-Y.; Colizza, V.; Lopez, O.; Thomas, M.; Poletto, C. Patrones globales e impulsores de la disminución de la influenza durante la pandemia de COVID-19. Int. J. Infect. Dis. 2023 , 128 , 132–139. [Google Académico] [CrossRef]
89. Achangwa, C.; Park, H.; Ryu, S.; Lee, M.-S. Impacto colateral de las medidas sociales y de salud pública en la actividad viral respiratoria durante la pandemia de COVID-19 2020-2021. Viruses 2022 , 14 , 1071. [Google Académico] [CrossRef] [PubMed]
90. Olsen, SJ; Azziz-Baumgartner, E.; Budd, AP; Brammer, L.; Sullivan, S.; Pineda, RF; Cohen, C.; Fry, AM. Disminución de la actividad de la influenza durante la pandemia de COVID-19: Estados Unidos, Australia, Chile y Sudáfrica, 2020. MMWR Morb. Mortal. Wkly Rep. 2020 , 69 , 1305–1309. [Google Académico] [CrossRef]
91. Chuang, Y.-C.; Lin, K.-P.; Wang, L.-A.; Yeh, T.-K.; Liu, P.-Y. El impacto de la pandemia de COVID-19 en la infección por el virus respiratorio sincitial: una revisión narrativa. Infect. Drug Resist. 2023 , 16 , 661–675. [Google Académico] [CrossRef]
92. Sabeena, S.; Ravishankar, N.; Robin, S. El impacto de la pandemia de COVID-19 en la vigilancia de la influenza: una revisión sistemática y un metaanálisis. Indian J. Public Health 2022 , 66 , 458. [Google Académico] [CrossRef]
93. Bermúdez Barrezueta, L.; Gutiérrez Zamorano, M.; López-Casillas, P.; Brezmes-Raposo, M.; Sanz Fernández, I.; Pino Vázquez, MdlA Influencia de la pandemia de COVID-19 en la epidemiología de la bronquiolitis aguda. Enferm. Infeccioso. Microbiol. Clínico. 2023 , 41 , 348–351. [Google Scholar] [CrossRef]
94. Nickbakhsh, S.; Mair, C.; Matthews, L.; Reeve, R.; Johnson, PCD; Thorburn, F.; von Wissmann, B.; Reynolds, A.; McMenamin, J.; Gunson, RN; et al. Las interacciones virus-virus impactan la dinámica poblacional de la influenza y el resfriado común. Proc. Natl. Acad. Sci. USA 2019 , 116 , 27142–27150. [Google Académico] [CrossRef] [PubMed]
95. Savy, V.; Ciapponi, A.; Bardach, A.; Glujovsky, D.; Aruj, P.; Mazzoni, A.; Gibbons, L.; Ortega-Barría, E.; Colindres, RE Carga de la influenza en América Latina y el Caribe: una revisión sistemática y un metanálisis. Gripe Otros Respiración. Virus 2013 , 7 , 1017–1032. [Google Scholar] [CrossRef] [PubMed]
96. Ali, A.; Lopardo, G.; Scarpellini, B.; Stein, RT; Ribeiro, D. Revisión sistemática sobre la epidemiología del virus respiratorio sincitial en adultos y ancianos en Latinoamérica. Int. J. Infect. Dis. 2020 , 90 , 170–180. [Google Académico] [CrossRef] [PubMed]
97. Bardach, A.; Rey-Ares, L.; Cafferata, ML; Cormick, G.; Romano, M.; Ruvinsky, S.; Savy, V. Revisión sistemática y metaanálisis de la epidemiología de la infección por el virus respiratorio sincitial en Latinoamérica. Rev. Med. Virol. 2014 , 24 , 76–89. [Google Académico] [CrossRef] [PubMed]
98. Gupta, S.; Gupta, T.; Gupta, N. Vigilancia global de virus respi-
ratorios: Fortalezas, deficiencias y camino a seguir. Int. J. Infect. Dis. 2022 , 121 , 184–189. [Google Académico] [CrossRef] [PubMed]
99. Organización Mundial de la Salud (OMS). Historia de la vacuna contra la gripe. Disponible en línea: https://www.who.int/newsroom/spotlight/history-of-vaccination/history-of-influenza-vaccination (consultado el 12 de agosto de 2023).
100.Organización Mundial de la Salud (OMS). Sistema Mundial de Vigilancia y Respuesta a la Gripe (SMVGI). 2023. Disponible en línea: https://www.who.int/ initiatives/global-influenza-surveillance-and-response-system (consultado el 13 de agosto de 2023).
101.Barberis, I.; Martini, M.; Iavarone, F.; Orsi, A. Vacunas disponibles contra la gripe: Estrategias de inmunización, historia y nuevas herramientas para combatir la enfermedad. J. Prev. Med. Hyg. 2016 , 57 , E41–E46. [Google Académico] [PubMed]
102.Pebody, R.; Moyes, J.; Hirve, S.; Campbell, H.; Jackson, S.; Moen, A.; Nair, H.; Simões, EAF; Smith, PG; Wairagkar, N.; et al. Enfoques para el uso de la Plataforma de Vigilancia del Virus Respiratorio Sincitial de la OMS para estimar la carga de enfermedad. Influenza y otros virus respiratorios 2020 , 14 , 615–621. [Google Académico] [CrossRef]
103.Organización Mundial de la Salud (OMS). Programa Mundial de la Gripe - La OMS lanza la Fase II del Programa Mundial de Vigilancia del Virus Respiratorio Sincitial ; OMS: Ginebra, Suiza, 2022; Disponible en línea: https://www.who. int/teams/global-influenza-programme/global-respiratory-syncytial-virus-surveillance#:~:text=WHO%20launches%20phase%20II%20of%20the%20Global%20 Respiratory%20Syncytial%20Virus%20Surveillance&text=(d)%20generate%20 a%20robust%20understanding,representation%20in%20all%20WHO%20Regions (consultado el 13 de agosto de 2023).
104.Organización Panamericana de la Salud (OPS). Influenza y otros virus respiratorios: Vigilancia en las Américas 2021 ; OPS: Washington, D.C., EE. UU., 2022; Disponible en línea: https://iris.paho.org/bitstream/handle/10665.2/56544/9789275124994_eng.pdf?sequence=3&isAllowed=y (consultado el 13 de agosto de 2023).
105.Broor, S.; Campbell, H.; Hirve, S.; Hague, S.; Jackson, S.; Moen, A.; Nair, H.; Palekar, R.; Rajatonirina, S.; Smith, PG; et al. Aprovechamiento del Sistema Mundial de Vigilancia y Respuesta a la Gripe para la Vigilancia Mundial del Virus Respiratorio Sincitial: Oportunidades y Desafíos. Gripe y Otros Virus Respiratorios 2020 , 14 , 622–629. [Google Académico] [CrossRef]
106.Sah, R.; Zaman, K.; Mohanty, A.; Al-Ahdal, T.; Awad, H.; Padhi, BK; Bhargava, A. Virus respiratorio sincitial con COVID-19 en curso: ¿Es una amenaza emergente? Ann. Med. Surg. 2023 , 85 , 67–70. [Google Académico] [CrossRef]
107.Organización Panamericana de la Salud (OPS). Página principal de Flu-
Net 2010-2023. 2023. Disponible en línea: https://ais.paho.org/phip/viz/ ed_flu.asp (consultado el 13 de agosto de 2023).
108.Instituto de Salud, Métricas y Evaluación (IHME). Carga mundial de enfermedades: Infecciones respiratorias. 2019. Disponible en línea: https://vizhub. healthdata.org/gbd-results/ (consultado el 12 de agosto de 2023).
109.Organización Panamericana de la Salud (OPS) FluNet. Porcentaje acumulado de positividad para influenza, VSR y SARS-CoV-2, por país, 2022. 2023. Disponible en línea: https://ais.paho.org/phip/viz/ed_flu.asp (consultado el 13 de agosto de 2023).
110.Dowdy, D.; D’Souza, G. Pruebas de COVID-19: Entendiendo el “Porcentaje de Positivos”. Disponible en línea: https://publichealth.jhu.edu/2020/ covid-19-testing-understanding-the-percent-positive#:~:text=The%20percent%20positive%20will%20be,haven’t%20been%20tested%20yet (consultado el 12 de agosto de 2023).
111. Centros para el Control y la Prevención de Enfermedades (CDC). Acerca del Síndrome Inflamatorio Multisistémico (SIM). 2023. Disponible en línea: https://www.cdc.gov/mis/about.html (consultado el 10 de agosto de 2023).
112.Sakhamuri, SM; Jankie, S.; Pinto Pereira, LM. Llamamiento a los países de América Latina y el Caribe a reconocer la discapacidad derivada de la COVID persistente. Lancet Reg. Health-Am. 2022 , 15 , 100362. [Google Académico] [CrossRef] [PubMed]
113.Alvarez-Moreno, CA; Pineda, J.; Bareño, A.; Espitia, R.; Rengifo, P. COVID-19 persistente en Latinoamérica: ¿Baja prevalencia, alta resiliencia o baja vigilancia y dificultades para acceder a la atención médica? Travel Med. Infect. Dis. 2023 , 51 , 102492. [Google Académico] [CrossRef]
114. Rodríguez-Morales, AJ; López-Echeverri, MC; Pérez-Raga, MF; Quintero-Romero, V.; Valencia-Gallego, V.; Galindo-Herrera, N.; López-Alzate, S.; Sánchez-Vinasco, JD; Gutiérrez-Vargas, JJ; Mayta-Tristán, P.; et al. Los desafíos globales del largo COVID-19 en adultos y niños. Medicina de viaje. Infectar. Dis. 2023 , 54 , 102606. [Google Scholar] [CrossRef] [PubMed]
115.Grupo Banco Mundial, Programa de las Naciones Unidas para el Desarrollo (PNUD). COVID prolongada: Los efectos extendidos de la pandemia en los mercados laborales de América Latina y el Caribe. 2022. Disponible en línea: https://documents1.worldbank.org/curated/ en/099900007072289098/pdf/P1758390cd83e707b0845f0450936b8882b. pdf (consultado el 13 de agosto de 2023).
116.Angarita-Fonseca, A.; Torres-Castro, R.; Benavides-Córdoba, V.; Chero, S.; Morales-Satán, M.; Hernández-López, B.; Salazar-Pérez, R.; Larrateguy, S.; Sanchez-Ramirez, DC Explorando la condición de COVID prolongada en América Latina: su impacto en las actividades de los pacientes y el uso de la atención médica asociada. Frente. Medicina. 2023 , 10 , 1168628. [Google Scholar] [CrossRef] [PubMed]
117. Baraldi, E.; Bonadies, L.; Manzoni, P. Evidencia sobre la relación entre la infección por el virus respiratorio sincitial en la infancia y la enfermedad pulmonar obstructiva crónica. Am. J. Perinatol. 2020 , 37 , S26–S30. [Google Académico] [CrossRef]
118.Verwey, C.; Nunes, MC; Dangor, Z.; Madhi, SA. Secuelas de la función pulmonar tras la infección del tracto respiratorio inferior por el virus respiratorio sincitial en niños: una revisión sistemática. Pediatr. Pulmonol. 2020 , 55 , 1567–1583. [Google Académico] [CrossRef]
119.Respuesta del Banco Mundial a la COVID-19 (coronavirus): El Banco Mundial en América Latina y el Caribe. Disponible en línea: https://www. worldbank.org/en/region/lac/coronavirus (consultado el 13 de agosto de 2023).
120.Servicio de Investigación del Congreso. América Latina y el Caribe: Impacto de la COVID-19 ; Servicio de Investigación del Congreso: Washington, D.C., EE. UU., 2022. Disponible en línea: https://sgp.fas.org/crs/row/IF11581. pdf (consultado el 10 de agosto de 2023).
121.Organización para la Cooperación y el Desarrollo Económicos (OCDE). Respuestas políticas de la OCDE al coronavirus (COVID-19) COVID-19 en América Latina y el Caribe: Implicaciones socioeconómicas regionales y prioridades de política ; OCDE: París, Francia, 2020; Disponible en línea: https://www.oecd.org/coronavirus/policy-responses/covid-19-in-latin-america-and-the-caribbean-regional-socio-economic-implications-and-policy-priorities-93a64fde/ (consultado el 13 de agosto de 2023).
122.Comisión Económica para América Latina y el Caribe (CEPAL). Impactos sociodemográficos de la pandemia de COVID-19 en América Latina y el Caribe ; CEPAL: Santiago de Chile, 2022; Disponible en línea: https://www.cepal.org/en/publications/47923-sociodemographic-impacts-covid-19-pandemic-latin-america-and-caribbean (consultado el 13 de agosto de 2023).
123.Mosegui, GBG; Antoñanzas, F.; de Mello Vianna, CM Costo de la pérdida de productividad por infecciones respiratorias agudas en América del Sur. Rev. Panamá. De Salud Pública 2023 , 47 , 1. [Google Scholar] [CrossRef]
124.Comisión Económica para América Latina y el Caribe (CEPAL). Evaluación Preliminar del Impacto de la Influenza H1N1-Documento Desarrollado por el Equipo de CEPAL-OPS-OMS, a Solicitud y con el Apoyo del Gobierno de México Disponible en línea: https://www.cepal.org/pt-br/node/19750 (consultado el 13 de agosto de 2023).
125. Sachs, JD; Karim, SSA; Aknin, L.; Allen, J.; Brosbol, K.; Colombo, F.; Barrón, GC; Espinosa, MF; Gaspar, V.; Gaviria, A.; et al. La Comisión Lancet sobre lecciones para el futuro de la pandemia de COVID-19. Lanceta 2022 , 400 , 1224–1280. [Google Scholar] [CrossRef] [PubMed]