htps://shkola.in.ua/3289






































































































1.Закінчіть
пластичність, твердість, високі
1.
2.
3.
- 63
- 59
- 37
4. Цинк - 17
5. Сталь - 7


різні забруднювачі (адсорбувати).
Галузі застосування: медицина (при отруєннях, розладах травлення), очищення води,
повітря та газів, харчова промисловість, косметологія, фармацевтика.
Використання в повсякденному житті: таблетки при отруєннях та розладах шлунку, фільтри для води, маски для обличчя, дезодоранти.
Речовини зі схожими властивостями: цеоліти, силікагель,
гази та деякі мікроорганізми, але на відміну

сполучення, розкладу, заміщення, обміну.
реакції це речовини, що утворюються після реакції.
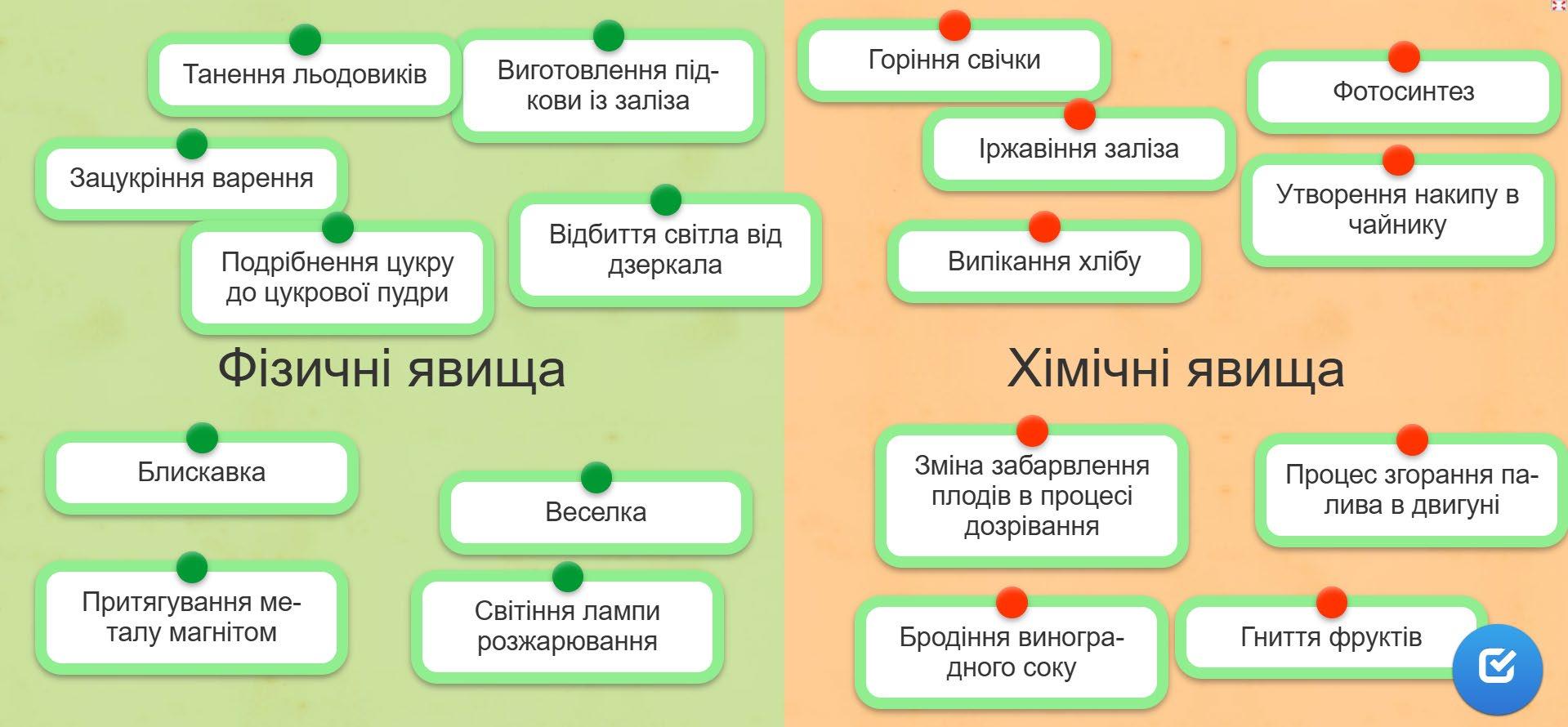
2. Які зміни відбуваються під час фізичних явищ?
Змінюється тільки форма чи агрегатний стан, склад речовини не змінюється.
Які зміни відбуваються під час хімічних явищ?
Утворюються нові речовини з новими властивостями.
Як фізичні явища можуть супроводжувати хімічні?
Під час реакції може змінюватися колір, виділятися газ, тепло, світло чи запах.
Як визначити реактанти та продукти реакції
Реактанти пишуть зліва від стрілки,
Що таке коефіцієнт?
Це число перед формулою речовини
Що таке хімічне рівняння? Це
6. Обговоріть вислів: «Наука в ліс
Для мене це значить: наука дає перевірені
і
відкинути міфи, щоб обрати правильні дії.
7. Серед наведених схем рівнянь реакцій укажіть реакції, у результаті яких:
1) виділяється газ: а), в).
2) утворюється нерозчинна речовина (осад): б), г).
Перетворюємо схеми на рівняння (урівнюємо):
а) MgCO₃ → MgO + CO₂↑ (газ CO₂).
б) BaCl₂ + K₂SO₄ → BaSO₄↓ + 2KCl (осад BaSO₄).
в) Zn + 2HCl → ZnCl₂ + H₂↑ (газ H₂).
г) Na₃PO₄ + 3AgNO₃ → Ag₃PO₄↓ + 3NaNO₃ (осад Ag₃PO₄).
Сторінка 21
1. Перейдіть
Правильно: зміна
htps://shkola.in.ua/3289
(фарбування), і хімічною (іржавіння).
2) Усі зміни, які
Це твердження
§3. ПРИНЦИПИ СКЛАДАННЯ
Сторінка 28
1. Закінчіть речення: Бінарні сполуки це сполуки, утворені
та атомні бінарні сполуки утворюють атоми здебільшого неметалічних (або металоїдів) елементів, що зв’язуються ковалентно.
Бінарні йонні сполуки складаються
2. Дайте відповіді на запитання:
Чому бінарні сполуки є електронейтральними? Сума зарядів усіх катіонів і аніонів у формульній
Що таке катіон?
Позитивно заряджений йон.
Що таке аніон?
Негативно заряджений йон.
3. Як атоми перетворюються на йони?
Атом втрачає електрони → катіон; приєднує електрони → аніон.
4. Складіть формули бінарних сполук
a) Na⁺ та O²⁻ → Na₂O (натрій оксид).
б) Al³⁺ та N³⁻ → AlN (алюміній нітрид).
в) Cu⁺ та Cl⁻ → CuCl (купрум(I) хлорид).
г) K⁺ та P³⁻ → K₃P (калій фосфід).
5. Визначте заряди йонів у сполуках:
NaBr → Na⁺, Br⁻; CaCl₂ → Ca²⁺, Cl⁻; Mg₃N₂ → Mg²⁺, N³⁻; AlP → Al³⁺, P³⁻; K₂S → K⁺, S²⁻; LiF → Li⁺, F⁻; MgS → Mg²⁺, S²⁻; CaH₂ → Ca²⁺, H⁻.
6. Допоможіть Селені скласти формули (валентності вказані):
S(VI)O(II) → SO₃ (сульфур(VI) оксид, сульфур триоксид).
C(IV)O(II) → CO₂ (карбон(IV) оксид).
H(I)Cl(I) → HCl (гідроген хлорид).
P(III)H(I) → PH₃ (фосфан).
C(IV)S(II) → CS₂ (карбон дисульфід).
N(IV)O(II) → NO₂ (нітроґен(IV) оксид).
7. Складіть формули та назвіть сполуки (катіон + аніон):
Літій + хлорид → LiCl (літій хлорид).
Натрій + сульфід → Na₂S (натрій сульфід).
Магній + карбід → Mg₂C (магній карбід).
Кальцій + силіцид → Ca₂Si (кальцій силіцид).
Алюміній + бромід → AlBr₃ (алюміній бромід).
Ферум(II) + хлорид → FeCl₂ (ферум(II) хлорид).
htps://shkola.in.ua/3289-hdz-khimiia-8-klas-midak.html
Ферум(III) + хлорид → FeCl₃ (ферум(III) хлорид).
Калій + флуорид → KF (калій флуорид)
Купрум(I) + фосфід → Cu₃P (купрум(I) фосфід).
8. Складіть формули бінарних сполук, використовуючи схеми. Підкресліть
сполуки.
(Позначу йонні словом [йонна]; бінарні та поняття катіон/аніон з підручника.
а) Ca з H, S, F, N, Cl, O: CaH₂ [йонна], CaS [йонна], CaF₂ [йонна], Ca₃N₂ [йонна], CaCl₂ [йонна], CaO [йонна].
б) Na з H, S, F, N, Cl, O: NaH [йонна], Na₂S [йонна], NaF [йонна], Na₃N [йонна], NaCl [йонна], Na₂O [йонна].
в) Al з H, S, F, N, Cl, O: AlH₃ (ковалентна, не йонна), Al₂S₃ [йонна], AlF₃ [йонна], AlN [йонна], AlCl₃ [йонна], Al₂O₃ [йонна].
г) C(IV) з H, S, F, N, Cl, O: CH₄, CS₂, CF₄, C₃N₄, CCl₄, CO₂ усі ковалентні (не йонні).
ґ) O з H, F, P(V), N(IV), S(VI): H₂O, OF₂, P₂O₅ (або P₄O₁₀), NO₂, SO₃ ковалентні (не йонні).
д) O з Ba, Na, K, Mg, Cu(II), Fe(III): BaO [йонна], Na₂O [йонна], K₂O [йонна], MgO [йонна], CuO [йонна], Fe₂O₃ [йонна]. (Йонні сполуки утворюються з катіонів і
дорівнює нулю).
9. 1) Заповніть таблицю:
Символи елементів Порядкові
Na, Cl Na (11), Cl (17) Na⁺, Cl⁻ NaCl
2) Приклади використання в побуті:
харчова сіль;
продуктів;
приготування розчинів для полоскання горла. 3) Галузі застосування:
O₃, Cl₂, SO₂, HCl, N₂, H₂S, H₂O
Йон (аніон):
O²⁻, S²⁻, Cl⁻, C⁴⁻, N³⁻
Йон (катіон):
Al³⁺, Au⁺, Ca²⁺, Ba²⁺, N³⁺
https://cutt.ly/4rEUUAA2
Ось правильні пари «формула назва»:
CaO кальцій оксид
Al₂O₃ алюміній оксид
CaS кальцій сульфід
AlN алюміній нітрид
AlCl₃ алюміній хлорид
NaCl натрій хлорид
Na₃N натрій нітрид
Ca₃N₂ кальцій нітрид
Al₂S₃ алюміній сульфід
Na₂O натрій оксид
Na₂S натрій сульфід
2. Дайте відповіді на запитання:
Як обчислити відносну атомну масу елемента?
Ar беруть із Періодичної таблиці; це відношення mₐ(Е) до 1 а.о.м.
Як обчислити масу атома елемента?
mₐ(Е) = Ar(Е) · 1 а.о.м. (1 а.о.м. ≈ 1,66057·10⁻²⁷ кг); приклад розрахунку показано для Fe.
Як обчислити відносну молекулярну (формульну) масу речовини?
Mᵣ = сума Ar усіх елементів у формулі з урахуванням індексів.
Як обчислити масу молекули (формульної одиниці) речовини?
m(молекули) = Mᵣ · 1 а.о.м. (для формульної одиниці аналогічно).
3. Поміркуйте, для чого це знати (коротко): щоб рахувати кількісний склад речовин,
розрахунки
4. Використовуючи Періодичну
а) відшукайте
8, 11, 15, 24, 32, 44. Запишіть
O (Оксиґен) 15,999; Na (Натрій) 22,990; P (Фосфор) 30,974; Cr (Хром) 51,996; Ge (Ґерманій) 72,63; Ru (Рутеній) 101,07.
б) запишіть назви хімічних
Si, K, N, Al, Mn. Для кожного елемента вкажіть
Si Силіцій 28,084; K
39,098; N
14,006; Al Алюміній 26,982; Mn Манґан 54,938.
5. Відшукайте в Періодичній таблиці: а)
Алюміній (Al), Aᵣ ≈ 26,98 ≈ 27. б) елемент, A
Сульфур (S), Aᵣ ≈ 32,06 = Mᵣ(O₂). в) елемент, A
(Si), Aᵣ ≈ 28,084 = Mᵣ(CO).
6.
Mᵣ(C₆H₁₂O₆) = Aᵣ(C)·6 + Aᵣ(H)·12 + Aᵣ(O)·6 = 12,0096·6 + 1,0078·12 + 15,999·6 = 72,0576 + 12,0936 + 95,994 ≈ 180,15.
7. Обчисліть
– C₈H₁₂: 8·12,0096 + 12·1,0078 = 96,0768 + 12,0936 = 108,17.
– SO₃: 32,06 + 3·15,999 = 32,06 + 47,997 = 80,06.
– NO₂: 14,006 + 2·15,999 = 14,006 + 31,998 = 46,00.
– HCl: 1,0078 + 35,45 = 36,46.
htps://shkola.in.ua/3289-hdz-khimiia-8-klas-midak.html
SF₆: 32,06 + 6·18,998 = 32,06 + 113,988 = 146,05.
H₂SO₄: 2·1,0078 + 32,06 + 4·15,999 = 2,0156 + 32,06 + 63,996 = 98,07.
Примітка: використовував Aᵣ із Періодичної таблиці в підручнику. 8. Обчисліть відносні молекулярні (формульні) маси простих речовин: водню, кисню, міді, графіту (вуглецю). Пригадайте, які з них складаються
які мають атомну будову.
H₂ (двоатомна): Mᵣ = 2·1,008 ≈ 2,02.
O₂ (двоатомна): Mᵣ = 2·16,00 ≈ 32,00.
Cu (атомна): Mᵣ ≈ 63,55.
C (графіт, атомна): Mᵣ ≈ 12,01.
9. Елементи O, S, Se утворюють H₂E. Розмістіть формули
обчислювати Mᵣ?
Порядок: H₂Se (≈81,99) > H₂S (≈34,08) > H₂O (≈18,02).
Висновок: обчислювати не обов’язково
формула однакова (H₂E).
10. Яке твердження правильне для CO₂ і C₂H₄O?
Mᵣ(CO₂) = 12,01 + 2·16,00 ≈ 44,01; Mᵣ(C₂H₄O) = 2·12,01 + 4·1,008 + 16,00 ≈ 44,05.
Правильно: Mᵣ(CO₂) < Mᵣ(C₂H₄O).
11. Обчисліть масу (г, кг) молекули амоніаку, метану.
Aᵣ
Амоніак NH₃: Mᵣ≈17,03 ⇒ m≈17,03·1,66057·10⁻²⁷ кг ≈ 2,83·10⁻²⁶ кг (≈ 2,83·10⁻²³ г).
Метан CH₄: Mᵣ≈16,04 ⇒ m≈16,04·1,66057·10⁻²⁷ кг ≈ 2,66·10⁻²⁶ кг (≈ 2,66·10⁻²³ г).
12*. Цукроза має Mᵣ=342; у молекулі 12 атомів C і 22 атоми H. Скільки атомів O?
12·12,01 + 22·1,008 + x·16 ≈ 342 ⇒ x≈11. (Отже, формула C₁₂H₂₂O₁₁.)
13*. Вітамін C має Mᵣ=176;
+
TeO₃: 48/(127.60+48) ≈ 27.3%;
CrO₃: 48/(52.00+48) = 48.0%;
SO₃: 48/(32.06+48) ≈ 60.0%.
Порядок зростання: WO₃ < XeO₃ < TeO₃ < CrO₃ < SO₃.
6. Установіть відповідність між речовиною
(w(Mn), %):
MnO₂ → 54.94/(54.94+32) ≈ 63.2 → Г
Mn₂O₇ → 109.88/(109.88+112) ≈ 49.5 → В
K₂MnO₄ → 54.94/(78.2+54.94+64) ≈ 27.9 → А
KMnO₄ → 54.94/(39.10+54.94+64) ≈ 34.8 → Д
Відповідь: 1–Г, 2–В, 3–А, 4–Д.
7. Обчисліть масову частку Нітроґену у
а) NaNO₃:
w(N)=14/(23+14+48) = 16.47%.
б) Ca(NO₃)₂:
w(N)=28/(40.08+28+96) ≈ 17.06%.
в) KNO₃: w(N)=14/(39.10+14+48) ≈ 13.85%.
г) NH₄NO₃:
w(N)=28/(28+4+48) = 35.00%.
Найбільш ефективне (найбільше N): амонійна селітра NH₄NO₃.
8*. Знайдіть
Пектораль: проба 958 ⇒ 95,8% Au.
����Au = 1148 г × 0,958 ≈ 1099,78 г.
Монета: маса 34,56 г, проба 900 ⇒ 90% Au. ����Au, монети = 34,56 г × 0,90 = 31,104
���� = 1099,78 31,104 ≈ 35,36 Відповідь: у
1. Закінчіть речення:
всієї речовини. Маса
2) ���� ����4 ��������2 → ���� (���� ) = 28 64 ≈ 43,75% → А
3) ����3 ����4 → ���� (����) = 28 32 ≈ 87,50% → Г
4) ������������3 → ���� (����) = 14 63 ≈ 0,222 → Д
Відповідь: 1–В, 2–А, 3–Г, 4–Д.
7. Запишіть формули речовин за зменшенням у них масової частки Хлору: KClO₃, NaClO, Ba(ClO₄)₂, CaOCl₂.
Масова частка Хлору зменшується в такій послідовності: CaOCl₂ → NaClO → KClO₃ → Ba(ClO₄)₂.
8. Обчисліть масову частку (%) Феруму в мінералах: а) гематит Fe2O3
(���� ) =0,13078 ⋅ 200 кг ≈ 26,16 кг
(���� ) =0,26609 ⋅ 200 кг ≈ 53,22 кг
забезпечення надходження Йоду.
����(солі у 1/4 ложки) =1,5 г
����(I у 1/4 ложки) = 65 мкг
Значить, у 1 ложці:
����(I у 1 ложці) = 65 ⋅ 4= 260 мкг
Для добової норми 150 мкг Йоду:
����(солі) = 150 260 ⋅ 6=3,46 г
Отже, дитині потрібно спожити приблизно 3,5 г йодованої солі на добу.
Сторінка 52
1. Заповніть пропущені в таблиці
речовини: P₂O₃.
1.
2.
43% б) 57% в) 12% г) 28%
Відповідь: а) 43%.
Відносна
а) 65 б) 37 в) 83 г) 51
���� (Na3 N) =3 ⋅ 23 + 14 = 83
Відповідь: в) 83.
Співвідношення мас
а) 7:3 б) 3:8 в) 4:8 г) 3:7
����(C): ����(O) = 12: 32 =3:8
Відповідь: б) 3:8.
Сторінка 64
1. Закінчіть речення:
(атомів, молекул, йонів) міститься в речовині.
Кількість речовини вимірюють у молях.
Стала Авогадро це кількість частинок у одному молі речовини. �������� =6,022 ⋅ 1023 частинок/моль
Одиниця вимірювання кількості речовини 1 моль.
2. Дайте відповіді на запитання: Як обчислити кількість речовини за
3. Поміркуйте: Кількість
Г 4,816 ⋅ 1023 Д 4,816 ⋅ 1024 ���� = ����⋅ 2��������
����(
аніонів) =0,1+0,2=0,3
Суміш 2: ����(BaO) =0,2, ����(K 2O ) =0,1
����(
катіонів) =0,2+2 ⋅ 0,1=0,4
����(
аніонів) =0,2+0,1=0,3
Висновок (а): в
б) �������� ��������3 (�������� 3+ ,3�������� ); �������� ��������2 (�������� 2+ ,2�������� )
Суміш 1: ����(AlBr3 ) =0,1, ����(CaBr2 ) =0,3
����(катіонів) =0,1+0,3=0,4
����(аніонів) =3 ⋅ 0,1+2 ⋅ 0,3=0,9
Суміш 2: ����(AlBr3 ) =0,2, ����(CaBr2 ) =0,2
����(катіонів) =0,2+0,2=0,4
����(аніонів) =3 ⋅ 0,2+2 ⋅ 0,2=1,0
Висновок (б): в обох сумішах
Сторінка 65
1. Оберіть правильну відповідь: 1) Укажіть формулу
3,01 ⋅ 1024 ; б) 1,204 ⋅ 1023 ;
1. Закінчіть речення: Масу вимірюють у грамах, кілограмах, міліграмах. Молярна маса це маса речовини кількістю 1 моль.
Молярна маса чисельно дорівнює відносній атомній або молекулярній
виражається в г/моль.
2. Дайте відповіді на запитання:
Як обчислити молярну масу речовини?
або за відносною молекулярною масою:
Як позначають молярну масу? У яких одиницях вимірюють?
Позначають M, вимірюють у г/моль або кг/кмоль.
Як обчислити кількість речовини
3. Поміркуйте, для чого потрібно знати
хімічних розрахунків.
4. Завершіть обчислення молярної
(����12
(����12 ����22
5. Обчисліть молярні маси речовин, хімічні
C₆H₈, P₂S₃, Cl₂O₇, NaNO₂, OF₂, K₂MnO₄. ���� (����6 ����8 ) = 12 ⋅ 6+1 ⋅ 8= 80 г/моль ���� (����2 ����3 ) = 31 ⋅ 2+ 32 ⋅ 3= 158 г/моль ���� (���� ����2 ����7 ) = 35,5 ⋅ 2+ 16 ⋅ 7= 183 г/моль ���� (����������������2 ) = 23 + 14 + 16 ⋅ 2= 69 г/моль ���� (��������2 ) = 16 + 19 ⋅ 2= 54 г/моль
(����2 ������������4 ) = 39 ⋅ 2+ 55 + 16 ⋅ 4= 197 г/моль
(��������2 ���� ) =7 ⋅
5) ���� = ���� · ����
Правильна відповідь: г) 3,5, бо масу можна
Кількість речовини кальцій карбонату �������������������� масою 20 г: ���� (������������ ����3 ) = 40 + 12 + 16 ⋅ 3= 100 г/моль
= ���� ���� = 20 100 =0,2 моль
Відповідь: б) 0,2 моль.
Маса магній оксиду кількістю речовини 0,2 моль:
���� (������������ ) = 24 + 16 = 40 г/моль
���� = ����⋅���� =0,2 ⋅ 40 = 8 г
Відповідь: г) 8 г.
2. Проаналізуйте твердження.
І. Моль одиниця вимірювання кількості речовини.
ІІ. Молярна маса кисню становить 16 г/моль.
Відповідь: тільки І правильне, бо для ����2 ���� = 32 г/моль. §10. ВИЗНАЧЕННЯ МАСИ ПРОДУКТУ
Сторінка 76
1. Закінчіть речення: Реактант це речовина, яка
4��������3 +3����2 → 2����2 +6����2 ����
(����2 ���� ) = 6 4 ⋅����(��������3 ) = 6 4 ⋅ 3=4,5 моль
5. Обчисліть кількість речовини (моль) кисню, який необхідний для взаємодії
воднем, щоб одержати воду кількістю речовини 55 моль.
Рівняння: 2����2 + ����2 → 2����2 ����
����(����2 ) = 1 2 ����(����2 ���� ) = 55 2 = 27,5 моль
6. Яка кількість речовини (моль) амоніаку утворюється під час взаємодії
кількістю речовини 4,2 моль з азотом?
Рівняння: ����2 +3����2 → 2��������3 ����(��������3 ) = 2 3 ����(����2 ) = 2 3 ⋅ 4,2=2,8 моль
7. У схемі
(г) сульфуру(VI) оксиду реагує
���� ����2 ����3 +3��������3 → ���� ����2 (��������4 )3 ����
htps://shkola.in.ua/3289-hdz-khimiia-8-klas-midak.html
Рівняння: 2����2 + ����2 → 2����2 ����
����(����2 ���� ) = 144 18 = 8 моль,
����(����2 ) = 1 2 ����(����2 ���� ) = 4 моль
+ ������������ → ���������������� + ������������. Обчисліть масу (г) утвореного
метан масою 100 г.
Збалансовано: ��������4 +4���� ����2 → �������� ����4 +4������������
(��������4 ) = 100 16 =6,25 моль,
(������������ ) =4 ⋅����(��������4 ) =4 ⋅ 6,25 = 25 моль
(������������ ) =1+ 35,5= 36,5 г/моль, ����(������������ ) = ����⋅���� = 25 ⋅ 36,5= 912,5 г 13. Складіть рівняння
(���� ����2 ) = 3,01 ⋅ 1024 2 =1,505 ⋅ 1024 ,
(
����2 (�������� )2 ��������3 → 2������������ + ��������2 + ����2 ����
(���� ����2 (�������� )2 ��������3 ) =2 ⋅ 64 +2 ⋅ (16 +1) + 12 +3 ⋅ 16 = 222 г/моль ����(малахіту) = 333 222 =1,5 моль
����(������������ ) =2 ⋅ 1,5=3,0 моль, ����(��������2 ) =1,5 моль, ����(����2 ���� ) =1,5 моль
����(����2 ���� ) =1,5 ⋅ 18 = 27 г,
(����2 ���� ) =1,5 ⋅ 6,02 ⋅ 1023 =9,03 ⋅ 1023 молекул
що утворюються. ���� ����2 ����3 +3����2 → 2�������� +3����2 ���� ����(���� ����2 ����3 ) = 240000 160 = 1500 моль =1,5 кмоль ����(����2 ) =3 ⋅ 1,5=4,5 кмоль (= 4500 моль) ����(����2 ) = 4500 ⋅ 6,02 ⋅ 1023 =2,709 ⋅ 1027 молекул ����(����2 ���� ) =3 ⋅ 1,5=4,5 кмоль ����(�������� ) =2 ⋅ 1,5=3,0 кмоль, ����(�������� ) =3,0 ⋅ 56 = 168 кг,
(�������� ) = 3000 ⋅ 6,02 ⋅ 1023 =1,806 ⋅ 1027 атомів 22. Обчисліть об’єм (м³) етанолу �������� �������� ��������, який
Збалансовано: ����6 ����12 ����6 → 2����2 ����5 �������� +2��������2 ���� (����6 ����12 ����6 ) = 180 г
��������2 ����5 �������� = 500 ⋅ 46 = 23000 г = 23 кг ρ =0,79 кг/л ⇒ ���� = ���� ρ = 23 0,79 = 29,
Відповідь: 0,029 м3 (приблизно).
Сторінка 79
1. Укажіть кількість речовини
речовини 5 моль за схемою реакції
Баланс: ����2 + ���� ����2 → 2������������ ⇒ 1: 1
����(���� ����2 ) = 5 моль
Відповідь: г) 5 моль. Під час прожарювання
Відповідь: б) 28,8 г.
Відповідь: а) 1,204·10²⁴.
2. Знайдіть і виправте помилки, якщо
хімічними
реакції». Неправильно.
Правильно: кількості й маси обчислюють
«Речовини беруть участь
коефіцієнтам». Правильно.
Сторінка 84
1. Закінчіть речення:
хімічними
реакції.
Відносний
n₍теор₎ = 5 · 2 = 10 (моль)
Фактична кількість: n₍факт₎ = 8,55 (моль)
Відносний вихід:
=
· 100% = 8,55 10 · 100% = 85,5%
4. Під час відновлення цинку
цинк масою 39 г. Обчисліть
Рівняння реакції:
3ZnO + 2Al → 3Zn + Al₂O₃
М(Zn) = 65 г/моль
Теоретична маса:
m₍теор₎ = 0,8 · 65 = 52 г
· 100% = 39 52 · 100% =
Fe + S → FeS М(Fe) = 56 г/моль
( ���� ���� ) = 112 56 =2(моль)
n₍теор₎ = 2 (моль)
n₍факт₎ = 1,7 (моль) ���� = ����факт ����теор
-hdz-
М(Mg) = 24,3 г/моль, М(Mg₃N₂) = 100,9 г/моль
����(��������) = 1200 24,3 = 49,38 моль
����теор (��������3 ���� 2 ) = 49,38 3 = 16,46 моль
����теор = 16,46 · 100,9= 1660 г =1,66 кг ���� = ����факт
· 100% = 900 1660 · 100% = 54,2%
8. Під час термічного розкладу
водень. Обчисліть
реакції: CH₄ → C + 2H₂ ����теор (���� ) = 80 · 12 16 = 60 кг
· 100% = 24 60 · 100% = 40%
кількість речовини (моль)
реакції становить 85\%.
реакції:
H₂ + S → H₂S
����теор (���� 2 ����) =0,5 моль
����факт = η 100% · ����теор = 85 100 ·0,5=0,425 моль
10. Цинк
ZnO + C → Zn + CO.
Обчисліть масу (г) утвореного
65%.
(��������) =0,8 моль ���� (��������) = 65 г/моль
=0,8· 65 = 52 г
= η 100% ·
����факт = η 100% · ����теор = 95 100 ·4,5=4,28 моль 12. Під час взаємодії
відносний вихід продукту реакції становить 80%.
Рівняння реакції:
Fe₂O₃ + 3CO → 2Fe + 3CO₂
���� (�������� ) = 56 г/моль, ���� (���� ���� 2 ���� 3 ) = 160 г/моль
����факт (�������� ) = 112 56 = 2 моль
����теор (�������� ) = ����факт η100% = 2 0,8 =2,5 моль
Зарівнянням2��������утворюєтьсяз1���� ���� 2 ���� 3 , тому
����(���� ���� 2 ���� 3 ) = 2,5 2 =1,25 моль
����(���� ���� 2 ���� 3 ) =1,25 · 160 = 200 г
13. Обчисліть масу (г) кальцій
оксидом масою 16,8 г, якщо
Рівняння реакції: CaO + 3C → CaC₂ + CO M(CaO) = 56 г/моль, M(CaC₂) = 64 г/моль
����(������������ ) = 16,8 56 =0,3 моль
����теор (������������ 2 ) =0,3 моль
����теор =0,3· 64 = 19,2 г
(AlI3 ) = 27 +3 ⋅ 127 = 408 г/моль.
Рівняння: Fe2O3 +3CO → 2Fe +3CO2 .
����теор (Fe) = 0,4 0,80 =0,5 моль.
3 CO
2 Fe = ����(CO) 0,5 ⇒ ����(CO) = 3 2 ⋅ 0,5=0,75 моль.
16. Карбон(IV) оксид кількістю речовини 0,85 моль пропустили над розжареним
вугіллям. Обчисліть масу (г) утвореного карбон(ІІ) оксиду, якщо
продукту реакції становить 95%.
Рівняння: CO2 +C → 2CO.
����теор (CO) =2 ⋅ 0,85 =1,70 моль.
����факт (CO) =0,95 ⋅ 1,70 =1,615 моль.
����(CO) =1,615 ⋅ 28 = 45,22 г (≈ 45,2 г)
17. Обчисліть масу (г) сірки, яку спалили, якщо
сульфур(IV) оксиду становить 3,5 моль. Відносний вихід продукту
70%.
Рівняння: ���� + ���� 2 → �������� 2
����факт (�������� 2 ) =3,5 моль
����теор (�������� 2 ) = 3,5 0,70 = 5 моль
����(����) = ����теор (�������� 2 ) = 5 моль
���� (����) = 32 г/моль
����(����) =5· 32 = 160 г 18. Під час взаємодії водню
виходом продукту реакції
для реакції? Рівняння: ���� 2 +3���� 2 → 2�������� 3 ���� (�������� 3 )
����теор (�������� 3 ) = 10 0,80 = 12,5 моль
����(�������� 4 �������� ) = ����теор (�������� 3 ) = 12,5 моль
����(�������� 4 �������� ) = 12,5· 53,5= 668,75 г
20. Барій одержують
за схемою:
3BaO + 2Al → 3Ba + Al₂O₃.
Обчисліть, яку масу (кг) алюмінію
масою 65,76 кг, якщо відносний
���� (�������� ) = 137 г/моль, ���� (�������� ) = 27 г/моль
����факт (�������� ) = 65 760 137 = 480 моль
����теор (�������� ) = 480 0,8 = 600 моль
Зарівнянням:3
����(�������� ) = 400 · 27 = 10 800 г = 10,8 кг
рівняння реакції
становить 80%. Рівняння: 2
���� (������������ ���� 3 ) = 162,5г/моль
����факт (������������ ���� 3 ) = 650 000 162,5
(���� ���� 2 ) = 5 2 =2,5 кмоль
0,8.
����(�������� ) = 200 · 27 = 5400 г =5,4 кг
����(����) = 300 · 32 = 9600 г =9,6 кг
Сторінка 86
1.
Правильна: ���� = ����практ ����теор · 100%
Правильна: ���� = ����практ ����теор · 100%
Правильна:
����практ = ���� · ����теор 100%
2. Укажіть відносний вихід (%) фреону CF₂Cl₂,
CCl₄ за схемою:
CCl₄ + 2HF → CF₂Cl₂ + 2HCl
Маса CCl₄ = 30,8 г, маса фреону = 11,616 г.
M(CCl₄) = 153,8 г/моль, M(CF₂Cl₂) = 121 г/моль
����(�������� ���� 4 ) = 30,8 153,8 =0,2моль
����теор (�������� 2 ���� ���� 2 ) =0,2· 121 = 24,2г
· 100% = 11,616 24,2 · 100% = 48% 3. Знайдіть і
2)
htps://shkola.in.ua/3289-hdz-khimiia-8-klas-midak.html
5. Укажіть речовини, сума індексів у формулах яких
Суми:
1) ���� ����2 ���� → 3;
2) ��������3 → 4;
3) ������������ ����3 → 4;
4) ��������3 ����2 → 5;
5) ���� ����3 ����→ 4;
6) ��������4 ����3 → 7.
Відповідь: б) 3, 5, 2 (усі мають суму індексів 4).
6. Укажіть кількість речовини (моль) манган(VII) оксиду, яка містить 14 моль
Оксигену: ��������2 ����7 містить 7 атомів ���� у 1 молі сполуки. ���� = 14 7 = 2 моль.
Відповідь: а) 2.
7. Виберіть правильне твердження щодо
Відповідь: в) маса 1 моль речовини.
8. Укажіть число молекул, що міститься в 10 моль азоту:
���� = �������� · ���� =6,02 · 1023 · 10 =6,02 · 1024 .
Відповідь: б) 6,02 · 1024 .
9. Увідповідніть маси та кількість
M(Al₂O₃) = 102 г/моль
а) 25,5 г → n = 25,5 102 = 0,25 моль → 4)
б) 5,1 г → n = 5,1 102= 0,05 моль → 3)
в) 51 г → n = 51 102 = 0,5 моль → 2)
Отже, відповідність: а–4, б–3, в–2.
10. Проаналізуйте твердження.
90%.
���� +2����2 → ��������4 .
����факт (��������4 ) = 28,8 16 =1,8 моль;
����теор (��������4 ) = ����факт 0,9 = 1,8 0,9 = 2 моль; ����(����2 ) =2 ⋅����теор (��������4 ) =2 ⋅ 2= 4 моль.
Відповідь: б) 4.
Сторінка 94
1. Закінчіть речення:
кисень тут не потрібен.
7. Характеристики кисню:
Безбарвний, без запаху і смаку газ.
Молярна маса 32 г/моль.
Легший за повітря.
Підтримує горіння, але сам не горить.
Вміст у повітрі близько 21%.
Блакитний у рідкому стані.
Відкритий Лавуазьє.
8. Знайдіть у фільворді відповіді
1. Закінчіть речення:
витрачається.
перманганату (KMnO₄).
2. Дайте відповіді на запитання:
ректифікації.
У лабораторії для
(KMnO₄), калій хлорат (KClO₃) або
й важчий за повітря.
Наявність кисню доводять тим, що
тліючу скіпку, яка спалахує.
3. Поміркуйте, чому не варто в
4.
1)
2)
3)
4)
KClO₃: M = 39 + 35,5 + 3·16 = 122,5; w(O) = 48 122,5 =0,392 = 39,2%. KNO₃: M = 39 + 14 + 3·16 = 101; w(O) = 48 101 =0,475 = 47,5%.
NaNO₃: M = 23 + 14 + 3·16 = 85; w(O) = 48 85 =0,565 = 56,5%. 6.
= 39 + 55 + 4·16 = 158
w(O) = 64 158 =0,405 = 40,5%.
= 25 · 0,405 = 10,1 г.
= 1000 32 = 31,25 моль.
htps://shkola.in.ua/3289-hdz-
���� = ���� · �������� = 31,25 ·6,02 · 1023 =1,88 · 1025 молекул.
8. Яка кількість речовини (моль) кисню
газу кількістю речовини 3 моль?
Рівняння: 6CO₂ + 6H₂O → C₆H₁₂O₆ + 6O₂.
n(O₂) = n(CO₂) = 3 моль.
9. Обчисліть кількість речовини
Рівняння: 2H₂O₂ → 2H₂O + O₂.
n(H₂O₂) = 2 · n(O₂) = 2 · 0,5 = 1 моль.
10. Обчисліть кількість речовини (моль) кисню,
Рівняння: 2������������ → 2�������� + ����2
0,5 моль.
Рівняння: 2����������������3 → 2����������������2 + ����2
����(����2 ) =1,5 моль
����(����������������2 ) =2 ⋅����(����2 ) =2 ⋅ 1,5=3,0 моль
12. Обчисліть маси (г) утворених продуктів
масою 24,5 г. Назвіть продукти реакції.
Рівняння: 2������������ ����3 → 2������������ +3����2
���� (����������������3 ) = 122,5 г моль
����(������������ ����3 ) = 24,5 122,5 =0,20 моль
����(������������ ) =0,20 моль, ����(����2
����(H2 O2 ) = 3 34 ≈ 0,088 моль.
2H2 O2 → 2H2 O+O2 ⇒����(O2 ) = 1 2 ����(H2 O2 ) = 1 2 ⋅ 0,088 ≈ 0,044 моль.
Відповідь: 0,044 моль O2 .
Сторінка 110
1. Закінчіть речення:
віддає електрони.
Оксид це бінарна сполука, утворена елементом і
Горіння
2. Дайте відповіді
Послідовність дій:
1) зняти запобіжник;
2) направити розтруб
3) натиснути важіль;
4)
(гіпотези 1, 8, 12). Горіння
1).
Горіння
2)
3)
6.
фотосинтезу.
8. Обчисліть кількість
повітря за один вдих 0,645 г.
За хвилину 15 вдихів, за 45 хв:
( 15 · 45 = 675 ) вдихів.
Маса повітря за урок:
( 0,645 · 675 = 435,4 г ).
Кисню в повітрі 6,6%:
( 435,4 · 0,066 = 28,7 г ).
Кількість речовини кисню:
(���� = 28,7 32 =0,897 моль)
Кількість молекул:
(���� =0,897 ·6,02 · 1023 =5,4· 1023 ).
Отже, за урок
Сторінка 124
1. Закінчіть речення:
об’єм
28 г (н.у.).
����He = 16 4 = 4 моль, ����H2 = 28 2 = 14 моль; ����Σ = 18.
���� = ����Σ · 22,4= 18 · 22,4= 403,2 л.
11. Обчисліть масу (г) суміші, яка складається
11,2 л (н.у.).
O2 = 5,6 22,4 =0,25; ����O2 =0,25 · 32 = 8 г.
N2 = 11,2 22,4 =0,5; ����N2 =0,5· 28 = 14 г.
����Σ =8+ 14 = 22 г. 12. Обчисліть число
���� = 56 22,4 =2,5 моль; ���� =2,5·6,02 · 1023 =1,51 · 1024 . ���� = ���� · ���� =2,5· 44 = 110 г.
= ���� ���� = 68 17 = 4 моль; ���� =4· 22,4= 89,6 л.
=4·6,02 · 1023 =2,41 · 1024 молекул.
�������� = 2,408 · 1024 6,02 · 1023 = 4 моль; ���� = ���� · 22,4=4· 22,4= 89,6 л;
= ���� · ���� =4· 30 = 120 г
11,2
(н.у.). Обчисліть об’єм (л) озону в суміші. 48 · ��������3 22,4 + 32 · 11,2 −��������3 22,4 = 20 ⇒ 16 · ��������3 = 89,6 ⇒ ��������3 =5,6 л
19. Обчисліть
кількістю речовини 0,45 моль (н.у.). ����2 + ���� ����2 → 2������������ ; ��������2 = ������������2 = 0,45 2 =0,225 моль; ���� =0,225 · 22,4=5,04 л (кожного)
20. Обчисліть об’єм (л) кисню,
112 л (н.у.).
��������4 +2����2 → ��������2 +2����2 ���� ; ��������2 =2· ������������4 =2· 112 = 224 л
1) Помилка. Правильно:
число молекул (не рівні маси).
2) Помилка у формулюванні. Правильно:
Сторінка 131
1. Закінчіть речення: Коефіцієнти
об’ємні
1
1
2.
����2 +3����2 → 2��������3 ; ��������2 = 100 · 1 2 = 50 м3 ; ��������2 = 100 · 3 2 = 150 м3
2�������� + ����2 → 2��������2 ;
������������ = 6 моль;
��������2 = 3 моль;
������������ =6· 22,4= 134,4 л;
��������2 =3· 22,4= 67,2 л
10. Чи вистачить водню
��������2 =0,5·2=1,0 л = 1000 мл
1. Закінчіть речення: Основи
Загальна
htps://shkola.in.ua/3289
масою 160 г, якщо
Рівняння: ��������3 + ����2 ����→����2 ��������4
����(��������3 ) = 160 80 = 2 моль;
����(����2 ��������4 ) = 2 моль; ����теор = ���� · ���� =2· 98 = 196 г;
���� = 70 100 · 196 = 137,2 г
Сторінка 147
1. Закінчіть речення:
електролізом води.
Зелений водень це
CO₂.
алюмінію з лугом (Al+NaOH).
2. Дайте відповіді на запитання:
Речовини для добування в лабораторії:
70%.
Гримучий
2����2 + ����2 → 2����2 ����
2
9. Під час електролізу води одержали
масу (г) води, яка розклалася.
(����2 ���� ) = ����(����2 ) + ����(����2 ) = 288 + 36 = 324 г
Обчисліть
об’ємом 1,12 м���� . 2����2 + ����2 → 2����2 ���� ; ��������2 =1,12 · 1 2 =0,56 м3
12. Обчисліть масу (г) заліза, яке реагує
Fe + HCl → FeCl₂ + H₂, якщо
Fe + 2HCl → FeCl₂ + H₂ ����(���� 2 ) = 8 моль ⇒����(�������� ) =
����(��������) = 6,5 65 =0,1 моль ⇒����(���� 2 ) =0,1 моль; ���� (����
Zn + H₂SO₄
+
2. Дайте відповіді на запитання: Важчий за повітря CO₂ (M=44), CO (M=28) майже як повітря.
CO₂ виявляють пропусканням через вапняну воду: Ca(OH)₂ мутніє (утворюється CaCO₃). Повне згоряння палива: CO₂ і H₂O.
Неповне згоряння палива: CO (чадний газ), C (сажа), H₂O.
3. У скільки разів чадний газ легший від вуглекислого?
����(CO2 )
���� (CO) = 44 28 = 11 7 ≈ 1,57 CO легший у 1,57 раза.
4. Чому перевіряють викиди авто на вміст чадного газу? Бо CO утворюється при неповному
отруйний.
5. Дві склянки по 200 мл: одна з CO₂, інша з CO (н.у.). Порівняйте кількість молекул.
Однакова (за законом Авогадро: рівні
кількість молекул).
6. Обчисліть об’єми (л) CO і O₂ (н.у.), потрібні
Рівняння: 2CO +O2 → 2CO2
����(CO2 ) = 8,8 44 =0,2 моль
За стехіометрією: ����(CO) =0,2 моль, ����(O2 ) =0,1 моль ���� (CO) =0,2· 22,4=4,48 л, ���� (O2 ) =0,1· 22,4=2,24 л
7. На згоряння суміші об’ємом
суміші(однаковіумови). 2�������� + ����2 → 2��������2 ; ������������
1. Закінчіть речення:
Причиною парникового
2. Дайте відповіді на запитання: Що таке
енергоефективність
сміття тощо.
Щоб зменшити викиди CO₂, потрібно:
ходити пішки або
Карбон(IV)
вуглекислий
Які наслідки збільшення вмісту парникових
Потепління клімату, танення льодовиків, підняття рівня океану, посухи.
Яка роль мікроорганізмів у колообігу
6CO₂ + 6H₂O → C₆H₁₂O₆ + 6O₂
4. Яка
1. Закінчіть речення:
метан.
Основним
транспортування.
2. Дайте відповіді
Яких заходів потрібно вживати для зменшення викидів
і розкладання сміття.
сфери
3.
4. Проаналізуйте,
5.
1 моль CO₂ = 22,4 л, 25,5 л CO₂ → 1 дерево за добу. V(CO₂) = 2 · 22,4 = 44,8 л, тому потрібно:
44,8 25,5 =1,76 ≈ 2 дерева. Отже, два
природного газу.
Припустімо,
1.
6.
в) метан
3. Проаналізуйте твердження.
I. Метан парниковий газ.
II. Кисень підтримує горіння.
в) обидва правильні
4. Укажіть речовини, розкладом яких одержують кисень у лабораторії: в) гідроген пероксид
5. Укажіть правильні твердження про біогаз:
б) утворюється внаслідок анаеробного розкладу органічних матеріалів
г) основні компоненти: метан
6. Запишіть рівняння реакції окиснення алюмінію.
Сума коефіцієнтів у лівій частині дорівнює: 4Al + 3O₂ → 2Al₂O₃
Сума коефіцієнтів = 4 + 3 = 7
в) менша за суму індексів у формулах двох простих речовин Оксигену і Алюмінію.
7. Сума індексів однакова у формулах гідратів:
Обчислюємо: K₂O (3), MgO (2); SO₃ (4), SO₂ (3); N₂O₅ (7), CaO (2); P₂O₅ (7), BaO (2).
Пари з однаковою сумою немає. Відповідь: немає правильної пари.
8. З кислотами будуть взаємодіяти метали: 1) залізо, 2) мідь, 3) алюміній, 4) срібло, 5) натрій, 6) цинк.
Реагують із неокиснювальними кислотами: 1, 3, 5, 6. Відповідь: г).
9. Укажіть колір
а) H₂; б) CO₂; в) CH₄; г) CO. 1) перегнивання органічних решток; 2) фотосинтез; 3) неповне згоряння палива; 4) електроліз води; 5) дихання.
Відповідь: а–4; б–5; в–1; г–3. (Пункт 2 відволікаючий: під час фотосинтезу утворюється O₂.)
12. Проаналізуйте перелік речовин (BaO, SO₃, O₂, K₂O, O₃, N₂O₅) і розподіліть: I прості речовини; II кислотні
Як обчислити кількість нейтронів у ядрі?
Формула: N = A − Z.
3.
нейтронів). Приклади: \ce{^{12}C} і \ce{^{14}C}; \ce{^{35}Cl} і \ce{^{37}Cl}.
4. Укажіть кількість протонів,
Аргентуму, Паладію.
Ca: Z=20 ⇒ p=20, e=20, ���� = ����Ca − 20
Ag: Z=47 ⇒ p=47, e=47, ���� = ����Ag 47
Pd: Z=46 ⇒ p=46, e=46, ���� = ����Pd 46
5. Порядковий номер елемента
Z(Zn)=30 ⇒ p=30, e=30, n=65-30=35.
а) CCl4 ; б) H2 S; в) B2 O3 ; г) SiO2 .
(дейтерієва) вода. Порівняйте
Важка вода це вода, у
кипіння й замерзання: вищі у D2O; швидкість біохімічних реакцій у D2O нижча; за зовнішнім виглядом обидві прозорі рідини.
16. Складіть ментальну карту «Будова атома».
Центр: «Атом». Гілки: «Ядро» → протони (заряд +1), нейтрони (0),
число A=Z+N; «Електронна хмара» → електрони
(Li);
(Pr);
(Nb);
(At);
(B);
(Cu).
htps://shkola.in.ua/3289-hdz-khimiia-8-klas-midak.html
27 електронів ⇒ 27 протонів ⇒ Z = 27 це Кобальт.
Відповідь: г) Кобальт.
3. Кількість електронів в атомі елемента, що знаходиться в 3-му періоді, 13 групі: 3-й період, 13 група це Алюміній (Z = 13).
Відповідь: а) 13.
4. 17 електронів містяться в атомі елемента, що
Періодичній таблиці: Z = 17 → Хлор (Cl) → 3-й період, 17 група.
Відповідь: а) у 3-му періоді, 17 групі.
5. 20 протонів містяться в атомі елемента, що знаходиться в
Z = 20 → Кальцій (Ca) → 4-й період, 2 група.
Відповідь: в) у 4-му періоді, 2 групі.
6. Знайдіть і виправте помилки, якщо вони є в даних твердженнях:
1) Хімічний елемент це вид атомів із однаковим зарядом ядра. 2) Атом електронейтральна частинка, тобто
1. Закінчіть речення:
(Z = 12): 2, 8, 2
2e, 2e → Z=4 →
2e, 8e → Z=10 →
2e, 8e, 5e → Z=15 →
2,
2,
3,
2 (Be);
18 (Ne);
15 (P).
(C): 2, 4;
електронів зростає 4 → 5 → 6.
7. Що спільного в
Спільне: по 3 електрони на зовнішньому рівні (група 13).
B 2,3 (період 2, металоїд), Al 2,8,3 (період 3, метал).
8. Елемент третього періоду має на зовнішньому рівні 6
номер?
Сульфур (S): Z = 16.
9. Запишіть назву та символи двох
рівнями: Гелій He, Неон Ne (інертні гази).
10. Запишіть назву та символ хімічного
Z=6, A=14 ⇒ p=6, n=14−6=8;
Схема: ядро 6p, 8n; K:2, L:4.
13. Визначте
Z=16 (як A у
A=2·16=32
S. p=16, n=32−16=16; електрони: 16
Потрібно
(беручи модулі) та скоротити, якщо можливо.
3. Визначте ступінь
KBr → K(+1), Br(−1)
MgCl₂ → Mg(+2), Cl(−1)
Ca₃N₂ → Ca(+2), N(−3)
AlH₃ → Al(+3), H(−1)
Ca₃P₂ → Ca(+2), P(−3)
Cr₂O₃ → Cr(+3), O(−2)
CO₂ → C(+4), O(−2)
CBr₄ → C(+4), Br(−1)
4. Складіть формули бінарних сполук і
C(−4) + H(+1) → CH₄ метан
S(+6) + O(−2) → SO₃ сульфур(VI) оксид
N(+3) + O(−2) → N₂O₃ нітроген(III) оксид
Cl(+7) + O(−2) → Cl₂O₇ хлор(VII) оксид
5. Визначте ступені окиснення
ці значення на числову пряму. Запишіть формули
кожним значенням ступеня окиснення.
N₂O₅: O(−2) ⇒ 2x + (−10) = 0 ⇒ x = +5 (N +5)
N₂O: O(−2) ⇒ 2x + (−2) = 0 ⇒ x = +1 (N +1)
Na₃N: Na(+1) ⇒ 3·(+1) + x = 0 ⇒ x = −3 (N −3)
N₂O₃: O(−2) ⇒ 2x + (−6) = 0 ⇒ x = +3 (N +3)
NO₂: O(−2) ⇒ x + (−4) = 0 ⇒ x = +4 (N +4)
N₂: проста речовина ⇒ 0
пряма: −3 (Na₃N) | 0 (N₂) | +1 (N₂O) | +3 (N₂O₃) | +4 (NO₂) | +5 (N₂O₅)
9.
10.
OF₂ (у O ступінь окиснення +2, у F −1)
11. Корунд поширений
періоду 13 групи та 2-го періоду 16 групи.
1) Таблиця (коротко):
Символи елементів: Al, O
Порядкові номери: 13 (Al), 8 (O)
Йони: �������� 3+ , ���� 2−
Ступінь окиснення: Al +3, O −2
Формула: ��������2 ����3
Назва сполуки: оксид алюмінію (корунд)
2) Різновиди корунду: рубін (Cr-домішки), сапфір (Fe, Ti-домішки).
3) Застосування: абразив (наждачний папір, шліфкруги), ювелірні камені, вогнетривка
кераміка, оптичні «вікна», підкладки в електроніці. 12.* Визначте ступені окиснення та
окиснення:
в) Mn₂O₇ (Mn +7).
4. Знайдіть і виправте помилки, якщо
1) Неправильно. Ступінь окиснення може
2) Правильно. У простих
Сторінка 214
1. Закінчіть речення:
заряду ядра (порядкового номера). У кожній тріаді атомна
Ar (39,9) – K (39,1); Co (58,93) – Ni (58,69);
періодична таблиця» («Періодична
Проект може містити: коротку історію
Основні гілки:
1) Історія створення (Дальтон, Деберейнер, Менделєєв, Мозлі).
2) Будова атома (ядро, електрони, енергетичні рівні).
3) Періоди й групи.
4) Властивості елементів у періодах і групах.
5) Значення для науки та практики.
Сторінка 215
1. Увідповідніть прізвища авторів класифікації хімічних
а) Лавуазьє 5) Відомі елементи поділив на металічні й неметалічні.
б) Деберейнер 3) Елементи розмістив у тріади.
в) Шанкуртуа 6) Елементи розмістив на поверхні циліндра по спіралі.
г) Майєр 1) Елементи розмістив за порядком зростання атомних мас; встановив
періодичність властивостей.
д) Ньюлендс 2) Запропонував правило «октав».
2. Знайдіть і виправте
1) Властивості хімічних
періодично.
Твердження правильне, помилок немає.
2) Знаючи
зменшуються.
He, Ne, Ar, Kr, Xe, Rn.
htps://shkola.in.ua/3289-hdz-khimiia-8-klas-midak.html
(Fr).
6. Укажіть назву елемента, який
Флуор (F).
7. Укажіть, як змінюються металічні властивості
у ряду: а) Cs → Rb → K → Na → Li; б) Na → Mg → Al. а) Зменшуються (від Cs до Li). б) Зменшуються (зліва направо).
8. Укажіть, як змінюються неметалічні властивості елементів
а) I → Br → Cl → F; б) Br → Se → As. а) Зростають (від I до F). б) Зменшуються (праворуч
9. Порівняйте значення
в одному періоді.
у
(праворуч) менші.
10. Як змінюються радіуси лужних
Зростають від Li до Cs.
11. Обчисліть об’єм (л) водню (н.у.), який виділяється
речовини
Br до As).
схемою Na + H₂O → NaOH + H₂↑.
Спершу урівнюємо: 2Na + 2H₂O → 2NaOH + H₂. ����(H2 ) = 1 2 ����(Na) = 1 2 ⋅ 2= 1 моль,
���� (H2 ) = ����⋅ 22,4=1 ⋅ 22,4= 22,4 л.
12. Обчисліть кількість
44,8 л за схемою K + Cl₂ → KCl.
2K + Cl₂ → 2KCl
����(���� ���� 2 ) = 44,8 22,4 = 2 моль
����(���� ) =2· ����(���� ���� 2 ) =2·2= 4 моль
13.
(���� 2 ) = 2 2 = 1 моль,
=1· 22,4= 22,4 л
K:
���� (���� ) = 39 г моль ,
����(���� ) = 78 39 = 2 моль
����(���� 2 ) = 2 2 = 1 моль,
���� = 22,4 л
15. Складіть кроссенс «Галогени».
Ключі: «солі моря» → «Cl₂ (відбілювання)» → «лампа з Br» → «антисептик I» → «HF і травлення скла» → «реактивність F₂» → «знебарвлення розчинів». Короткі підписи: властивості, добування, застосування.
16. Обговоріть біологічне значення Кальцію та Магнію.
Ca: кістки й зуби (гідроксоапатит), згортання крові, скорочення м’язів, передавання нервового імпульсу.
Mg: активний центр багатьох ферментів, фотосинтез (Mg у хлорофілі), робота м’язів
серця.
17. Позначте елементи 2 періоду буквами; укажіть:
б) один атом елемента
нейтронів у ядрі (H) → NH₃.
Сторінка 227
1. Металічні
а) Mg, Al, Si б) Ca, Mg, Be
в) Mg, Ca, Sr г) Ga, Al, B
Відповідь: в) (у
2.
а) Be, Mg, Ca б) C, O, F
в) I, Br, Cl г) N, As, P Відповідь: а)
6. Знайдіть і виправте помилки, якщо
1) У ряду C – N – O радіус атома зменшується.
2) Усі елементи 3 періоду – металічні елементи. Відповідь:
твердженнях:
1) Правильно (у періоді зліва направо радіус зменшується).
2) Неправильно: у 3 періоді є метали (Na, Mg, Al), неметал-металоїд (Si), неметали (P, S, Cl) і благородний газ (Ar).
Самоконтроль знань із теми «Досліджуємо будову атома»
Сторінка 228
1. Проаналізуйте твердження.
I. Заряд ядра атома чисельно дорівнює
II. Кількість
Відповідь: обидва правильні.
2. Укажіть назву хімічного елемента, заповнення електронних шарів
ряд 2e, 8e, 5e.
Відповідь: Фосфор.
3. Укажіть ступінь
Відповідь: +6.
4. Укажіть правильне твердження. Відповідь:
рівні.
5.
Li, Na, K.
10. Увідповідніть
а) P 3; б) Br 1; в) Li 4; г) F 2.
11. Увідповідніть
рівнях в атомах.
Відповідь: O 2e, 6e (4); S 2e, 8e, 6e (3); Ne 2e, 8e (1); P 2e, 8e, 5e (2).
12. Установіть послідовність зменшення значення електронегативності
елементів (Al, Cl, H, Na, Ba, F).
Відповідь: F > Cl > H > Al > Na > Ba (номери: Al 4; Cl 2; H 3; Na 5; Ba 6; F 1).
Сторінка 235
1. Закінчіть речення:
сполука стійкіша)
2. Дайте відповіді на запитання: Як виникає йонний
Кількість речовини:
Кількість енергії:
а) SiO₂, б) OF₂, в) HI, г) NH₃.
Відповідь: електронна
Найбільш полярним буде зв’язок у сполуці OF₂, найменш полярним у HI.
4. Виберіть із списку формули сполук із ковалентним зв’язком і поділіть їх у таблицю.
Полярний NH₃, H₂O, SO₃, PH₃, H₂S, NO₂.
Неполярний O₂, N₂, S₈, SiO₂.
Не всі сполуки вдалося поділити, бо частина (наприклад, Fe₂O₃, K₂O) має йонний зв’язок.
5. Як ви поясните вислів «подібне розчиняється в подібному»?
Полярні речовини розчиняються в полярних (наприклад, сіль або цукор у воді).
Неполярні у неполярних (наприклад, бензин розчиняє жир).
6. Яке значення мають знання про полярність молекул?
Вивчення полярності допомагає зрозуміти хімічні
1. Метал елемент,
4. Йонний
3.
Приклади: сіль (NaCl), цукор, алмаз, кварц, залізо.
Використання: у харчовій промисловості, ювелірній справі, будівництві, техніці.
4. Які методи використовують для визначення кристалічної
матеріалу?
Використовують рентгеноструктурний аналіз, мікроскопію, термічні
5. Поміркуйте, як термічна та механічна
частинок.
6. Виготовлення
силіцій(IV) оксид 70% від маси скла, натрій карбонат (Na₂CO₃)
кальцій оксид,
мідь(II) оксид 0,5 кг (надає зеленого кольору),
кобальт(II) оксид 1 кг (надає синього кольору). Обчисліть масову частку (%) кожного компонента: Маса скла 50 кг.
����(SiO2 ) = 50 ⋅ 0,7= 35 кг
�����Na2CO3 � = 10 кг
����(CuO) =0,5 кг
����(CoO) = 1 кг
����(CaO) = 50 − (35 + 10 +0,5+1) =3,5 кг
Тоді масові частки:
���� (SiO2 ) = 35 50 ⋅ 100% = 70%
���� �Na2CO3 � = 10 50 ⋅ 100% = 20%
���� (CaO) = 3,5
50 ⋅ 100% = 7%
���� (CuO) = 0,5
50 ⋅ 100% = 1%
���� (CoO) = 1 50 ⋅ 100% = 2%
Отже, склад скла мільфіорі (%): SiO₂ 70%, Na₂CO₃ 20%, CaO 7%, CuO 1%, CoO 2%.
7. Знайдіть у філворді назви
властивості.
Можливі речовини: скло, сіль, вода, кисень, залізо, сірка, кальцій,
гідроген.
Коротко про властивості:
рідина, має полярні молекули;
залізо метал, блискучий, проводить струм; сірка жовта кристалічна
4. Наведіть
NaCl кухонна сіль (харчова промисловість); CaCO₃ крейда/вапняк (будівництво); KNO₃ селітра (добрива); CaCl₂ протиожеледний реагент; Na₂CO₃ сода (миття, скло).
5. Які умови потрібні
мала
Для прикладу, щоб
обмежити
Сторінка 263
1. Закінчіть речення: Йонні кристали це речовини,
катіонами й аніонами.
Атомні кристали утворені атомами, сполученими
Молекулярні кристали, на відміну від
діють слабкі міжмолекулярні сили.
2. Дайте відповіді на запитання: Що таке кристалічна ґратка?
Це просторове впорядковане розміщення частинок
між собою певним видом хімічного зв’язку.
Як упорядковані частинки
В атомних кристалах
3.
2) Сполуки з атомною
кипіння, тверді та нерозчинні у воді. Самоконтроль
Сторінка 265
1. Хімічний зв’язок …
Відповідь: зв’язок між частинками
кристалі.
2. Зв’язок між атомами неметалів з різною
Відповідь: полярний ковалентний.
3. Укажіть формулу
електронна пара.
Відповідь: HBr.
4. Укажіть тип хімічного
Відповідь: йонний.
5. Хімічні формули речовин із
Відповідь: 1, 4, 6 (NaCl; K₃N; NaF).
6.
водень.
7. Проаналізуйте твердження (про NH₃
Відповідь: лише II. 8.
а) H₂ (4); б) O₂ (2); в) NH₃ (1); г) CH₄ (3); д) SO₃ (5).
(H₂, H₂O, CH₄, HCl, HF).
H₂ (1) < CH₄ (2) < HCl (3) < H₂O (4) < HF (5).
б) (2e, 8e, 1e і 2e, 8e, 7e)
(ковалентний полярний) N₂O, CO₂. Вариант: а).
