0,981,57 0,931,31 0,821,001,361,541,631,661,551,831,881,911,901,651,812,012,182,552,963,00 0,820,951,221,331,602,161,902,202,282,20
2
0,821,001,361,541,631,661,551,831,881,911,901,651,812,012,182,552,963,00 0,820,951,221,331,602,161,902,202,282,201,691,782,052,102,662,60
Підручник
посиланням rnk.com.ua/107937 Григорович О. В. Г 83 Хімія : підруч. для 8 кл. закл. загал. серед. освіти / О. В. Григорович, О. Ю. Недоруб. — Харків : Вид-во «Ранок», 2025. — 320 с. : іл.
ISBN 978-617-09-9592-6 УДК 37.016:54(075.3)
за QR-кодом
РОЗДІЛ 1.
Пізнаємо кількісні закони хімії
§ 1. Елементи, речовини та явища ... 8
§ 2. Формули та назви бінарних
§ 3. Відносна атомна маса
молекулярна маса .. 25
§ 4. Масова частка хімічного
§ 5. Установлення хімічних
§
§ 10. Кисень — єдиний газ повітря, що підтримує горіння .
83
§ 11. Колообіг Оксигену в природі ... 94
§ 12. Озон . . . .
§ 13. Молярний об’єм газів . . .
Навчальне дослідження № 2
«Визначення молярного
100
108
§ 14. Взаємодія оксидів із водою. Поняття про кислоти й основи 120
Навчальне дослідження № 3
«Виявлення кислот і лугів у розчинах» .
Навчальне дослідження № 4
«Виявлення кислот і лугів
у побутових хімікатах природними індикаторами»
§ 15. Гідроген. Водень
16. Водень: хімічні властивості й одержання.
Навчальне дослідження № 5 «Досліджуємо
129
131
певним законам і правилам. Необхідно вміти користуватися
нами для розуміння хімії та розкриття
рубрика «Пригадайте» (важливі знання, набуті раніше, які варто актуалізувати для успішної роботи)
рубрика «Досліджуємо, моделюємо, проєктуємо» (різноманітні дослідження: експериментальні, віртуальні, математичне моделювання тощо)
важлива інформація, яку слід запам’ятати
— рубрика «Поміркуйте» (самостійно
У цьому розділі ви дізнаєтеся:
чи можна придумати свою унікальну хімічну сполуку;
чи можна зважити молекулу води;
що це за «звір» — моль;
скільки атомів Оксигену міститься в ковтку води;
як визначають хімічну формулу невідомої сполуки;
що спільного між міллю та
як правильно визначити масу соди для випікання пирога; чи
1.
2.
3. Маса атомів. Як вимірюють маси атомів і молекул? Чому визначення відносної атомної маси «прив’язане» до атома Карбону?
4. Уплив вимірювань на розвиток хімії та науки в цілому. Створіть лепбук на
Каталог бінарних сполук.
Відносна атомна та молекулярна маса.
Моль — одиниця вимірювання кількості речовини.
Масова частка хімічного елемента в речовині.
молекули або йони. Молекула — це найдрібніша частинка
існувати самостійно і яка є носієм властивостей речовини.
Склад речовин виражають хімічними формулами, використовуючи символи хімічних елементів та індекси.
хімічною
Фізичні властивості речовин:
колір;
запах;
здатність змінювати агрегатний стан (температури
плавлення та кипіння за певних умов);
густина;
здатність проводити електричний струм і теплоту;
розчинність у воді; пластичність / крихкість тощо.
Хімічними властивостями
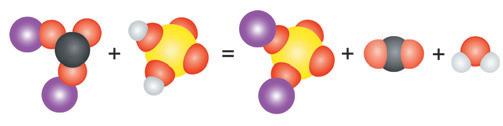
Поміркуйте Хімічна формула харчової соди NaHCO3,
кислота, формула якої CH3COOH. Під час хімічної реакції між цими речовинами утворюються сіль CH3COONa, вуглекислий газ і вода.
Чи правильно складене
CH3COONa + CO2 + H2O = NaHCO3 + CH3COOH
Після зачищення шліфувальним папером мідна
Ні. Речовина, яка
з інформацією
1. Можливо, ви чули забобони щодо молока та приготування дріжджового тіста. Поспілкуйтеся зі своїми близькими дорослими та дізнайтеся, чого, на їхню думку, не варто робити, аби «молоко не скисло» або «тісто не осіло». Запропонуйте способи перевірки цих фактів на наукову достовірність.
2. В українських легендах,
3. Марія та Микола досліджували
Результати
Проаналізуйте результати дослідження та
дайте відповіді на запитання.
1. Визначте масу магнію та масу продукту реакції.
2. За описом досліду Микола склав таке хімічне рівняння: Mg + O2 = MgO. Але Марія зауважила, що Микола припустив неточність, і виправила її. Яку неточність, на вашу думку, помітила й виправила Марія?
3. Чому під час досліду тигель слід накривати кришкою? Чому для спостереження тигель не відкривають повністю, а лише злегка піднімають кришку?
4. У давні часи один король доручив ювелірові
виготовити для доньки іграшку-брязкальце та видав йому брусок із пластичного металу масою 231,0 г. Через тиждень ювелір приніс виріб і сказав, що залишок металу (19,25 г)
він залишив собі як оплату за роботу. Король
запідозрив, що ювелір його обманув, і покликав придворного алхіміка, щоб дізнатися, чи справді брязкальце виготовлене саме з того металу, який було видано ювелірові. Уважно прочитайте опис дій алхіміка, проаналізуйте результати дослідів та обчислень і дайте відповідь на запитання, яке цікавило
3. Для визначення густини матеріалу брязкальця алхімік використав
необхідне обладнання з-поміж того, що зображене на малюнку.
Виберіть необхідне для дослі-
дження обладнання.
Опишіть спосіб визначення густини матеріалу, який, на вашу
думку, застосував алхімік.
Поясніть свій вибір облад-
нання та спосіб визначення
густини.
4. Дослід із визначення об’єму брязкальця алхімік повторив п’ять разів. Щоразу він обчислював
густину матеріалу, а результати фіксував у таблиці.
З якою метою алхімік вимірю-
вав кілька разів?
Обчисліть середнє значення
густини матеріалу брязкальця
за даними експерименту.
Чи можна на цьому етапі пові-
домити королю про можливий обман? Аргументуйте свою
думку.
5. Алхімік порівняв обчислену густину матеріалу, з якого виготовлена
нями густин металів. Порівняйте довідникові значення густин металів із
116,013,2 215,813,4 316,013,2 415,913,3 516,213,1
ні склянки вони насипали, відповідно, кухонну сіль, залізні ошурки, деревну тирсу та глину. Молодша сестра Андрія вирішила допомогти й змішала всі
речовини в одну склянку. Софія та Андрій не розгубилися. Вони розділили суміш на складники, як зазначено на схемі. Компоненти суміші позначено літерами A, B, C, D.
Етап 2. Додали воду і зібрали з поверхні те, що
Зазначте тип кожної суміші (однорідна / неоднорідна), яку отримували Софія та Андрій. Чи можна обрати іншу послідовність дій (або інші дії) для оптимальнішого розділення суміші? Відповідь обґрунтуйте. Які чинники (приміром, властивості тирси) могли завадити роботі Софії та Андрія?
6. Обговоріть достовірність наведених фактів. Запропонуйте способи їхньої перевірки.
1. Багато диму — малий вогонь.
2. Вогонь кочерги не боїться.
3. Коли вогонь розгориться, то спалює і мокре, і сухе.
4. Склянка молока задовольнить добову потребу людини в Кальції.
5. Чим довший термін придатності молока, тим більше в ньому консервантів.
6. Щоб схуднути, потрібно відмовитися від продуктів, що містять жири та вуглеводи.
7. Мед не можна нагрівати — він стає отрутою.
8. ГМО можуть змінити ДНК людини.
9. ГМО шкідливі для навколишнього середовища.
10.
Аніони Хлору також утворюють
1.
3.
9. Запишіть назви аніонів, утворених хімічними елементами: C, Si, Se, Te, As.
10. Латинською binarius — той, що складається з двох, подвійний (від bini — «по два» та bis — «двічі»). Поясніть значення термінів «бінарна сполука», «бінарний код», а також виразу «зіграти щось на біс».
11. Запишіть формули та систематичні назви сполук, утворених хімічними елементами: а) H і S; б) K і S; в) Ba і F; г) Al і I; д) Mg і P; е) Na і N; ж) Na і O; и) K і P.
12. Запишіть систематичні назви сполук: K2O, Al2S3, Ca3P2, MgCl2, LiBr, NaI, HBr, FeF2, Cr2O3, PbCl4.
13. У більшості формул спочатку записують символ хімічного
мента з позитивним зарядом, але в деяких формулах, за традицією, пишуть навпаки. Зважаючи на це,
сполук із Гідрогеном:
Минулого року ми визначили, що атоми мають певну масу (завдяки уявному експерименту Демокрита). Але ж атоми
ший спосіб визначити
медичних
тощо.
Зрозуміло, що для зважування
атомів звичайні терези використовувати неможливо. Сьогодні для
визначення маси атомів і молекул використовують складні прила-
ди — мас-спектрометри (мал. 3.1).
Маси
1 а. о. м.: таку масу називають відносною
Ar(N) = 14 = 14
молекулярна маса»; б) «відносна молекулярна маса»
15. Сьогодні одиницею вимірювання маси в системі SI є кілограм. А в давні часи різні країни користувалися
16.
17.
лення для класу.
18. Обчисліть, атом якого елемента
трогену чи Гелію; б) Оксигену чи Сульфуру; в) Феруму чи Силіцію; г) Сульфуру чи Купруму.
19. Обчисліть, скільки атомів Оксигену мають таку саму масу, як один атом Купруму.
20. Обчисліть відносні молекулярні (формульні) маси речовин: а) хлору Cl2; б) сульфатної кислоти H2SO4; в) сахарози C12H22O11; г) міді Cu; д) ангідриту CaSO4; е) крейди CaCO3; ж) малахіту (CuOH)2CO3.
21. Запишіть формули й обчисліть відносні молекулярні (формульні) маси речовин: а) натрій хлориду; б) кальцій броміду; в) плюмбум(2+) йодиду; г) алюміній оксиду; д) нітроген(ІІІ) оксиду.
22. Речовину із систематичною назвою гідроген пероксид у побуті
хлору».
26.
H H H H H H H H H H H H
одиниці; N — число атомів (йонів) цього елемента, позначене
Приклад 1
Відомо
w (С) — ?
w (О) — ?
2 Відомо:
m(H2O) =
m(O) — ?
w (О) = 1 – w(C) = 1 – 0,273 = 0,727. Відповідь: w(C) = 27,3
27. Обчисліть масові частки
а) NO2; б) PbCl2; в) Na2CO3; г) H2SO4; д) Ba3(PO4)2.
28. Хімічна формула глюкози — C6H12O6, а сахарози — C12H22O11. Обчисліть, у якій речовині масова частка Оксигену більша.
29. Кварц — силіцій(IV) оксид — використовують для виробництва скла. Обчисліть масову частку Силіцію у кварці.
30. Амоніак, або аміак, — важлива речовина хімічної промисловості. Він
32. Гематит — один із
33. Як ви вважаєте, чи відрізняються відносні атомні маси атомів і йонів, що з них утворюються? Поясніть свою думку.
34. Уявіть себе технологом / технологинею на заводі з виробництва сталі (заліза). Ваші постачальники пропонують вам різні види залізної руди: ферум(3+) оксид і ферум(2+) сульфід. Як допоможе вам уміння визначати масову частку елементів
сировину для вашого виробництва?
35. Чилійська селітра NaNO3 й амоніачна селітра NH4NO3 —
Алгоритм доцільно застосовувати, якщо
домо:
що речовина є бінарною;
якими хімічними елементами утворена речовина;
масова частка одного з елементів.
Перетворюємо математичну формулу масової
Приклад 1
вить 44,1 %.
Аналізуємо умову: нам відомо, що сполука складається з йонів Феруму та Хлору.
Відома також масова частка
Визначаємо математичну мо-
дель: використовуємо форму-
лу для обчислення відносної
формульної маси речовини
за відомою масовою часткою
хімічного елемента.
Припускаємо, що N = 1.
Підставляємо у формулу відо-
мі величини, з урахуванням,
що Ar(Fe) = 56
Аналізуємо результати обчислень і складаємо хімічну
формулу сполуки
Mr (речовини) = = N (елемента) · A r (елемента) w(елемента)
Mr (хлориду) = N (Fe) · A r (Fe) w(Fe) 1 ·
= 127
Оскільки ми припустили, що у формулі один йон Феруму, то йони Хлору мають масу 127 – 56 = 71. Це відповідає
йонам Хлору (Ar(Cl) = 35,5)
Формулюємо відповідь Хімічна формула сполуки — FeCl2 Визначте хімічну
ною номенклатурою.
Аналізуємо умову: нам відомо, що сполука складається
з Калію та Оксигену. Відома
також масова частка Калію.
Записуємо умовну хімічну
формулу сполуки
Визначаємо математичну мо-
дель: обчислюємо відносну
молекулярну масу речовини за відомою масовою часткою
Відомо: w(K) = 83 % = 0,83.
Необхідно визначити хімічну формулу сполуки.
KxOy
елемента Mr (речовини) = = N (елемента) · A r (елемента) w(елемента) Припускаємо, що N = 1.
що Ar(K) = 39 Mr (сполуки) = N (K) ·
·
Аналізуємо результати обчислень і складаємо хімічну формулу сполуки Оскільки ми припустили, що у формулі один йон Калію, то йони Оксигену мають масу 47 – 39 = 8. Це відповідає половині йона Оксигену, що не можливо
Повторюємо обчислення, але з припущенням, що N = 2 Mr (сполуки)
Повторно аналізуємо результати обчислень і визначаємо хімічну формулу сполуки.
Складемо назву сполуки (див. § 2 і таблицю на с. 22).
Формулюємо відповідь
2
Цього разу ми припустили, що у формулі два йони Калію, тоді йони Оксигену мають масу 94 – 2 · 39 = 16.
Це відповідає одному йону Оксигену.
Калій оксид
Хімічна формула калій оксиду — K2O
Визначаємо хімічні формули
Цей алгоритм доцільно використовувати, якщо за умовою
дачі відомо:
якими хімічними елементами утворена речовина; що речовина
умову: записуємо умовну хімічну формулу сполуки. Також відомі
носна молекулярна маса
сполуки та масова частка
Карбону, яку одразу переводимо в частки від одиниці
Визначаємо математичну
модель: перетворюємо
формулу для обчислення від-
носної молекулярної маси
сполуки за відомою масовою
часткою хімічного елемента
так, щоб обчислити кількість атомів Карбону.
Підставляємо у формулу
відомі величини з урахуван-
ням, що Ar(С) = 12
Аналізуємо результати обчислень і складаємо хімічну формулу сполуки
Відомо: w(С) = 85,7 % = 0,857, Mr(СxНy) = 70.
Необхідно визначити хімічну форму-
лу сполуки.
СxНy
N (елемента) = Mr (речовини) · w(елемента) A r(елемента)
N (C) = 70 · 0,857 12 = 5
Аналізуємо умову: записуємо умовну хімічну формулу кальциту.
Відомі масові частки Каль-
цію та Карбону, а також від-
носна формульна маса
Визначаємо математичну
модель: переробляємо формулу для обчислення
відносної формульної маси
за відомою масовою часткою так, щоб обчислити число
атомів Кальцію.
Підставляємо у формулу значення масової частки Каль-
цію та його відносної атомної
Відомо: w(Са) = 40 % = 0,4, w(С) = 12 % = 0,12, Mr(СахСуОz) = 100.
Необхідно визначити хімічну формулу кальциту. СахСуОz
маси Ar(Са) = 40 N (елемента) = Mr (речовини) · w(елемента) A r(елемента)
Так само визначаємо число
атомів Карбону, ураховуючи,
N (Ca) = 100 · 0,4 40 = 1
Отже, у формулі біля символу Кальцію індекс 1
що Ar(С) = 12 N (C) = 100 · 0,12 12 = 1 Біля символу Карбону також індекс 1
Так само обчислити число
атомів Оксигену ми не мо-
жемо, адже в умові відсутня
36. Визначте хімічну формулу оксиду, у якому: а) масова частка Хрому становить 52 %; б) масова частка Феруму становить 70 %.
37. Визначте хімічну формулу сполуки: а) Нітрогену з Оксигеном, у якій масова частка Оксигену становить 63,2 %; б) Карбону з Гідрогеном, у якій масова частка
81,82 %.
38. Мінерал халькопірит містить Купрум (масова частка 34,8 %), Ферум (масова частка 30,4 %) та Сульфур. Визначте хімічну
халькопіриту, якщо його відносна формульна маса дорівнює 184.
39. Поширений мінерал магнетит складається з Феруму
40. Відомий
Приклад 1
Відомо: Na2CO3
М(Na2CO3) — ?
Обчисліть
Na2CO3.
Розв’язання:
Обчислимо відносну формульну
кальцинованої соди:
Мr(Na2CO3) = 2 · Ar(Na) + Ar(C) + 3 · Ar(O) = 2 · 23 + 12 + + 3 · 16 = 106. Молярна маса
мульній масі, отже: M(Na2CO3) = 106 г/моль.
Відповідь: M(Na2CO3) = 106 г/моль.
2
Відомо:
n(Na2CO3) = = 0,5 моль
m(Na2CO3) — ?
човини 0,5 моль.
Розв’язання: m = n · M
Обчислимо
Обчислимо масу соди:
m(Na2CO3) = n(Na2CO3) · M(Na2CO3) = = 0,5 моль · 106 г/моль = 53 г.
Відповідь: m(Na2CO3) = 53 г.
Відомо: m(H2O) = 1 кг
n(H2O) — ?
Розв’язання: n = m M
Обчислимо молярну
М(Н2О) = 2 · 1 + 16 = 18 г/моль.
n(H2O) = ≈ 55,6 моль. = m(H2O) M(H2O) 1 000 г 18 г/моль
Відповідь: n(H2O) ≈ 55,6 моль.
го елемента, що
1 моль: а) Cl2; б) H2SO4; в) H3PO4; г) Fe2O3; д) Ca(OH)2.
42. Обчисліть молярні маси речовин: а) H2S; б) NH3; в) F2; г) CaCO3; д) SO2; е) NaOH; ж) K2SO4; и) Fe(NO3)3; к) NaAl(OH)4.
43. Обчисліть кількість речовини: а) заліза масою 7 г; б) азоту N2 масою 21 г; в) крейди CaCO3 масою 500 г; г) харчової (питної) соди NaHCO3 масою 10 кг.
44. Обчисліть масу (г): а) водню Н2 кількістю речовини 2
2,5 моль; г) цукру C12H22O11 кількістю
45.
Якщо ми знаємо залежність між масою речовин і числом молекул, то чи можемо вже самостійно писати «рецепти» для хімічних перетворень? Не знаю, мені
Так, знаючи кількості речовини
вирішити, у яких пропорціях слід
мають утворитися. Ці розрахунки можна здійснити за хімічними
1 моль реагує з воднем кількістю 3 моль при цьому утворюється
а будь-яку іншу кількість речовини
1,5 моль), то кількість речовини азоту, який прореагує, буде втричі меншою, ніж кількість речовини водню, тобто n(N2) = 0,5 моль: n(H2) : n(N2) = 1,5 : 0,5 = 3 : 1
Отже, речовини беруть участь у хімічних реакціях у кількостях, що пропорційні коефіцієнтам у рівнянні реакції — стехіометричним коефіцієнтам. Інакше кажучи, відношення кількостей речовини реактантів (у
коефіцієнтів у рівнянні реакції.
Для будь-якої
рівнянням:
Приклад 1
ються сульфур(IV) оксид і вода.
Аналізуємо умову: нам відома кількість речовини сірководню. Сірководень — це гідроген сульфід H2S.
Необхідно обчислити кількість речовини кисню
Відомо: n(H2S) = 1,5 моль.
Обчислити: n(О2)
Записуємо рівняння реакції 2H2S + 3O2 = 2SO2 + 2H2O
Складаємо пропорцію: за умовою відома кількість речовини сірко-
водню, а не відома кількість речовини кисню, тож необхідно скласти відношення кількостей речовини сірководню та кисню = n(H2S) n(O2) 2 3
В отриманому рівнянні невідома
Складаємо пропорцію: за умовою
кількість речовини кисню, а не відома маса оксиду, тож необхідно скласти відношення кількостей речовини
= n (P2O5) n (O2) 2 5
отриманому рівнянні невідома кількість речовини оксиду, тож перетворюємо його для обчислення n(Р2O5) = n (P2O5) n (O2) · 2 5
Підставляємо у формулу відомі величини й обчислюємо n(P2O5) = = = n(O2) · 2 5 0,5 моль · 2 5 = 0,2 моль
За відомою кількістю речовини фосфор(V) оксиду визначаємо його масу m(P2O5) = n(P2O5) · M(P2O5) = = 0,2 моль · (2 · 31 + 5 · 16) г/моль = = 28,4 г
Формулюємо відповідь m(P2O5) = 28,4 г
Приклад 4
Аналізуємо умову:
частка солі в ньому. Необхідно обчислити масу кальцій
карбонату Відомо: m (розчину CaCl2 ) = = 500 г, w(CaCl2) = 1,11 %, або 0,0111. Обчислити: m(CaCО3)
Записуємо рівняння реакції
Використовуємо формулу для
обчислення масової частки
речовини в розчині.
Обчислюємо масу кальцій хлориду.
Обчислюємо кількість речовини
кальцій хлориду
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
w(речовини) = m(речовини) m(розчину)
w(CaCl2) = m(CaCl2) m(розчину CaCl2 ) m(CaCl2) = m(розчину CaCl2) · · w(CaCl2) = 500 г · 0,0111 = 5,55 г. n(CaCl2) = m(CaCl2) M(CaCl2) = = 5,55 г (40 + 2 · 35,5) г/моль = 0,05 моль
Відношення дорівнює 1 : 1, тож кількості речовин однакові
За відомою кількістю речовини кальцій карбонату визначаємо його масу
n(CaCO3) = n(CaCl2) = 0,05 моль
m(CaCO3) = n(CaCO3) · M(CaCO3) = = 0,05 моль · (40 + 12 + + 3 · 16) г/моль = 5 г
Формулюємо відповідь m( CaCO3 ) = 5 г
53. Визначте відношення кількостей речовини реактантів для реакції одержання
54.
Яка кількість речовини кисню витратиться під час реакції?
55. Гашене вапно Ca(OH)2 (кальцій
гідроксид) використовують для
зменшення кислотності ґрунтів і в будівництві. Обчисліть кількість речовини кальцій гідроксиду, що утворюється внаслідок взаємодії води з кальцій оксидом: а) кількістю речовини 0,5 моль; б) масою 7 г.
56. Запишіть рівняння реакції амоніаку NH3 із киснем з утворенням азоту N2 й води. Обчисліть масу кисню, який необхідний для спалювання амоніаку кількістю речовини 24 моль. Обчисліть маси кожного з продуктів реакції.
57. Для випікання хліба й тістечок часто використовують харчовий розпушувач, який робить тісто пухким. Популярним розпушувачем є
ній гідрогенкарбонат NH4HCO3.
58.
59. У сільському
використовують амоніачну селітру як азотне добриво. За нагрівання така селітра розкладається: NH4NO3 = t N2O + 2H2O Обчисліть масу амоніачної
Головне — пам’ятати, що хімічні речовини реагують у певних, чітко визначених відношеннях. Кількості речовин усіх «учасників» реакції відносяться, як стехіометричні коефіцієнти в рівнянні реакції. Для реакції аА
У цьому розділі ви дізнаєтеся:
які умови науковці називають нормальними;
якщо озон нас захищає, то чому він небезпечний;
що в хімії антонім до с лова «кислий» — зовсім не «солодкий»; чому чадний газ називають «тихим убивцею»; чому водень називають паливом майбутнього.
1. Озон у повітрі.
2. Альтернатива природному газу: використання різних
нашою громадою.
3. Перспективи одержання
4. STEAM-проєкт
5. STEAM-проєкт «Дослідження якості
Я знаю, що повітря важливе для дихання, оскільки в ньому є кисень. А що ще є в повітрі? Ми вивчаємо хімію, то, гадаю, можемо якось це визначити.
довести, що повітря складається з багатьох газуватих речовин? Ми говорили про це на уроках природознавства, але я не розумію, як з’ясували склад повітря.
Цікаво, чи можна якось експериментально
1.
2.
вода.
3. Крізь отвір у куполі підпалюємо фосфор і отвір одразу закорковуємо.
4. Спостерігаємо горіння фосфору
з утворенням твердого продукту реакції — фосфор(V) оксиду.
5. Через певний
(у місті, за його межами та в іншій країні).
Повітря — це складна суміш близько 15 різних газів. Основними компонентами повітря є азот, кисень і аргон (мал. 8.3). Інші компоненти повітря — це вуглекислий газ, неон, гелій, метан тощо. Склад повітря дещо змінюється
фід H2 S (сірководень).
66.
Джозеф Прістлі (1733–1804)
Англійський хімік, першим відкрив кисень
rnk.com.ua/ 110972
Карл Вільгельм Шеєле (1742–1786)
Шведський хімік-самоук, відкрив кисень незалежно від Джозефа Прістлі rnk.com.ua/ 110971
Кисень був відкритий 1774 року Джозефом Прістлі. Науковець досліджував гази, що утворюються внаслідок розжарювання різних речовин сонячними променями, сфокусованими за допомогою лінзи. Для
кисень: 2HgO t = 2Hg + O2↑
Розкладання бертолетової солі
Зручним способом
розкладання бертолетової солі (калій хлорату) KClO3, відкритої
Бертолле. За нагрівання бертолетова
з параграфа.
80. Як ви вважаєте, що означають терміни
ріям мають відповідати
81. З якою метою працівники рибних
82. Як ви вважаєте, чи можна виділити
83. Уявіть,
84.
ється. Чи можна наповнювати
охолодженою водою? Поясніть свою думку.
85. Як ви вважаєте, чи впливає кількість доданого
швидкість реакції? Чому
89.
90.
організмах. Презентуйте результати свого дослідження в класі.
91. Одержання кисню електролізом потребує великих
трику. Кисень у промисловості одержують
цього процесу.
92. За кількістю реактантів і
реакцій можна виділити, зокрема, такі: реакції сполучення, які можна описати схемою А + В = АВ; реакції розкладу за схемою AВ = А + В.
Проаналізуйте методи одержання
якого типу реакцій — сполучення чи розкладу — вони належать? Відповідь поясніть. Сформулюйте
За результатами дослідження Сергій зробив висновок, що в Північному Льодовитому
з-поміж усіх океанів. Оцініть правильність цього твердження, наведіть аргументи для його підтвердження або спростування. Поліна стверджує, що навіть
треба правиль-
зберігати та доставляти до споживачів. Залежно від агрегатного стану кисню, його зберігають у різні способи, як
зображено на малюнках.
Як ви вважаєте, у яких посу-
динах зберігають газуватий
кисень, а в яких — скрап-
лений? Відповідь поясніть.
За схемою влаштування
посудини Дьюара пояс-
ніть, на чому ґрунтується
зберігання кисню в необхідному
що кисень притягується магнітом, узагалі мене шокувало! І не лише з води! Є багато речовин, розкладанням яких можна одержати кисень. Ось це — справжня магія хімії!
«Одержання кисню»
Що є метою нашої роботи?
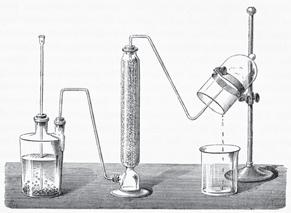
Дослідити одержання, збирання та виявлення кисню.
Що нам знадобиться?
Обладнання: конічна колба об’ємом 100–200 мл, пробірка, корок із газовідвідною трубкою, деревна скіпка, кристалізатор, хімічна склянка об’ємом 50–100 мл, аркуш паперу, спиртівка.
Реактиви: розчин гідроген пероксиду (аптечний, 3 %), каталізатор (сухі
Збирання газів у лабораторії зазвичай здійснюють двома способами: витісненням повітря або витісненням води.
Газовідвідна трубка занурена на дно
Реактант для одержання кисню
планували.
та кисень, запропонуйте спосіб доведення наявності кисню в посудині.
Щоб довести, що газ, яким ви наповнили
пробірку або іншу посудину, — це кисень, треба до отвору посудини піднести тліючу скіпку або занурити її в
—
3.
4.
5. Піднесіть тліючу
її, допоки не впевнитеся, що вона цілком
6. Поки хімічна склянка заповнюється киснем, налийте в кристалізатор воду, заповніть пробірку водою, закрийте її та помістіть отвором униз у криста лізатор. Відкрийте отвір пробірки.
7. Коли хімічна склянка заповниться киснем, перемістіть газовід-
2.
3.
1. Чи вдалося підтвердити / спростувати гіпотезу,
2.
3.
4. Запропонуйте
Помістимо розжарений шматочок деревного вугілля в чистий кисень. Вугілля продовжує горіти, не утворюючи полум’я, але набагато яскравіше, ніж у повітрі.
Продуктом згоряння деревного вугілля є карбон(IV)
вуглекислий газ:
Помістимо в сталеву ложечку невеликий шматочок сірки й нагріємо на спиртівці.
жими «порціями» кисню.
Димар забезпечує
Температура займання
Кисень (окисник) Горюча речовина
Мал. 10.1. Трикутник вогню
Ковалі, металурги та скловари спеціальними
Якщо подрібнити
в полум’я пальника, то воно займеться, розкидаючи яскраві іскри — частинки розпеченого
ферум(3+) оксиду. Малоактивні
й не здатні горіти. Приміром,
лише за нагрівання:
95. Порівняйте поняття «горіння», «повільне окиснення» та «вибух», склавши діаграму Венна.
96. Запишіть
оксиду, йод(V) оксиду, плюмбум(IV) оксиду.
97. Запишіть рівняння реакцій із киснем речовин: а) літію; б) каль-
98. Обчисліть масу (г) сірки, яка згоріла,
99.
102.
103.
104.
завданням № 92 на с. 76.)
105. Поясніть зміст поняття «температура
єте, чи загориться сірка або деревне вугілля, якщо їх без попереднього нагрівання внести в посудину із чистим киснем?
106. Поміркуйте, чому під час горіння деяких речовин, приміром, вугілля, не утворюється полум’я.
107.
112. Обговоріть, яка свічка
113. За правилами безпеки на
114. Рудокопи помітили, що
115. Використовувати
ними елементами він становить
сфери (червоного залізняку, кварцу, гіпсу, польового шпату тощо) й речовин, що
119.
120.
123.
Поміркуйте
металевою дротиною, яка
створює електричний розряд усередині
Попри те, що озон за властивостями
же все, зокрема, тканини в легенях. Озон
токсична, канцерогенна й мутагенна речовина,
може спричинити смерть людини. Утім токсичну дію озону
тивні речовини в них. Навіть
приміщень у лікарнях, стерилізації посуду (мал. 12.1А). На деяких водоочисних станціях перед подачею
у
крізь воду пропускають потужний струмінь
(мал. 12.1Б). Озонування
Ультрафіолетове випромінювання
Мал. 12.3. Діяльність
Ділянку атмосфери, у якій
Мал. 12.4. Озонова
129. Чи можна ультрафіолет
130.
131.
Максимальне значення об’ємної частки озону — 0,006 %.
На якій висоті (за графіком) спостерігається такий уміст
озону? У якій частині атмосфери вміст озону найменший? Поясніть, чому
133. Створіть листівку
він дорівнюватиме 22,4 л/моль.
відношенню об’єму
Для порівняння: за стандартних умов (температури 25 °С
Якщо під час реакції утворюються
то відношення числа
молекул у хімічному рівнянні
rnk.com.ua/ 110977
1
Відомо: n(газу) = 1,20 моль
V(газу) — ?
Приклад 2
Відомо: V(газу) = 5,6 л
n(газу) — ?
Розв’язання: V = n · Vm = 1,20 моль · 22,4 л/моль = 26,9 л. Відповідь: V(газу) = 26,9 л.
Приклад 3
Відомо: V(CO2) = 1,00 л
m(CO2) — ?
Розв’язання: n = = 0,25 моль. = V
1,00 л (н. у.).
Розв’язання: Обчислимо кількість речовини
газу:
n(CO2) = = 0,0446 моль. = V(CO2) Vm 1,00 л 22,4 л/моль
M(CO2) = 12 + 2 · 16 = 44 г/моль, m(CO2) = n(CO2) · M(CO2) = = 0,0446 моль · 44 г/моль = 1,96 г.
Відповідь: m(CO2) = 1,96 г.
: m(Р2О5)
Записуємо рівняння реакції 4P + 5O2 = 2P2O5
Перед складанням пропорції всі
об’єми, подані в літрах, «переводимо» в молі n(O2) = = = V(O2) Vm 11,2 л 22,4 л/моль = 0,5 моль
Необхідно скласти відношення кількостей речовини оксиду та кисню = n(P2O5) n(O2) 2 5
В отриманому рівнянні не відома
кількість речовини оксиду, тому
перетворюємо його для обчислен-
ня n(Р2O5) n(P2O5) = n(O2) · 2 5
Підставляємо відому кількість
речовини кисню й обчислюємо n(P2O5) = = = n(O2) · 2 5 0,5 моль
За відомою кількістю речовини
фосфор(V)
«учасників» реакції. Також відомо, що об'єми всіх газів виміряні
за однакових умов. У такому разі можна застосовувати закон ГейЛюсcака.
Відповідно до закону Гей-Люссака:
об’єми всіх «учасників» реакції
відносяться один до одного, як
коефіцієнти в рівнянні реакції = V(CH4) V(O2) 1 2 , = V(CH4) V(CO2) 1 1
За складеними пропорціями обчис-
лимо V(O2) і V(CO2) V(O2) = V(CH4) · 2 = 1 л · 2 = 2 л. V(CO2) = V(CH4) = 1 л
Формулюємо відповідь V(O2) = 2 л, V(CO2) = 1 л
що стали підґрунтями для формулювання їхніх законів.
137. Обчисліть об’єми (н. у.) речовин: а) азоту кількістю речовини 2 моль; б) кисню кількістю речовини 0,5 моль; в) фтору кількістю речовини 0,25 моль; г) сірководню H2S кількістю речовини 2,9 моль; д) амоніаку NH3 кількістю речовини 4,2 моль.
138.
140. Обчисліть об’єм (н. у.) водню: а)
141.
142.
143.
145. На запитання: «Який
rnk.com.ua/
Визначити
(для відмірювання рідин) і 100 мл (для збирання газів), конічна колба, корок із газовідвідною трубкою, ваги, фільтрувальний папір.
Реактиви: аптечний перекис водню (3 %), каталізатор, крейда, столовий оцет (6 %), розчин NaCl (10 %).
Визначаємо ризики
Які небезпечні та проблемні
обладнанням і речовинами, зокрема, розчинами гідроген перокси-
1)
2)
3)
1)
2)
3)
4)
Порівняйте значення молярного об’єму газу, яке є результатом дослідження, з молярним об’ємом газів за нормальних умов. Чи справді молярний об’єм газу не залежить від складу (формули) газуватої речовини?
Для підбиття підсумків
1. Поясніть, чому важливо швидко закоркувати колбу після змішування реактантів.
2. Чи можна виконувати дослідження за нормальних умов, щоб потім не перераховувати об’єми? Якщо ні, то поясніть, для чого після дослідження перераховувати
3.
4.
5.
6.
пами, визначте точність вашого дослідження. Які чинники могли вплинути на точність результатів?
7. Як ви вважаєте, навіщо використовували
Поміркуйте Сформулюйте
оксиди, утворені металічними елементами, у яких формальний заряд хімічного елемента в складі оксиду зазвичай +4 і вищий. Усі кислотні оксиди, за винятком силіцій(IV) оксиду SiО2, реагують із водою з утворенням кислот: кислотний оксид + Н2О → кислота
Наприклад:
SO3 + H2O = H2 SO4 (сульфатна кислота); CO2 + H2O = H2CO3 (карбонатна кислота);
P2O5 + 3H2O = 2H3PO4 (ортофосфатна кислота);
Mn2O7 + H2O = 2HMnO4 (перманганатна кислота).
Наприклад:
Na2O + H2O = 2NaOH
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
число гідроксид-аніонів у складі формульної одиниці основи дорівнюватиме заряду катіона металічного хімічного елемента: Na OH , Fe (OH 2 )2
Назви основ складають так само,
Наприклад: Na OH — натрій гідроксид; Fe (OH 2 )2 — ферум(2+) гідроксид.
важно розчинні основи) та нерозчинні основи. Розчинність
(як і інших речовин) можна визначити
(див. форзац 2). Наприклад,
тіонів Na+ та аніонів OH–, є розчинною (мал. 14.1). Із водою можуть реагувати
утворюються луги.
Na2O
K2O
Li2O
SrO
BaO
Взаємодіють
MnO Не взаємодіють
FeO
Кислоти та луги —
Натрій гідроксид NaOH
Калій гідроксид KOH
Літій гідроксид LiOH
Стронцій гідроксид Sr(OH)2
Барій гідроксид Ba(OH)2
Манган(2+) гідроксид Mn(OH)2
Ферум(2+) гідроксид Fe(OH)2
Робота з інформацією
147. Запишіть формули оксидів: калій оксиду, фосфор(ІІІ) оксиду, аргентум(1+) оксиду, ферум(2+) оксиду, хлор(IV) оксиду, нітроген(V) оксиду, сульфур(VI) оксиду, ванадій(V) оксиду. Які з них є основними, а які — кислотними?
148. Запишіть формули гідроксидів: Калію, Магнію, Стануму(2+), Хрому(3+), Купруму(2+), Барію. Підкресліть формули лугів.
149. Випишіть окремо формули оксидів: а) кислотних; б) основних.
Na2O, P2O5, CO2, SO3, SO2, CrО, ВаО, Cu2O, SiО2, Mn2O7, Li2O, N2O5, MnO, SnO2, I2O5. Для оксидів, які можуть реагувати з водою, запишіть рівняння реакцій, для інших — формули відповідних кислот або основ.
150. Доповніть схеми реакцій і назвіть утворені продукти: а) Li2O + H2O → …; б) SO2 + H2O → …; в) … + H2O → Ba(OH)2. 151.
153.
154.
які
155. Речовини групи антоціанів на-
зивають «природними хамелеонами» через те, що за наявності
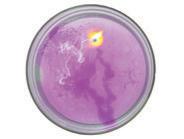
кислот і лугів вони змінюють забарвлення. На світлині зображено різне забарвлення
екстракту із червоноголової ка-
пусти (розчин антоціанів) за на-
явності різних речовин.
За таблицею 3 (с. 125) зробіть висновок
лугу в різних частинах склянки.
156. Більшість індикаторів для виявлення кислот
rnk.com.ua/ 110979
1.
2.
універса льного індикатора.
3. Результати спостережень занотуйте в таблицю.
4. Підготуйте три пробірки. У першу
2. За результатами дослідження зробіть висновок: яким / якими індикаторами зручніше користуватися для виявлення: а) кислот; б) лугів.
3. Чому в цьому дослідженні рекомендовано
хімікатах природними індикаторами» 1
Що є метою нашої роботи?
rnk.com.ua/ 110980
Визначити наявність кислот або лугів у засобах побутової хімії, роз-
вивати навички здійснення якісного аналізу.
Що нам знадобиться?
Обладнання: одноразові стаканчики, ніж, лійка, фільтр (паперові
рушники, фільтр для кавоварки, марлева тканина тощо), тертка. Речовини та матеріали: буряк або червоноголова капуста чи квітки з яскравими пелюстками (на власний вибір), наявні зразки засобів
бутової хімії та харчових продуктів. Визначаємо ризики
об’єктах: у буряку (коренеплодах), червоноголовій капусті, чорниці, у яскравих пелюстках квіток (фіалки, календули, бузку тощо). Також можна використати зеленку (розчин «Брильянтового зеленого») з домашньої аптечки.
1. Приготуйте природний індикатор.
Так само можна приготувати сік
із червоноголової капусти або
чорниці.
Для приготування індикатора
з пелюсток квіток їх необхідно
на ніч залити спиртом, а потім
відфільтрувати.
2. Випробуйте отриманим індикатором наявні у вас зразки.
У пластикові стаканчики налий-
те досліджувані харчові продукти
й засоби побутової хімії об’ємом
приблизно по 20–50 мл і долийте до них по 1–2 мл природних індикаторів.
Для випробування можна використати:
розчини лимонної кислоти, харчової (питної) соди, прального порошку, мила;
маринад від маринованих овочів (огірків, помідорів тощо), сік квашеної капусти, свіже та прокисле молоко, кефір, йогурт, сметану, сік лимона (або інші соки) тощо; засоби для чищення скла, унітаза, підлоги, духової шафи тощо (для випробування цих
SbH
Водень
Хімічна формула й модель молекули
Водень:
смаку та запаху; розчинність у воді: за 0 °С в 1 л води розчиняється
Твердий водень — це кристали, що нагадують сніг. Проте
за тиску понад 4 млн атм
твердий водень стає металом.
Такий металічний водень міститься в глибинних шарах
Поверхневий газуватий шар (шар хмар)
Землі відбувається багато
водень (мал. 15.1): вулканічна
дією радіоактивного випромінювання, у геотермальних джерелах тощо. Також
164. На початку ХХ століття водень широко використовували для виготовлення дирижаблів, допоки не сталася трагедія з повітряним судном «Гінденбург». Які висновки було зроблено після цього?
Підготуйте коротке ілюстроване повідомлення про використання дирижаблів і катастрофу «Гінденбурга».
165. Обчисліть густину водню за нормальних умов, порівняйте отри-
мане значення з наведеним у параграфі.
166. За матеріалом параграфа обчисліть масову частку водню у водному розчині, якщо за температури 20 °С розчиниться його максимальний об'єм. Порівняйте
часткою
аналогічних умов (див. § 9). До яких речовин (розчинних, малорозчинних чи практично нерозчинних) належать кисень і водень?
167. Обчисліть масову частку водню, розчиненого в паладії, якщо в металі розчиниться його максимальний об'єм (н. у.). Густина паладію — 12,02 г/см3. Для розрахунків використайте дані з параграфа. Розуміння
168. Чому Гідроген є найпоширенішим елементом у Всесвіті?
169. Поясніть, як поширеність Гідрогену пов’язана з утворенням молекул води й інших сполук на Землі.
170. Порівняйте поширеність Гідрогену й Оксигену у Світовому
Яке місце в періодичній таблиці мав би посісти Мурій?
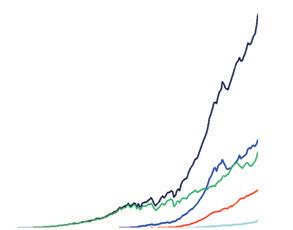
174. Проаналізуйте графік атомізації (дисоціації) водню.
Запишіть хімічне рівняння процесу атомізації водню.
Дізнайтеся значення слова «дисоціація» і сформулюйте гіпотезу, чому цей термін тут є синонімом терміна «атомізація».
У якому діапазоні температур «вигідне» існування лише молекул водню?
За якої температури атомізація водню відбувається щонайменше на 5 %?
Чи існують молекули водню на поверхні Сонця? А в
рі Юпітера? (Для відповіді
лами інформації.)
А ти знаєш, що водень може створити «гримучий газ»? Це схоже на щось із хімічної лабораторії мага! Вибухи? Звучить круто! Де роздобути водень?...
Водень реагує майже з усіма неметалами, а з елементами 17-ї групи (галогенами) водень реагує
активно.
Наприклад:
із фтором: H2 + F2 = 2HF (реагує з вибухом
температури);
із хлором: H2 + Cl2
каталізатора (платина, паладій
найменшої іскри.
із сіркою: Н2
з азотом: 3H2 + N2 t, p, кат. = 2NH3
із сажею: 2H2 + C t = CH4 t =
називають так само, як і інші бінарні сполуки
Поміркуйте
175. Поясніть, як утворюються йони Гідрогену Н+ і Н–.
176. Проаналізуйте рівняння реакцій водню з неметалами. Поясніть умови, за яких відбувається та чи інша реакція. Запишіть назви утворених продуктів реакцій.
177. Запишіть формули бінарних сполук Гідрогену з: K, Li, Mg, Sr, Al.
178. Запишіть хімічні рівняння утворення бінарних сполук, згаданих у попередньому завданні, із простих речовин.
179. Запишіть назви сполук: Fe2O3, CuO, WO3, Ag2O, MnO. Для останніх двох речовин запишіть рівняння реакцій із воднем.
180. Останнім часом дедалі більше застосовують промисловий спосіб одержання
181.
182.
масою 44 г.
183. Під час електролізу води одержують водень,
ного кисню, якщо під час електролізу одержано 2 м3 водню (н. у.).
184. Амоніак — дуже важлива промислова речовина, він є сировиною для одержання азотних добрив. Обчисліть
водню (н. у.), необхідний для одержання амоніаку масою 340 кг.
185. Деякі метали, зокрема, хром, використовують для захисту сталі від корозії (іржавіння). Обчисліть масу хром(3+) оксиду, який можна відновити, використовуючи водень об’ємом 44,8 л (н. у.). Обчисліть масу утвореного хрому.
сполучення: А + В → АВ; розкладу: AВ → А + В;
обміну: АВ + CD → AD + CB; заміщення: АВ + С → СВ + А. Проаналізуйте хімічні
та способи
жання, описані в параграфі. До якого типу належить кожна з реакцій? Поясніть свою відповідь.
188. Водень легко
189.
нити реакцію одержання натрію під час
191.
які в них відбуваються.
192. «Кресало Деберейнера» — один
із перших пристроїв для отримання вогню в домашніх
близько 200 років тому. Певною
rnk.com.ua/
Дослідити лабораторний спосіб одержання водню, фізичні властивості водню та способи його збирання.
Що нам знадобиться?
Обладнання: апарат Кіппа, кристалізатор із водою, соломинка, пробірки, сірники.
Реактиви: цинк, хлоридна кислота, мильний розчин.
Визначаємо ризики
Які небезпечні та проблемні ситуації можуть статися під час роботи з названим обладнанням і речовинами? Яки-
Поміркуйте Як
Відкрийте
1.
2.
3. Унаслідок якого
4.
5. Як результати дослідження (дослід
6.
7.
8. На чому ґрунтується
Поширеність у природі та застосування солей
Натрій карбонат Na2CO3 (кальцинова-
ну соду) одержують із природного мінералу
Na2СO3 · 10H2O (кристалічної соди) й використо-
вують для виготовлення скла, мила, пральних порошків тощо.
Калій карбонат K2CO3 (поташ) використовують
для виробництва мінеральних добрив, виготов-
лення кришталю й оптичного скла тощо.
Глауберова сіль Na2SO4 ∙ 10H2O (мірабіліт) —
важливий реактив для лабораторної практики, також його використовують для виготовлення скла. Має проносну дію, що є характерною для всіх розчинних солей сульфатної кислоти.
Арсен(ІІІ) сульфід As2S3 (аурипігмент) — цін-
ний мінерал, із якого раніше виготовляли зо-
лоту та жовту фарби, які використовували
в іконописі. Надзвичайно отруйний. Є сирови-
ною для одержання арсену.
Цинк сульфід ZnS (цинкова обманка, сфалерит)
є сировиною для одержання цинку. Зі сфалери-
ту виготовляють цинкові білила, а також фарби, що світяться в темряві.
Аргентум(1+) нітрат AgNO3 (ляпіс) здавна використовували для виготовлення дзеркал. Солі Аргентуму іноді використовують
або AgBr, то вони конденсують водяну пару, і випадає дощ.
гівля сіллю.
194. Назвіть солі: а) K2SO4; б) Сr(NO3)3; в) MgCl2; г) CuSO4; д) SnCl2; е) AgNO3; ж) AlPO4; и) BaSO3; к) BaS; л) BaSO4; м) Na2SiO3; н) NaBr; п) MnSO4; р) Ag2S; с) Mg3(PO4)2. Зазначте заряди катіонів і аніонів
кислотні
силікату; е) аргентум(1+) хлориду; ж) магній сульфіту; и) алюміній сульфіду; к) ферум(3+) сульфату; л)
рій(2+) нітрату; с) купрум(1+) фториду.
196.
198. Обчисліть маси: а) хром(3+) сульфату кількістю речовини 0,35 моль; б) кальцій фториду
речовини 0,7 моль; в) магній силікату кількістю речовини 1,2 моль.
199. У складі пластмаси для деталей конструктора «Лего» міститься барій сульфат. Солі
Барію дуже отруйні, але барій сульфат майже нерозчинний у воді, що робить його нетоксичним для організму. До того ж його
дуже добре видно на рентгенівських знімках.
Якщо дитина проковтне деталь, її можна знайти за цими знімками. Запишіть форму-
лу барій сульфату.
200. Фізіологічний розчин — це водний розчин натрій хлориду, у якому масова частка солі становить 0,9 %. Обчисліть масу натрій хлориду, необхідну для приготування фізіологічного розчину об’ємом 5 л (густину розчину вважати 1 г/мл).
201. У воді масою 532,8 г розчинили кальцій хлорид кількістю речовини 0,2 моль. Обчисліть
202. Із-поміж солей, згаданих у завданнях
кальцій хлориду в розчині.
та підготуйте
стивості, застосування сьогодні
203. Пригадайте поширеність хімічних елементів у земній корі. Чому найпоширенішими
й карбонати? Як їх можна використовувати? Тепер я знаю,
Що є метою нашої роботи?
Дослідити активність металів у реакціях із кислотами.
Що нам знадобиться?
Обладнання: штатив із пробірками. Реактиви: зразки металів (цинк, алюміній, залізо, мідь, олово, магній тощо), зразки кислот (хлоридна або сульфатна). (Натрій, калій або
кальцій (за наявності) досліджуються віртуально або демонстраційно.)
Визначаємо ризики
Співвіднесіть активність
елементів
1. Чи можливо схарактеризувати
2. Як варто враховувати
3.
Ми ж начебто знаємо, як метали реагують із кислотами. Але, можливо, з-поміж них є якийсь «рейтинг»?
Як у спорті: хто сильніший — той посідає перше місце. На мою думку, «ряд
+ 3H2O t = Fe2O3 + 3H2↑ Zn + H2O t = ZnO + H2↑
K Ca NaMg Al Zn Fe Ni SnPb H2 Cu Ag Hg Au
Із часом залізна пластинка покриється досить щільним шаром міді, а розчин світлішає, що
свідчить про зменшення в ньому кількості йонів Купруму(2+) (мал. 18.2).
Залізо розміщене в ряду активності ліворуч від міді, тому
катіони Феруму можуть витіснити атоми Купруму із солі. Але якщо в розчин купрум(2+) сульфату занурити срібну пластину, то реакція не відбуватиметься: CuSO4 + Ag ≠
Мідь можна витіснити із солі будь-яким металом, розміщеним ліворуч від міді в ряду
активності. А мідь буде витісняти з розчинів інших солей будь-який метал, розміщений у ряду активності праворуч від
неї (мал. 18.3):
2AgNO3 + Cu = Cu(NO3)2 + 2Ag↓ Найактивніші метали, розмі-
алюмінію), не витісняють
Мал. 18.2. Взаємодія розчину купрум(2+) сульфату із залізною пластинкою
CuO + Pb t = PbO + Cu Fe2O3 + 2Al t = Al2O3 + 2Fe
204. Підготуйте повідомлення про М. М. Бекетова та його дослідження щодо формування ряду активності металів.
205. Шматочки магнію та олова помістили в розчин хлоридної кислоти. З яким металом реакція відбувається інтенсивніше? Запишіть рівняння реакцій.
206. У розчин нікель(2+) сульфату занурили свинцеву та залізну пластини. З яким металом реакція відбуватиметься? Відповідь поясніть.
207. Чому для одержання міді з розчину купрум(2+) сульфату не можна використовувати натрій і калій, адже вони активніші за мідь? Чи можна їх використовувати для одержання міді з розплаву купрум(2+) оксиду? Відповідь поясніть.
208. Які речовини утворюються під час взаємодії води: а) з активними металами; б) оксидами активних металічних елементів; в) оксидами неметалічних елементів? Наведіть приклади.
209. Визначте можливість реакцій між такими металами та кислотами: а) Mg і H2SO4(розб.); б) Fe і HBr; в) Hg і HCl; г) Al і HI; д) Cu і H3PO4; е) Ni і H2SO4 (розб.); ж) Au і HCl; и) Pb і HCl; к) Sn і H2SO4 (розб.); л) Zn і HBr; м) Mn і H2SO4 (розб.). Для можливих реакцій запишіть хімічні рівняння та назвіть продукти реакцій.
210. Визначте можливість реакції з водою таких металів: K, Sr, Ba, Mn, Sn, Ag, Hg. Для можливих реакцій
хімічні рівняння й назвіть продукти реакцій.
211. Визначте можливість реакцій
такими
та солями: а) FeSO4 і Sn; б) AgNO3 і Cu; в) NiCl2 і Al; г) CuSO4 і Hg; д) Hg(NO3)2 і Cu; е) Hg(NO3)2 і Ag; ж) CrCl3 і Zn; и) Al2(SO4)3 і Pb; к) SnCl2 і Zn; л) FeCl2 і Zn; м) NiSO4 і Fe; н) CuBr2 і Al; п) Pb(NO3)2 і Ni.
212.
213.
хімічні рівняння та
214. Після занурення цинкової пластини в розчин купрум(2+) нітрату на
215. Обчисліть
216. Обчисліть об’єм водню (н. у.), який
хлоридною кислотою.
217. Обчисліть кількість речовини сульфатної кислоти,
для взаємодії з магнієм
218. Обчисліть кількість речовини міді,
219. Суміш магнію масою 6,0 г і
статньою кількістю розчину сульфатної
водню (н. у.), що виділиться під час реакції.
220. У розчин аргентум(1+)
виріб у повітрі
досить короткий час перетворюється на сірий порошок, у якому можна спостерігати сріблясті кульки. Поясніть, чому можуть відбуватися такі зміни, з хімічної точки зору. Запишіть відповідні рівняння реакцій.
224. Прочитайте опис досліду та дайте відповіді на запитання. Учитель демонстрував у класі взаємо-
дію натрію з водою. Велику посудину
він наповнив водою і додав до неї розчин фенолфталеїну. Між посудиною та
учнями / ученицями в класі розмістив
пластиковий прозорий екран і
дів захисні окуляри. Потім учитель
у якій він зберігався зануреним
у мінеральну олію, видалив
і пінцетом поклав його у воду.
Одразу почалася бурхлива реакція: вода навколо натрію вирувала, газ штовхав шматочок натрію по поверх-
ні води, а в місці контакту з натрієм
вода става ла рожевою.
Запишіть рівняння реакції натрію з водою.
Яке спостереження свідчить про
гідроксиду?
Яка ознака активного
226.
Способи
Найпоширенішими способами
ріння карбоновмісних речовин
лоти (карбонатів).
Горіння вугілля (або сажі): С + О2 = СО2
Горіння метану й інших вуглеводнів (сполук Карбону
Розкладання кальцій карбонату:
вим бродінням рослинної
Дізнайтеся більше
Кислотні дощі (дощова вода з домішками кислот) є не лише серйозною екологічною проблемою для ґрунтів, водойм
і живих організмів. Кислотні опади та-
кож пошкоджують пам’ятки архітектури, виготовлені з мармуру. Впродовж століть на поверхні мармуру відбувається
реакція кальцій карбонату з кислотою, що спричиняє руйнування скульптур.
Пригадайте
З матеріалу § 14 пригадайте, до якого
234.
припустивши, що «гасити» соду
можна й хлоридною кислотою, обчисліть
масу гідроген хлориду, який витрачається
для «гасіння» харчової соди масою 10 г.
Обчисліть об’єм утвореного вуглекислого
газу (н. у.).
235. Для очищення повітря закритих приміщень
го газу його пропускають
м3 (н. у.) накопичився
236.
вуглекислого
241.
242.
244. У необроблених кавових зернах
доволі великий уміст кофеїну, що
може негативно впливати на організм. Для видалення (повного або часткового) кофеїну із зерен кави
їх потрібно додатково обробити
перед смаженням. Це, по-перше, позбавить шанувальників кави
надлишку кофеїну. А по-друге — у такий спосіб одержують чистий
кофеїн для фармацевтичної та
харчової промисловості.
Проаналізуйте опис процесу декофеїнізації та
на запитання.
під час декофеїнізації? Які способи розділення сумішей застосовують?
У додаткових джерелах знайдіть інформацію щодо галузей промисловості, у яких використовують вуглекислий газ із такою самою метою.
245. Йохан Баптіст ван Гельмонт ще у XVIII столітті припустив існування вуглекислого газу.
(«лісовий
248. Артем, Сніжана та Юля вирішили виміряти молярний
об’єм вуглекислого газу. Ко-
жен із них наповнював конічну колбу об’ємом 1,00 л
вуглекислим газом з апарата Кіппа та зважував колбу
до та після наповнення. Навіщо в цей прилад додали осушувач? Чи може
вплинути на результати експерименту його відсутність? Осушувач Артем наповнював колбу
m(повітря в колбі до заповнення) = = ρ(повітря) · V(повітря в колбі)
вуглекислого газу» 1
Що є метою нашої роботи?
Дослідити ефективність різних розпушувачів тіста.
Що нам знадобиться?
rnk.com.ua/ 110985
Обладнання: три невеликі посудини для замішування тіста, ложки. Речовини: для приготування тіста: борошно, вода, цукор; для розпушування: сухі дріжджі, харчова сода, столовий оцет, пакетик
1.
3.
5.
1.
2.
3. Який
можна оцінити об’єм випеченої продукції?
4. За інформацією
якій
«Досліджуємо вуглекислий
Що є метою нашої роботи?
Дослідити фізичні властивості та способи виявлення
Що нам знадобиться?
Обладнання: апарат Кіппа (або інший пристрій
кислого газу), склянки, штатив із пробірками, свічки, склянка і соломина, сірники, свічки.
Речовини: мармур, хлоридна кислота, вапняна вода, вода, універсальний індикатор.
Визначаємо ризики
Які небезпечні та
час роботи
Якими мають бути
Що ми маємо зробити?
Поміркуйте
rnk.com.ua/ 110986 1. Зберіть
4.
Етанол
С2Н5ОН + 3О2 = 2СО2 + 3Н2О
Продукти реакції — безбарвні.
Нагріті гази світяться ледь синім.
На згоряння 1 об’єму випарів етанолу витрачається 3 об’єми кисню.
Згоряння пентанолу
Пентанол
2С5Н11ОН + 15О2 = 10СО2 + 12Н2О
Усі продукти реакції також газуваті, й полум’я має бути безбарвним.
На згоряння 1 об’єму випарів пентанолу витрачається 7,5 об’ємів кисню.
+ 5О2 = 10С + 12Н2О
нення — чадного газу: С5Н11ОН + 5О2 = 5СО + 6Н2О
Отже, якщо
під
кількості).
Якщо в закритому приміщенні
тривалий час
то за кілька
продукти згоряння
легші за холодне повітря: вони здіймаються трубою
та вивільняють місце для свіжого повітря
галюцинації.
з інформацією
250. За наведеною в параграфі інформацією зробіть припущення щодо можливих напрямів застосування чадного газу. Перевірте свої гіпотези за додатковими джерелами інформації.
251. Дізнайтеся про механізм отруйної дії чадного газу на людину, симптоми отруєння та домедичну допомогу постраждалому. Створіть пам’ятку та презентуйте її в класі.
252. Знайдіть інформацію про способи виявлення чадного
253. Порівняйте фізичні властивості чадного
254.
правильним є твердження: чим більша масова частка Карбону в речовині, тим більша ймовірність утворення кіптяви?
255. Бензин є сумішшю вуглеводнів,
С8Н18. Порівняйте масові частки Карбону в метані
258.
259.
діляється під час реакції, посилює горіння.
На думку Сергія, магній, який
кислим газом, оскільки
А ти знаєш, що газ, яким ми користуємося на кухні, складається переважно з метану? Начебто звичайний газ, але про нього багато говорять у медіа… Але чому так? Нумо дізнаватися! Напевно, не такий він простий. Але знаю, що він може бути як корисним, так і небезпечним. Фізичні властивості
Метан
Метан: безбарвний газ без смаку та запаху;
ми, зокрема, у кишечнику людини.
Дізнайтеся більше
Газогідрати є к латратними сполуками (від лат. clathratus — той, що закритий ґратками, посаджений у клітку), або сполуками включення. Клатратними називають сполуки, у яких маленькі молекули (такі як у метану) розміщені в порожнинах між
266.
267. Обчисліть мінімальний об’єм метану (н. у.),
кг.
269.
270.
Будова танків за типом «термоса» необхідна, аби рідина всередині якомога менше нагрівалася для запобігання надлишковому випаровуванню. Випаровування скрапленого газу
274. Як ви вважаєте,
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
органічні речовини в ґрунтах (їх зазвичай називають гумусом, він зумовлює родючість ґрунтів) неорганічні речовини, зокрема, у складі карбонатів: соди, кальциту, мармуру, крейди тощо
сполуки Карбону («газуватий»
газу у Світовому океані
поглинаються організмами
під час фотосинтезу. Також
багато вуглекислого газу
перетворюється на карбонат-
ну кислоту та споживається
тваринами (молюсками,
кораловими поліпами тощо),
які «переробляють» його на
кальцій карбонат. Цей кальцій
карбонат стає основою їхніх
черепашок (мушель), ендой екзоскелетів тощо.
Відмерлі рештки молюсків,
Біогенний вуглекислий газ виділяється в процесах:
дихання організмів;
гниття решток організмів і бродіння;
окиснення гумусу киснем повітря.
Абіогенний вуглекислий газ виділяється переважно внаслідок лісових пожеж і вулканічної діяльності.
Антропогенні джерела вуглекислого газу в атмосфері:
згоряння палива (деревини, вугілля, бензину тощо) в автівках, на теплоелектростанціях, під час опалювання помешкань тощо;
хімічні
спалювання сміття й опалого листя.
Крізь чисту атмосферу
від Сонця
потрапляє
випромінювання 343 Вт/м2
рівня Світового океану.
і кількість екстремальних
ганів, які вже відбуваються в різних
зами, почастішають у майбутньому (мал. 22.4).
Природозахисники й природозахисниці звертають
необхідність обмеження викидів
У 1998–1999 роках майже всі
підписали Кіотський
Для досягнення цієї
ти енергоощадні технології, замінювати викопне
ходів (процеси анаеробного гниття). Робота з інформацією
276. У додаткових джерелах знайдіть інформацію про перли: як вони утворюються, як їх добувають і використовують. Підготуйте ілюстроване повідомлення.
277. У додаткових джерелах дізнайтеся, як виробництво
278.
впливає на парниковий ефект.
слід модернізувати для зменшення цих обсягів.
280. Знайдіть потрібну інформацію
281.
283.
існує певна рівновага. Температура в Арктиці зростає майже вдвічі швидше, ніж у середньому на планеті. Унаслідок цього швидше тануть арктичні льодовики та морський лід.
У середньому більшість материкових регіонів нагріваються швидше, ніж океани, через різницю теплоємності води й суші. Попри наявні знання про кліматичні системи, існує ще багато невідомих чинників: приміром, не
між атмосферою, океанами, суходолом і біосферою зрозумілі або передбачувані.
сільськогосподарських культур, розведення великої рогатої худоби, заміна палива в котельній з природного газу
як фреони, у 23 тис. разів більший, ніж у вуглекислого газу. Як ви вважаєте, чому стосовно фреонів наголошують переважно на їхній загрозі озоновому шару, а не на посиленні парникового ефекту? (Про озоновий шар ви можете пригадати
288.
Що є метою нашої роботи?
rnk.com.ua/ 110987
Дослідити залежність між складом газової суміші та парниковим ефектом.
Що нам знадобиться?
Обладнання: великі посудини (трилітрові скляні банки, невеликі акваріуми, пластикові бутилі на 5 л або 10 л), побутові термометри, джерело теплоти (лампи розжарювання, інфрачервоні обігрівачі).
Речовини: пісок, водяна пара (джерело, наприклад, чашка з окропом), вуглекислий газ (джерело, наприклад, апарат Кіппа).
Визначаємо ризики Ви маєте працювати з електричними
4.
5.
2.
варто пам’ятати,
Декарбонізація
карбонізації.
і киснем (мал. 23.1).
Сьогодні в деяких країнах уже можна побачити автобуси на таких
електрогенераторах (мал. 23.2).
Поміркуйте
Пригадайте способи одержання водню. Як ви вважаєте, чи матиме одержаний у промисловості водень вуглецевий слід? Мал. 23.2. Міський транспорт, у якому джерелом енергії є водневі паливні
292.
293.
Сформулюйте гіпотезу щодо існування такої залежності.
нам знадобиться?
Обладнання: ваги, мірний посуд, хімічні склянки, скляна
шпатель, фільтрувальний папір, лійка.
Речовини: розчини соди (натрій карбонату Na2CO3) і
з масовою часткою 5 %, дистильована вода.
1.
2. Кальцій хлорид реагує із содою: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Обчисліть об’єм розчину соди, необхідний для реакції з кальцій хлоридом. (Припустіть, що густина розчинів дорівнює густині води. Для довідки див. приклад 4 на с. 58.)
3. Налийте в склянку розчин кальцій хлориду об’ємом, значення якого ви обрали, та додайте до
розчин соди об’ємом у 1,5 раза більший за обчислений.
4. Визначте масу фільтрувального папірця, який
ристовувати для фільтрування осаду.
5. Відфільтруйте одержаний осад, промийте
тильованою водою об’ємом 5
для висихання. Подальші дії виконайте наступного уроку.
6. Обчисліть за рівнянням
утворитися з використанням
кальцій хлориду того
г/см3).
7. Визначте масу одержаного
8.
1.
2. Навіщо відфільтрований
3. Навіщо окремо зважувати фільтрувальний папір?
4. Поясніть отримане значення відносного виходу
5. У яких межах може варіювати вихід продукту реакції?
Рефлексуємо
Що нового ви дізналися під час цього дослідження?
Де вам можуть знадобитися
1. Візуалізація
2. Моделювання періодичної
елементів: створення електронного варіанта періодичної таблиці, у якій за QR-кодами можна дізнатися інформацію про хімічні елементи.
Інформація про субатомні частинки. Відкидні сторінки з прикладами різних хімічних елементів (приміром, Гідроген, Гелій тощо) із зазначенням числа протонів, нейтронів і електронів.
Поміркуйте
Частинки, з яких складаються ядра атомів, називають
нами (від лат. nucleus — ядро). Існують нуклони двох видів.
Протони (позитивно заряджені частинки із зарядом +1)
Нейтрони (частинки без електричного заряду, за масою
число: А(210Pb) = 210. Оскільки порядковий
82. Число нейтронів: N = A – Z = 210 – 82 = 128. Відповідь
Наприклад, у ядрі
і 15N) тощо. А деякі хімічні елементи представлені
природним нуклідом, наприклад Флуор (19F), Натрій (23Na) тощо.
Дізнайтеся більше
Те, що ядро
початку XX століття. Експериментально першими це підтверди-
301.
302.
303. У природних речовинах на Землі знайдено 92 хімічні елементи, проте в періодичній таблиці наведено
інформацію
як дізналися про існування хімічних елементів, які не існують
хімічний елемент, із-поміж таких, яких немає на Землі, було відкрито першим? Чи можуть бути відкриті ще нові хімічні елементи?
304. Порівняйте поняття, склавши для них діаграми Венна: а) «атом» і «хімічний елемент»; б) «електрон» і «протон»; в) «протон» і «нейтрон».
305. Атом Карбону містить 6 електронів. Чому дорівнює заряд: а) атома Карбону; б) ядра атома Карбону?
306. Запишіть позначення нукліда, якщо ядро атома містить: а) 2 протони й 1 нейтрон; б) 8 протонів і 9 нейтронів; в) 15 протонів і 16 нейтронів; г) 35 протонів і 45 нейтронів; д) 25 протонів і 30 нейтронів; е) 89 протонів і 117 нейтронів.
307. Визначте склад атомів таких нуклідів: 17O, 14C, 137Cs, 60Co, 130I, 65Zn, 19F, 56Fe, 39K, 90Sr, 206Pb, 40Ca, 294Ts.
308. Чим відрізняються за складом ядра атомів нуклідів: а) Літію 6Li і 7Li; б) Урану 235U і 239U?
309. Запишіть символи нуклідів: а) Натрію, який
що
313. Чи можливо, на вашу думку, за значенням відносної атомної маси хімічних елементів передбачити нукліди, якими представлений цей елемент у природі? Якщо відносна атомна маса Бору дорівнює 10,81, то які існують природні нукліди Бору? 314. Нукліди можуть бути стабільними
315.
316.
317. У молекулі води можуть міститися різні нукліди Гідрогену
води з різною відносною молекулярною масою. Скільки різних молекул може утворитися із цих нуклідів: а) за складом; б) за масою? 318. Під час перегонки (дистиляції)
«Кексова» модель атома Вільяма Томсона (1902), який уявляв атом
як згусток позитивно зарядженої матерії, у якому рівномірно
який уявляв атом як згусток позитивно зарядженої матерії, де рівномірно розподілені електрони, наче родзинки в кексі; б — «кексова» модель, удосконалена Джозефом Джоном томпсоном (1904), у якій електрони розміщені в одній площині й утворюють концентричні кільця; в — модель атома Хантаро нагаока (1904), який припустив, що атом схожий на планету
розподілені електрони, наче родзинки в кексі.
320. Планетарну модель
«Кексова» модель, удосконалена Джозефом Джоном Томсоном (1904), у якій електрони розміщені в одній площині й утворюють концентричні кільця.
(1904), у якій електрони розміщені в одній площині
б — «кексова» модель, удосконалена Джозефом Джоном томпсоном (1904), у якій електрони розміщені в одній площині
Модель атома Хантаро Нагаока (1904), який припустив, що атом схожий на планету Сатурн: половину
можна пояснити
моделі Дж. Дж. Томсона? У чому її переваги?
Як Е. Резерфорд міг перевірити
які ми спостерігаємо у Всесвіті (наприклад, у зорях)?
321. Скільки електронів міститься на зовнішньому енергетичному рівні атомів: а) Гелію; б) Літію; в) Берилію; г) Бору; д) Карбону; е) Оксигену; ж) Арсену; и) Стануму; к) Барію?
322. Скільки енергетичних рівнів зайнято електронами в атомах: а) Карбону, Силіцію, Германію; б) Берилію, Магнію, Кальцію; в) Флуору, Хлору, Йоду?
323. Назвіть два хімічні елементи, в атомах яких повністю заповнені електронами зовнішні енергетичні рівні.
324. Для хімічних елементів № 1–20 визначте: а) число електронних пар на
325.
326.
Я вже зрозумів, що періодична таблиця — це джерело хімічних знань. Цікаво, чи є в ній щось, поки нам не відоме? Гадаю, що є. Бо подібність будови електронної оболонки атомів у періодах і групах
мітили ще до відкриття електронної будови, тому певні хімічні
1 He
2Li NOFNe
3Na PSCl Ar
4K
7 Fr Ra Mc Lv Ts Og 1 —
2
3 —
Лужні елементи:
найактивніші металічні елементи;
перетворюються на катіони із зарядом 1+;
утворюють луги.
Загальні формули сполук:
оксидів — Е2O;
гідроксидів (лугів) — ЕOH.
Лужні метали:
легкі, м’які;
надзвичайно хімічно активні.
Літій Li
Натрій Na
Калій K Рубідій Rb
Цезій Cs
Францій Fr
Метали, утворені цими хімічними елементами, також називають лужними. Вони
Елементи-галогени:
оксидів — Е2O7 (крім Флуору);
летких сполук із Гідрогеном — HЕ.
Прості
Для елементів-галогенів також характерні
сті, зокрема, усі вони перетворюються
329.
330.
332. Із переліку хімічних елементів випишіть окремо: а) лужні елементи; б) лужноземельні елементи; в) галогени; г) інертні елементи.
Br, Na, Al, Ca, S, Xe, K, Cl, I, Li, Ba, Ne, Be, Rb, Sr, F, Fe, He, H.
333. Калій за слабкого нагрівання бурхливо реагує із сіркою, а розплавлений калій згоряє в атмосфері хлору. Запишіть хімічні рівняння цих реакцій.
334. У перекладі з грецької гало означає «сіль», халько — «мідь», пнікто — «задушливий», генеа — «народження». Яке значення, на вашу думку, мають назви родин «галогени», «халькогени» та «пніктогени»? Чому ці родини було названо саме так?
335. Уявіть, що перед вами однакові за формою та розміром зразки літію та заліза. Як відрізнити ці речовини, ґрунтуючись лише на відмінностях їхніх фізичних
336. У перекладі з грецької
і віддавати
Проста речовина, утворена Натрієм,
хімічна активність натрію
на зовнішньому рівні
лише одного
для Флуору характерним є процес приєднання електрона. Так,
121314151617
341.
347.
348.
нію та оболонкою: а) атома Магнію; б) атома Неону; в) йона Са2+; г) аніона О2–? Якщо відмінність існує, то в чому вона полягає?
349. Чому хімічні елементи Флуор і Хлор мають подібні властивості? У чому полягають відмінності
з подібними
елементи) не з’являються
(регулярно) повторюються. Виявилося,
так само закономірно (через певний інтервал) повторюються хімічні властивості сполук елементів.
Проаналізуймо, які закономірності
вавши хімічні елементи другого
Аналізуючи цю послідовність, можна виявити, що залежність
декілька прикладів такого
кон було сформульовано інакше.
Таблиця 9. Передбачені
Характеристика
Властивості простої речовини
Характеристика оксиду
Характеристика хлориду
тугоплавкий метал, густина — бл. 5,5 г/см3
тугоплавкий
густина — 5,35 г/см3
Формула оксиду — EO2, густина — бл. 4,7 г/см3, оксид має доволі легко відновлюватися до металу Формула оксиду — GeO2, густина — 4,7 г/см3, оксид відновлюється
ECl4 має бути рідиною з температурою
350.
351.
реакцій із водою. Які властивості характерні для продуктів реакцій?
352. Який хімічний елемент за властивостями
Алюміній, Фосфор, Германій чи Титан? Відповідь поясніть.
353. У якого хімічного елемента сильніше виражені металічні (або неметалічні) властивості: а) у Бору чи Алюмінію; б) в Арсену чи Нітрогену; в) в Арсену чи Стибію? Відповіді обґрунтуйте.
354. Порядкові номери хімічних елементів А
355.
356.
2.
з прикладами різних типів
3.
чотириста років
ся відштовхуванням двох по-
зитивно заряджених ядер.
В утвореній молекулі водню
електрони переважно перебу-
вають у просторі між ядрами й начебто «склеюють» їх,
не дають атомами розлетітися. Так між атомами Гідрогену виникає хімічний зв’язок (мал. 29.1). Хімічний
Мал. 29.1. Для утворення
атомів перекриваються, а в утвореній молекулі електрони притягують ядра двох атомів
нуть змінити електронну оболонку
таку, як в атомів найближчого
ного елемента, віддаючи
приєднуючи електрони. Лише в цьому разі утворюються стійкі молекули / йони.
Це твердження називають правилом октету Льюїса
елементів (окрім Гелію) містять на
зовнішньому рівні
стійка, а
пов’язане з тим, що
360. До електронної оболонки атомів яких інертних елементів прагнуть атоми Літію, Оксигену, Кальцію, Алюмінію, Хлору? Атоми цих елементів будуть віддавати чи приєднувати електрони під час утворення хімічних зв’язків?
361. Визначте число електронів, які можуть віддати атоми Літію, Магнію, Калію, Алюмінію, Фосфору, Хлору.
362. На уроці хімії учні й учениці за графіком аналізували
притягання хімічно незв’язаних атомів Гелію і сполучених
у молекулу атомів Гідроге-
ну та зробили певні висновки. Оцініть, чи правильно
міркують.
Притягання між атомами
Гідрогену в
понад 5000 разів сильніше, ніж
між атомами Гелію.
Відстань між атомами Гід-
рогену в молекулі майже в 4 рази менша, ніж між
двома атомами
1 ангстрем (Å) = = 10 –10 м
у спільні електронні пари, що належать одночасно
Н–Н
Між атомами Гідрогену утворюється одна спільна електронна
нарним, або простим. Атоми неметалічних
364.
365.
366. Скільки неспарених електронів
а) атом Флуору; б) молекула фтору?
367. Чому не можуть існувати двоатомні молекули, утворені інертними хімічними елементами?
368. Електрони якого енергетичного рівня утворюють
атомами в: а) молекулі водню; б) молекулі хлору?
369. Запишіть формули Льюїса для молекул: хлороводню HСl, сірководню H2S, амоніаку NH3. Скільки спільних і неподілених
тронних пар містять атоми
випадку?
370. Дано три електронні формули: а) X Y ; б) Z Z ; в) A A .
із речовин — NH3, HCl, О2, F2, N2, H2, HBr, Cl2 — відповідають ці електронні формули? Яким речовинам
жодна електронна формула?
371. В атомах Карбону на зовнішньому
HH H FFF
рою. Такий ковалентний
утворених
приклад, H2, N2, O2, S2),
1,780,960,760,46
372. Поясніть, від чого залежить полярність ковалентного зв’язку. Відповідь аргументуйте.
373. Як визначити, на якому з атомів, сполучених ковалентним зв’язком, з’являється надлишковий негативний заряд, а на якому — позитивний?
374. Запишіть формули речовин за збільшенням полярності зв’язку в молекулах: H2O, CH4, HF, NH3.
375. Випишіть окремо формули речовин із полярним і неполярним зв’язком: S8, NH3, O2, OF2, F2, ClF3, P4, NO2, NO, N2.
376. Користуючись форзацем 1, обчисліть різницю між електронегативностями елементів у парах: Li–Cl, Be–Cl, B–Cl, C–Cl, N–Cl, O–Cl, F–Cl. Укажіть пару елементів із найбільш полярним і найменш полярним зв’язками.
377. Визначивши різницю електронегативностей, зазначте формулу найполярнішої молекули: H2, HCl, HF, ClF, Cl2, F2.
378.
зв’язку: йодоводень HI, хлороводень HCl, бромоводень HBr, вода H2O, сірководень H2S, хлор Cl2, метан CH4, фосфін PH3.
379.
380.
381.
до інертних газів. Азот навіть іноді використовують
382. Чим, на вашу думку, зумовлена така характеристика хімічних елементів, як електронегативність? Чому вона змінюється
ріодах і групах? Назвіть
хімічні елементи. Відповідь обґрунтуйте. Я мав рацію! Виявилося,
залишається електронейтральною. Точно! Важливо, що полярність ковалентного зв’язку виникає через нерівномірне притягання електронів спільних електронних пар атомами, яке залежить від їхньої електронегативності.
Важливою характеристикою
4.
5.
6.
2.
3. Складаємо рівняння для обчислення невідомого заряду. Слід пам’ятати, що ступінь
1.
2.
3.
цього елемента
4.
хімічний
в назвах зазначають або заряди йонів: Fe2O3 — ферум(3+) оксид, Ag2O — аргентум(1+) оксид;
окиснення
позна-
383. Порівняйте поняття «ступінь окиснення» й «заряд йонів», склавши
384.
а) H2, H2O, HCl, NaOH, NaH; б) PH3, NO2, H2O2; в) HCl, Cl2, CuCl2, KClO3; г) N2, N2H4, N2O3, HNO3.
385.
386.
387. Обчисліть ступені
CH3Cl, CH2Cl2, C2H5Cl, C2H2Cl4, С2Cl6. (Візьміть до уваги, що в усіх цих сполуках ступінь окиснення Гідрогену — +1, а Хлору — –1.)
388. Хімічна номенклатура впродовж кількох століть зазнавала суттєвих змін. Зокрема, сполуки з Оксигеном — оксиди — раніше називали інакше. Проаналізуйте назви оксидів. Закис
порядку — утворюють кристалічні ґратки; мають певну температуру плавлення; утворюють кристали певної форми; у разі руйнування кристалічної речовини
кристали розпадаються на окремі шматочки, кожен із яких зберігає хоча б частково форму початкового кристала;
приклади речовин: кухонна сіль, цукор, харчова сода, кварц, гіпс.
Кварц Структурні одиниці в кристалічних речовинах утворюють правильні геометричні фігури Аморфні речовини не мають чіткої просторової структури,
які мають
температуру плавлення, аморфні речовини плавляться в широкому інтервалі температур. Під час нагрівання
розм’якшуються і нарешті стають рідкими. Аморфним речовинам, як і рідинам, можна надати будь-якої форми.
Аморфні речовини:
не мають чіткої просторової
температур;
за нагрівання спочатку розм’якшуються;
391.
дамасма означає «скорення, приборкування», дамао — «розтрощую», а адамас — «незламний». У перекладі з французької brilliant означає «блискучий». Висловіть припущення, чому мінерал алмаз багатьма мовами називають адамантом, а оброблений алмаз називають діамантом, або брильянтом.
393. Грецькою
394. Чому аморфні речовини
395. Як ви розумієте твердження: «Кристалічним речовинам
на надати будь-якої форми»?
396. Чи є аморфними такі речовини: віск, парафін, сухий
етилен, скло, кухонна сіль, тверде мило?
ми цих речовин
397. Чому за швидкого
йоду — з двохатомних
(мал. 34.1).
Молекулярні кристалічні
валентними зв’язками (полярними й неполярними). Вони властиві більшості органічних сполук, а також деяким неорганічним речовинам
ню, хлору, азоту тощо).
Особливістю
У вузлах атомних кристалічних ґраток розташовані атоми, сполучені між собою міцними ковалентними зв’язками. Щоб зруйнувати ці
ковалентні зв’язки, необхід-
на значна енергія. Цим пояснюється міцність атомного
кристала та високі температури плавлення й кипіння речовин
між атомами в ґратках — ковалентний; надзвичайно тверді, нелеткі;
тугоплавкі;
не розчиняються в жодному розчиннику.
досить тверді, непластичні й некрихкі.
Будовою кристалічних ґраток
400. Якими взаємодіями утримуються: а) атоми в молекулі; б) молекули в молекулярному кристалі; в) атоми в атомному кристалі?
401. Поясніть, чому кварц SiO2 і вуглекислий газ CO2 мають різні фізичні властивості, попри подібний склад.
402. Випишіть окремо формули речовин із різними кристалічними ґратками в твердому стані: F2, CO2, He, C (графіт), HBr, S8 (сірка), H2, SiO2, O3.
403. Чи можна замінити: а) силіцій(IV) оксид на карбон(IV) оксид для виготовлення скла; б) алмаз на графіт для виготовлення бурів для свердління? Обґрунтуйте свою відповідь.
404. За текстом параграфа проілюструйте
речовин. Поясніть логічний
хімічний склад
Багато
неполярним уважають також зв’язок між атомами різних неметалічних елементів за умови, що різниця між електронегативностями елементів (ΔEH) не перевищує 0,4.) Якщо
(NaCl, NaNO3, K2 SO4, KOH, NaOH, CaO).
Йонні кристали:
у вузлах ґраток — йони (катіони й аніони);
тип зв’язку — йонний;
тверді, крихкі, нелеткі;
тугоплавкі;
деякі розчиняються у воді.
406. Порівняйте
і йонний зв’язки, склавши для них діаграми Венна.
407. Наведіть по дві формули сполук, у яких Оксиген утворює зв’язок: а) йонний; б) ковалентний.
408. Із-поміж
ком. HBr, Na2O, CaO, CO2, CO, NO2, K3N, NH3, N2, NF3, MgF2.
409. Зобразіть схему
1Парафін
2
4 Цукор 186—1,59гарнапогана
5Графіт 4000—2,2нерозчиннийнерозчинний
8
rnk.com.ua/
фізичними властивостями.
Що нам знадобиться
Обладнання: пробірки, пальник, хімічний стакан, порцелянова чаша, термометр, прилад для визначення електропровідності, молоток. Речовини: натрій хлорид, цукор, графіт, силіцій(IV) оксид, парафін, вода, лід.
Визначаємо ризики
1.
2.
молекулярна маса Мr — величина, що дорівнює відношенню маси певної молекули до 1/12 маси атома Карбону-12.
Електроліз — процес розкладання розчинених або розплавлених речо-
вин під упливом електричного струму.
Електронегативність — здатність
пари.
Ізотопи — різні нукліди одного хімічного елемента.
Індикатор
іншої речовини в розчині (кислоти, лугу
Йон
заряд.
Каталізатор — речовина, що змінює швидкість хімічної реакції, але сама в ній не витрачається.
Кількість речовини — фізична величина, що характеризує число однотипних частинок речовини (атомів, молекул, йонів тощо).
Моль — кількість речовини (порція), що містить 6,02 · 1023 структурних частинок цієї речовини (атомів, молекул або йонів).
Молярна маса — маса речовини кількістю 1 моль.
Молярний об’єм Vm— об'єм речовини кількістю 1 моль. Нуклід — різновид атомів із певним
Атмосфера 63
Атом 8, 108
Атомна одиниця маси 26
Б
Бінарні сполуки 20
Біопаливо 215
В
Відносна атомна маса 27
Відносна молекулярна маса 28
Водень 135
Вуглекислий газ 169
Вуглецевий слід 213
Г
Горіння 83
Д
Декарбонізація 214
Е
Електроліз 72
Електрон 224
Електронегативність 287
Енергетичний рівень 238
З
Закон
Авоґадро 110
об’ємних співвідношень 111
Періодичний 267
І
Ізотопи 231
Індикатор 125
Й
Йон 9, 309
К
Каталізатор 71
Кислоти 122
Кількість речовини 48
Л
Леткі сполуки з Гідрогеном 134
Масова частка хімічного
в речовині 34
Метан 193
Молекула 9
Моль 47
Молярна маса 49
Молярний об’єм 111
Н
Нейтрони 225
Нукліди 228
Нуклони 225
О
Оксиди
кислотні 121
основні 123
Орбіталь 239
Основи 123
П
Парниковий ефект 205
Період 267
Повільне окиснення 89
Повітря 64
Протони 225
Р
Ряд активності металів 158
Речовини
аморфні 300
атомної будови 305
йонної будови 312
кристалічні 300
молекулярної будови 303
Родини хімічних елементів 249
С
Солі 150
Ступінь окиснення 293
Т
Трикутник вогню 86
Х
Хімічний елемент 227
Хімічний зв’язок 275
йонний 310
ковалентний 281
Ч
Чадний газ 185
Я
Ядро атома 224
§ 1. 3. 1,2 г; 2 г. 4. 4.1. 211,75 г; 4.2. 12 см3, 19,25 г/см3; 4.4. 13,24 г/см3; 4.5. Au (вольфрам не пластичний), виріб із суміші золота із додаванням срібла або міді. 5. A — тирса, B — глина, C — сіль, D — залізо.
§ 3. 18. а) Нітрогену в 3,5 рази; б) Сульфуру у 2 рази; в) Феруму у 2 рази; г) Купруму у 2 рази. 19. 4. 20. а) 71; б) 98; в) 342; г) 64; д) 136; е) 100; ж) 222. 21. а) 58,5; б) 200; в) 461; г) 102; д) 76. 22. H2O2. 23. FeS2. 24. 202. 25. а) так; б) так. 26. Права шалька опуститься донизу.
§ 4. 27. а) 30,4 %, 69,6 %; б) 74,5 %, 25,4 %; в) 43,4 %, 11,3 %, 45,3 %; г) 2,04 %, 32,65 %, 65,31 %; д) 68,4 %, 10,3 %, 21,3 %. 28. 53,3 %, 51,5 %. 29. 46,7 %.
30. 1,76 г. 31. 0,786 г. 32. 700 кг. 35. 16,5%, 35%.
§ 5. 36. а) CrO3; б) Fe2O3. 37. а) N2O3; б) C3H8. 38. CuFeS2. 39. Fe3O4. 40. CaCl2.
§ 6. 42. а) 34 г/моль; б) 17 г/моль; в) 38 г/моль; г) 100 г/моль; д) 64 г/ моль; е) 40 г/моль; ж) 174 г/моль; и) 242 г/моль; к) 118 г/моль. 43. а) 0,125 моль; б) 0,75 моль; в) 5 моль; г) 119 моль. 44. а) 4 г; б) 96 г; в) 45 г; г) 256,5 г; д) 15,76 г. 45. а) 63,5 г/моль; б) 24 г/моль; в) 32 г/моль. 46. а) 96 г, 56 г; б) 90 г, 99,4 г; в) 56 г, 60 г. 47. а) 6 моль; б) 0,5 моль. 49. а) 2 моль; б) 2 моль; в) 2 моль; г) 6 моль. 50. СН4.
§ 7. 53. 2 : 1. 54. 1 моль, 2,5 моль. 55. а) 0,5 моль; б) 0,125 моль. 56. 576 г, 336 г, 648 г. 57. 11,85 г. 58. 15 г, 20 г, ≈1,33 рази. 59. 9,12 г. 60. ≈ 3,9 кг. 61. 37,8 г. 63. 56 г, 32 г.
§ 9. 76. ≈ в 1,11 раза. 77. а) 25 г; б) 13,3 %. 78. 40,5 %, 39,2 %. 79. а) 392 г, 274 л; б) 101 г, 70,6 л. 86. Шалька зі склянкою опуститься вниз.
§ 10. 98. 11,2 г. 99. 14,4 г.
§ 11. 121. 1050 годин.
§ 13. 137. а) 44,8 л; б) 11,2 л; в) 5,6 л; г) 64,96 л; д) 94,08 л. 138. Найбільша — із
SO2. 139. 25,5 г. 140. а) 112 л; б) 224 л. 141. В 1,25 раза. 143. 300 л.
§ 15. 161. 0,03125 моль, 0,5 моль, у 16 разів. 166. 0,000168 %. 167. 0,627 %. 171. У паладії — 3036 г водню.
§ 16. 180. 67,2 м3. 181. 16,25 г. 182. 123,2 л. 183. 1 м3 ≈ 1,6 кг. 184. 672 м3. 185. 101 г, 69,2 г.
§ 17. 197. 0,03 моль. 198. а) 137,2 г; б) 54,6 г; в) 120 г. 200. 45 г. 201. 4 %.
§ 18. 214. 3,25 г. 215. 3,57 кг. 216. 33,6 л. 217. 0,5 моль, 60 г, 11,2 л. 218. 0,2 моль. 219. 12,32 л. 220. 1,08 г, збільшиться на 0,755 г.
§ 19. 233. 5 кг. 234. 4,34 г, 2,67 л. 235. 83,25 г. 236. 1271,2 г. 237. 2,5 кг.
§ 20. 256. 386 л.
§ 21. 266. 56 л. 267. 1,1 м3. 275. 168 л.
вимоги до друкованої продукції для дітей»
Редактор Т. М. Мишиньова. Технічний редактор А. В. Пліско. Художнє оформлення В. І. Труфена, Т. В. Задорожної. Комп’ютерна верстка І. І. Пікальова. Коректор Н. В. Красна.
Підписано до друку 22.05.2025. Формат 70×90/16. Папір офсетний. Гарнітура Шкільна. Друк офсетний. Ум. друк. арк. 23,33. Обл.-вид. арк. 16,26. Наклад 325 527 пр. Зам. № 9704-2025.
ТОВ Видавництво «Ранок», пр. Незалежності, 5, Харків, 61022; вул. Деревлянська, 13, Київ, 04119. E-mail: office@ranok.com.ua
61052.
Тел. +38 (057) 712-20-00. Е-mail: triadakniga@ukr.net
Хімія 8
підручник для 8 класу закладів
Навчально-методичний комплект